β-Lactam-Antibiotika
Die β-Lactam-Antibiotika, auch Azetidin-2-one, sind eine Gruppe von Antibiotika/antibakteriellen Antiinfektiva, die alle in ihrer Strukturformel einen viergliedrigen Lactam-Ring aufweisen. Sie gehen auf das Penicillin zurück, das der schottische Bakteriologe Alexander Fleming 1928 aus Kulturen des Schimmelpilzes Penicillium notatum extrahierte, welches zugleich den wichtigsten und bekanntesten Vertreter dieser Gruppe darstellt. Sie wirken alle bakterizid, indem sie die Peptidoglycansynthese bei der Zellteilung hemmen. Unterschiede in der Wirksamkeit begründen sich vor allem durch differente Affinität und Penetrationsfähigkeit. β-Lactam-Antibiotika werden heutzutage überwiegend halbsynthetisch erzeugt.
| Stoffgruppe der Azetidin-2-one |
|---|
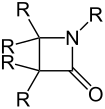 Azetidin-2-one (β-Lactam) |
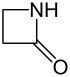 Azetidin-2-on |
Zugleich bilden die Azetidin-2-one eine Stoffgruppe in der organischen Chemie.
Geschichte
Um 1940 entwickelten Howard Walter Florey und Ernst Boris Chain Medikamente auf Basis des Penicillins, welche ein Jahr später zum ersten Mal therapeutisch eingesetzt wurden. Dafür erhielt Fleming 1945, gemeinsam mit den zwei anderen Wissenschaftlern, den Nobelpreis für Medizin. Damals wurden Penicillinpräparate häufig falsch eingesetzt, besonders auch gegen Krankheitserreger, die von Natur aus gegen β-Lactam-Antibiotika resistent sind. Mehrfach entwickelten ursprünglich empfindliche Krankheitserreger Antibiotikum-Resistenzen gegen die eingesetzten β-Lactampräparate. Es wurden daher im Laufe der Zeit bereits verschiedene „Generationen“ von β-Lactampräparaten entwickelt, da die vorher eingesetzten Präparate keine zuverlässige Wirkung mehr zeigten.
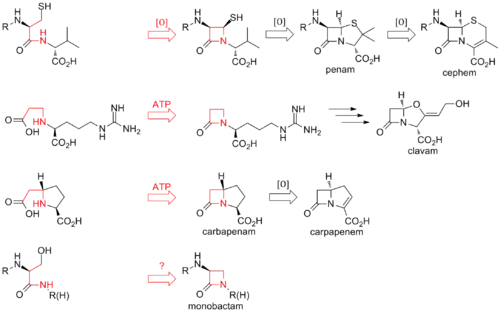
Biosynthese
Wirksamkeit
Alle β-Lactam-Antibiotika sind unwirksam gegen Mykoplasmen, Chlamydien und Legionellen. Daneben existieren auch bei manchen anderen Bakterien erworbene Resistenzen, die auf einer β-Lactamase beruhen. Bei hohen Konzentrationen an Bakterien kommt es bei β-Lactam-Antibiotika zu einer Abnahme der Wirkung, die als Eagle-Effekt bezeichnet wird.
Nebenwirkungen
β-Lactam-Antibiotika sind in der Regel für den Menschen gut verträglich, was auf den Wirkungsmechanismus zurückzuführen ist. Sie greifen in die Zellwandsynthese von sich teilenden Bakterien ein – dieser Stoffwechselvorgang kommt beim Menschen nicht vor. Jedoch existieren inzwischen viele Allergien gegen Penicillin und verwandte Substanzen, die von leichten Hautreaktionen bis zum anaphylaktischen Schock in allen Schweregraden reichen können. Auch muss mit Kreuzallergien zwischen den einzelnen β-Lactam-Antibiotika gerechnet werden.
Einteilung
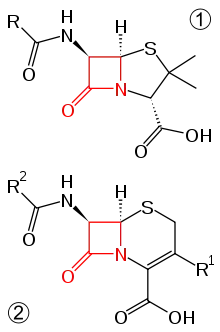
Man unterscheidet heute folgende vier Gruppen von β-Lactam-Antibiotika: Penicilline, Cephalosporine, β-Lactamase-Inhibitoren und sonstige β-Lactam-Antibiotika.
Penicilline
- β-Lactamase-sensitive (-instabile) Penicilline
- Benzylpenicillin (Penicillin G)
- Phenoxymethylpenicillin (Penicillin V)
- Propicillin
- Azidocillin
- β-Lactamase-resistente (-stabile) Penicilline
- Breitbandpenicilline oder Breitspektrumpenicilline
- Aminopenicilline
- Ureidopenicilline (Acylaminopenicilline)
- Pivmecillinam
Cephalosporine
- Cephalosporine zur parenteralen Anwendung
- Cephalosporine ohne erhöhte β-Lactamase-Stabilität
- Cephalosporine mit erhöhter β-Lactamase-Stabilität
- Breitspektrumcephalosporine
- Oralcephalosporine
- Oralcephalosporine ohne erhöhte β-Lactamase-Stabilität
- Oralcephalosporine mit erhöhter β-Lactamase-Stabilität
- Cefixim
- Cefuroximaxetil
- Cefetametpivoxil
- Ceftibuten
- Cefpodoximproxetil
β-Lactamase-Inhibitoren
- Clavulansäure in Kombination mit Amoxicillin
- Sulbactam
- Tazobactam in Kombination mit Piperacillin
- Avibactam in Kombination mit Ceftazidim[1]
Sonstige
- Carbapeneme
- Imipenem in Kombination mit Cilastatin
- Meropenem ggf. mit Vaborbactam (entspricht RPX7009)
- Doripenem
- Ertapenem
- Carbacepheme
- Monobactame
Resistenzen und Mechanismen
Während der Anwendung von β-Lactam-Präparaten entwickeln sich nur selten und langsam Resistenzen gegen die jeweiligen Präparate. Insgesamt stellten die Resistenzen gegen β-Lactam-Präparate jedoch inzwischen ein ernsthaftes Problem dar. Hierbei sind drei Resistenzmechanismen zu unterscheiden:
- unempfindliche Penicillin-Bindeproteine
- Membranveränderungen
- Bildung von β-Lactamasen
- β-Lactamasen sind von den Bakterien gebildete Enzyme, die den β-Lactam-Ring der Präparate öffnen. Die β-Lactam-Präparate werden damit unwirksam. Die genetische Information zur Bildung der β-Lactamasen wird chromosomal oder plasmidal vererbt. Je nach der unwirksam gemachten Gruppe von β-Lactam-Präparaten werden die β-Lactamasen als Penicillinasen, Cephalosporinasen oder Carbapenemasen bezeichnet.
Um β-Lactamase-stabile Penicilline zu erhalten, werden voluminöse Gruppen in das Penicillinmolekül eingeführt. Diese neu eingeführten Teile des Penicillinmoleküls behindern durch die veränderte räumliche Struktur des Gesamtmoleküls (sterisch) die Öffnung des β-Lactam-Rings. Ebenfalls möglich ist die Anwendung von β-Lactamase-Hemmstoffen, wie Clavulansäure, Sulbactam oder Tazobactam.
β-Lactam-Antibiotika blockieren nicht nur die Teilung von Bakterien inklusive der Cyanobakterien, sondern auch die Teilung der photosynthetisch aktiven Organellen der Glaucocystaceaen (Cyanellen), sowie der Chloroplasten von Blasenmützenmoosen,[2] Lebermoosen (Marchantia polymorpha[3]) und Moosfarnen (Selaginella nipponica.[4]). Auf die Teilung der Plastiden der höher entwickelten Gefäßpflanzen wie beispielsweise bei Tomaten haben sie jedoch keinen Effekt. Dies ist ein Hinweis darauf, dass bei höheren Pflanzen durch evolutionäre Veränderungen der Plastidteilung β-Lactam-Antibiotika auf Chloroplasten keine Wirkung mehr zeigen.[2]
Literatur
- Claus Simon, Wolfgang Stille: Antibiotika-Therapie in Klinik und Praxis. 10. Auflage. Schattauer, Stuttgart 2001, ISBN 3-7945-1970-1.
- Peter Imming: Wie macht der Pilz das Penicillin? Aktuelle Forschung, Trends bei β-Lactam-Antibiotika. Biosynthese der Penicilline und Cephalosporine. Pharmazie in unserer Zeit 18(1), S. 20–24 (1989).
Einzelnachweise
- Avoxa-Mediengruppe Deutscher Apotheker GmbH: Avibactam|Zavicefta®|10|2017. Abgerufen am 18. November 2020.
- Kasten, Britta und Reski, Ralf (1997): β-lactam antibiotics inhibit chloroplast division in a moss (Physcomitrella patens) but not in tomato (Lycopersicon esculentum). In: J. Plant Physiol. 150, 137–140; PDF (Memento vom 4. Februar 2012 im Internet Archive) (freier Volltextzugriff, engl.).
- Tounou, E. et al. (2002): Ampicillin Inhibits Chloroplast Division in Cultured Cells of the Liverwort Marchantia polymorpha. In: Cytologia 67; 429–434; doi:10.1508/cytologia.67.429.
- Izumi, Y. et al. (2003): Inhibition of plastid division by ampicillin in the pteridophyte Selaginella nipponica Fr. et Sav. In: Plant Cell Physiol. 44(2):183–189; PMID 12610221; PDF (freier Volltextzugriff, engl.)