Flavivirus
Die Gattung Flavivirus umfasst behüllte Viren mit einem positivsträngigen RNA-Einzelstrang als Genom, die durch Arthropoden (Zecken und Stechmücken) als Vektoren auf Vögel und Säugetiere übertragen werden. Der Name der Gattung und der gesamten Virusfamilie Flaviviridae leitet sich vom Gelbfiebervirus beim Menschen ab (von lat. flavus, „gelb“), das bereits 1904 von Walter Reed als durch Stechmücken übertragbar erkannt wurde.
| Flavivirus | ||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
TEM-Abbildung des West-Nil-Virus | ||||||||||||||||
| Systematik | ||||||||||||||||
| ||||||||||||||||
| Taxonomische Merkmale | ||||||||||||||||
| ||||||||||||||||
| Wissenschaftlicher Name | ||||||||||||||||
| Flavivirus | ||||||||||||||||
| Links | ||||||||||||||||
|
Viren der Gattung Flavivirus verursachen wichtige Erkrankungen bei Tieren und Menschen. Darunter sind Krankheiten, die einem viralen hämorrhagischen Fieber entsprechen oder durch eine Infektion des Zentralnervensystems im Sinne einer Enzephalitis, Meningoenzephalitis oder Leukenzephalitis gekennzeichnet sind. Dies sind neben dem Gelbfieber beispielsweise auch die Frühsommer-Meningoenzephalitis (FSME), die Japanische Enzephalitis, das Dengue-Fieber und das West-Nil-Fieber.[3]
Verbreitung
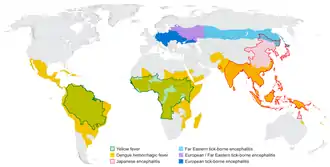
Die Karte zeigt die weltweite Verbreitung von Vertretern der Gattung Flavivirus.
Morphologie
Die Viruspartikel (Virionen) der Flaviviren sind etwa 50 nm im Durchmesser groß und in der elektronenmikroskopischen Darstellung von sphärischer, unregelmäßiger Gestalt. Analysen mittels Kryoelektronenmikroskopie zeigten beim Dengue-Virus eine ikosaedrische Symmetrie der Virushülle, was auf eine Interaktion der Hüllproteine mit den Kapsidproteinen schließen lässt.[4] Das Kapsid ist aus nur einem Kapsidprotein (C, 11 kDa) aufgebaut. In die Virushülle des Virions sind 90 Dimere des E-Proteins (50 kDa) eingelagert. Zwischen diesem Netzwerk der E-Dimere findet sich ein weiteres, kleineres Hüllprotein (M-Protein, 26 kDa).[5]
Genomorganisation
Die positivsträngige RNA ist etwa 11.000 Nukleotide lang und umfasst nur einen Offenen Leserahmen, der für ein Polyprotein codiert. Die virale Protease (N-terminaler Teil von NS3) und wirtseigene Proteasen schneiden dieses Polyprotein in die 3 strukturellen (C, prM, E) und in die 7 nicht-strukturellen Proteine (NS1, NS2A, NS2B, NS3, NS4A, NS4B, NS5); die Aufzählung entspricht der Anordnung der für die Proteine codierenden Gene auf dem Genom.[5] Im Gegensatz zu den anderen Gattungen der Familie Flaviviridae, besitzen Viren der Gattung Flavivirus am 5'-Ende der RNA eine 5'-Cap-Struktur vom Typ 1 (m-7GpppAmp) gefolgt von einem konservierten Dinukleotid AG. Am 3'-Ende findet sich bei Flaviviren im Gegensatz zu den anderen Gattungen kein poly(A)-Schwanz.
Replikation
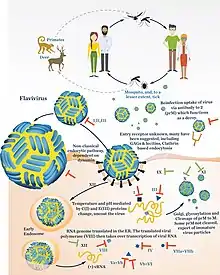
Die Viren befallen unter anderem Monozyten, Makrophagen und Dendritische Zellen. Sie heften sich über spezifische Rezeptoren an der Zelloberfläche an und werden durch ein sich ausbildendes Endosomvesikel aufgenommen. Im Innern des Endosoms induziert der saure pH die Fusion von Endosommembran und Virushülle. Dadurch gelangt das Kapsid in das Zytosol, zerfällt und gibt das Genom frei. Sowohl die Rezeptorbindung als auch die Membranfusion werden durch das Protein E katalysiert, das bei saurem pH-Wert eine Konformationsänderung durchlebt, die dazu führt, dass die 90 Homodimere sich zu 60 Homotrimeren neu organisieren.[5]
Nach dem Eindringen in die Wirtszelle wird das virale Genom im rauen Endoplasmatischen Retikulum und in so genannten vesicle packets repliziert. Innerhalb des ER wird zuerst eine unreife Form der Viruspartikel produziert, bei der das M-Protein noch nicht durch einen Reifungsschritt gespalten wurde und als prM (precursor M) in einem Komplex mit E vorliegt. Die unreifen Partikel werden im Golgi-Apparat durch das Wirtsprotein Furin prozessiert, welches prM zu M schneidet. Dadurch wird E aus dem Komplex entlassen und kann seinen Platz im maturen, infektiösen Virion einnehmen.[5]
Übertragung
Flaviviren können indirekt durch blutsaugende Insekten oder in seltenen Fällen (beispielsweise beim Rio-Bravo-Virus) auch direkt von einem Wirbeltier auf ein anderes übertragen werden. Einige Flaviviren zirkulieren zwischen Nagetieren und Fledermäusen, ohne dass ein weiterer Vektor bekannt ist.
Systematik
Die Viren der Gattung Flavivirus wurde aufgrund ihrer Übertragung durch Gliederfüßer (Arthropoden) früher als Arboviren Gruppe B von den Arboviren Gruppe A unterschieden; aus letzteren ging später die Gattung Alphavirus der Familie Togaviridae hervor.
Die Gattung Flavivirus beinhaltet 89 Virusspezies (Stand 2018; 2009 waren es noch 53 Spezies mit 73 Serotypen). Nach der Art des Vektors (Stechmücke, Zecke), unbekanntem Vektor (NKV-Gruppe: no known vector) sowie auf der Grundlage von phylogenetischen Untersuchungen, werden die Spezies in (nicht-taxonomische) Gruppen klassifiziert. Die englischen Bezeichnungen sind die offiziellen Speziesnamen nach ICTV (International Committee on Taxonomy of Viruses), Stand November 2018.[6][7]
1. Durch Zecken übertragene Flaviviren
- Gruppe der durch Zecken übertragenen Flaviviren bei Säugetieren (Tick-Borne-Enzephalitis-Komplex, TBE)[8]
- Spezies Gadgets-Gully-Virus (en. Gadgets Gully virus, GGYV)
- Spezies Kyasanur-Forest-Disease-Virus (KFD-Virus, en. Kyasanur Forest disease virus, KFDV) mit Subtyp Al-Khurma-Virus
- Spezies Langat-Virus (en. Langat virus, LGTV)
- Spezies Louping-Ill-Virus (en. Louping ill virus, LIV)
- Spezies Omsk-hämorrhagisches-Fieber-Virus (en. Omsk hemorrhagic fever virus, OHFV)
- Spezies Powassan-Virus (en. Powassan virus, POWV)[9] mit Subtyp Deer tick virus (DTV)[10]
- Spezies Royal-Farm-Virus (en. Royal Farm virus, RFV) mit Subtyp Karshi-Virus (KSIV)[11]
- Spezies FSME-Virus (en. Tick-borne encephalitis virus, TBEV) mit Subtyp Absettarov virus (ABSV)
- Gruppe der durch Zecken übertragenen Flaviviren bei Seevögeln[12]
- Spezies Kadam-Virus (en. Kadam virus, KADV)
- Spezies Meaban-Virus (en. Meaban virus, MEAV)
- Spezies Saumarez-Reef-Virus (en. Saumarez Reef virus, SREV)
- Spezies Tyuleniy-Virus (en. Tyuleniy virus, TYUV)
2. Durch Stechmücken übertragene Flaviviren (Mosquito-Borne-Enzephalitis-Komplex, MBE)
- Aroa-Virus-Gruppe
- Spezies Aroa-Virus (en. Aroa virus, AROAV) mit Subtypen Bussuquara virus (BSQV), Iguape virus (IGUV), Naranjal virus (NJLV)
- Dengue-Virus-Gruppe[13]
- Spezies Dengue-Virus (en. Dengue virus, DENV)
- Spezies Kedougou-Virus (en. Kedougou virus, KEDV)
- Japanische-Enzephalitis-Virus-Gruppe[14]
- Spezies Cacipacore-Virus (en. Cacipacore virus, CPCV)
- Spezies Japanisches-Enzephalitis-Virus (en. Japanese encephalitis virus, JEV), Subtypen JAOARS982, M28, Nakayama, SA(V) und SA-14
- Spezies Koutango-Virus (en. Koutango virus, KOUV)
- Spezies Murray-Valley-Enzephalitis-Virus (en. Murray Valley encephalitis virus, MVEV)
- Spezies St. Louis-Enzephalitis-Virus (en. St. Louis encephalitis virus, SLEV) – St.-Louis-Enzephalitis
- Spezies Usutu-Virus (en. Usutu virus, USUV)
- Spezies West-Nil-Virus (en. West Nile virus, WNV) mit Subtyp Kunjin-Virus
- Spezies Yaounde-Virus (en. Yaounde virus, YAOV)
- Kokobera-Virus-Gruppe[15]
- Spezies Kokobera-Virus (en. Kokobera virus, KOKV) mit Subtypen New Mapoon virus (NMV) und Stratford virus (STRV)
- Ntaya-Virus-Gruppe[16]
- Spezies Bagaza-Virus (en. Bagaza virus, BAGV)
- Spezies Ilheus-Virus (en. Ilheus virus, ILHV) mit Subtyp Rocio virus (ROCV): Rocio viral encephalitis[17]
- Spezies Israel-Truthahn-Meningoenzephalitis-Virus (en. Israel turkey meningoencephalomyelitis virus, ITV)
- Spezies Ntaya-Virus (en. Ntaya virus, NTAV)
- Spezies „T'Ho virus“,[18][19] vom ICTV nicht bestätigt
- Spezies Tembusu-Virus (en. Tembusu virus, TMUV) mit Subtypen Duck egg drop syndrome virus (DEDSV, BYDV) und Sitiawan virus (STWV)[20]
- Spondweni-Virus-Gruppe
- Spezies „Spondweni-Virus“ (en „Spondweni virus“, SPONV), vom ICTV nicht bestätigt
- Spezies Zika-Virus (en. Zika virus, ZIKV)
- Gelbfiebervirus-Gruppe[21]
- Spezies Banzi-Virus (en. Banzi virus, BANV)
- Spezies Bouboui-Virus (en. Bouboui virus, BOUV)
- Spezies Edge-Hill-Virus (en. Edge Hill virus, EHV)
- Spezies „Bamaga-Virus“ (en. „Bamage virus“, BgV), vom ICTV nicht bestätigt[22]
- Spezies „Fitzroy river virus“,[23][24] vom ICTV nicht bestätigt
- Spezies Jugra-Virus (en. Jugra virus, JUGV)
- Spezies Saboya-Virus (en. Saboya virus, SABV)
- Spezies Sepik-Virus (en. Sepik virus, SEPV)
- Spezies Uganda-S-Virus (en. Uganda S virus, UGSV)
- Spezies Wesselsbron-Virus (en. Wesselsbron virus, WESSV)
- Spezies Gelbfiebervirus (en. Yellow fever virus, YFV)
3. Flaviviren mit unbekanntem Vektor
- Spezies Entebbe-Fledermaus-Virus (en. Entebbe bat virus, ENTV)
- Spezies Yokose-Virus (en. Yokose virus, YOKV)
- Spezies „Nanay virus“[25]
- Spezies „Tamana-Fledermaus-Virus“ (en. „Tamana bat virus“ TABV), vom ICTV nicht bestätigt
- Modoc-Virus-Gruppe[26]
- Spezies Apoi-Virus (en. Apoi virus, APOIV)
- Spezies Cowbone-Ridge-Virus (en. Cowbone Ridge virus, CRV)
- Spezies Jutiapa-Virus (en. Jutiapa virus, JUTV)
- Spezies Modoc-Virus (en. Modoc virus, MODV)
- Spezies Sal-Vieja-Virus (en. Sal Vieja virus, SVV)
- Spezies San Perlita-Virus (en. San Perlita virus, SPV)
- Rio-Bravo-Virus-Gruppe
- Spezies Bukalasa-Fledermaus-Virus (en. Bukalasa bat virus, BBV)
- Spezies Carey-Island-Virus (en. Carey Island virus, CIV)
- Spezies Dakar-Fledermaus-Virus (en. Dakar bat virus, DBV)
- Spezies Montana-Myotis-Leukenzephalitis-Virus (en. Montana myotis leukoencephalitis virus, MMLV)
- Spezies Phnom-Penh-Fledermaus-Virus (en. Phnom Penh bat virus, PPBV) mit Subspezies Batu cave virus
- Spezies Rio-Bravo-Virus (en. Rio Bravo virus, RBV)
4. Nicht-Wirbeltier-Virus-Gruppe (englisch Non vertebrate viruses)
- Spezies „Soybean cyst nematode virus 5“, vom ICTV nicht bestätigt[27]
5. Weitere nicht klassifizierte Kandidaten für diese Gattung[28]
- Spezies „Mediterranean Ochlerotatus flavivirus“
- Spezies „Nanay virus“
- Spezies „Nounané virus“
- Spezies „Ochlerotatus caspius flavivirus“
- Spezies „Palm Creek virus“
- Spezies „Parramatta River virus“
- Spezies „Aedes flavivirus - NCBI unclassif Flavivirus“
- Spezies „Culex theileri flavivirus“
Literatur
- H.-J. Thiel, M. S. Collett et al.: Genus Flavivirus. In: C. M. Fauquet, M. A. Mayo et al.: Eighth Report of the International Committee on Taxonomy of Viruses. London / San Diego, 2005, ISBN 0-12-249951-4
- D. Gubler, G. Kuno, L. Markoff: Flaviviruses. In: David M. Knipe, Peter M. Howley (eds.-in-chief): Fields’ Virology. 5. Auflage. Philadelphia 2007, Band 1, ISBN 0-7817-6060-7, S. 1153 ff.
- EA Gould, T. Solomon: Pathogenic flaviviruses. Seminar. In: Lancet 2008, 371, S. 500–509
Weblinks
- Gattung Flavivirus in der Datenbank des NCBI
- Gattung Flavivirus in der Datenbank des ICTV
Einzelnachweise
- ICTV Master Species List 2018b.v2. MSL #34, März 2019
- ICTV: ICTV Taxonomy history: Yellow fever virus, EC 51, Berlin, Germany, July 2019; Email ratification March 2020 (MSL #35)
- EA Gould, T Solomon: Pathogenic flaviviruses. In: The Lancet. 371, Nr. 9611, Februar 2008, S. 500–9. doi:10.1016/S0140-6736(08)60238-X. PMID 18262042.
- RJ Kuhn, W Zhang, MG Rossmann et al.: Structure of dengue virus: implications for flavivirus organization, maturation, and fusion. In: Cell. 108, Nr. 5, März 2002, S. 717–25. PMID 11893341.
- A Sampath, R Padmanabhan: Molecular targets for flavivirus drug discovery. In: Antiviral Research. 81, Nr. 1, Januar 2009, S. 6–15. doi:10.1016/j.antiviral.2008.08.004. PMID 18796313.
- Master Species List (#33) 2018a v1. ICTV, Herbst 2018
- H. Weissenböck, Z. Hubálek, T. Bakonyi, N. Nowotny: Zoonotic mosquito-borne flaviviruses: worldwide presence of agents with proven pathogenicity and potential candidates of future emerging diseases. In: Veterinary Microbiology, Elsevier, 2010, 140 (3-4), S. 271 ff, doi:0.1016/j.vetmic.2009.08.025
- NCBI: Tick-borne encephalitis virus group
- Anne Piantadosi, Daniel B Rubin, Daniel P McQuillen, Liangge Hsu, Philip A Lederer: Emerging Cases of Powassan Virus Encephalitis in New England: Clinical Presentation, Imaging, and Review of the Literature. In: Clinical Infectious Diseases: An Official Publication of the Infectious Diseases Society of America. Band 62, Nr. 6, 15. März 2016, ISSN 1537-6591, S. 707–713, doi:10.1093/cid/civ1005, PMID 26668338, PMC 4850925 (freier Volltext).
- Powassan Basics: About Powassan Virus Disease, Minnesota Department of Health, 11. April 2019
- NCBI: Karshi virus
- NCBI: Seaborne tick-borne virus group
- NCBI: Dengue virus group
- NCBI: Japanese encephalitis virus group
- NCBI: Kokobera virus group
- NCBI: Ntaya virus group
- Joel H. Ellwanger et al.: Rocio Virus: An Overview, auf: ResearchGate, Juli 2017
- NCBI: T'Ho virus (species)
- PMC 5469153 (freier Volltext)
- Peipei Liu et al: Genomic and antigenic characterization of the newly emerging Chinese duck egg-drop syndrome flavivirus: genomic comparison with Tembusu and Sitiawan viruses, in: Journal of General Virology, Band 93, Nr. 10, 1. Oktober 2012, doi:10.1099/vir.0.043554-0
- NCBI: Yellow fever virus group
- Andrew F. van den Hurk, Willy W. Suen, Roy A. Hall, Caitlin A. O’Brien, Helle Bielefeldt-Ohmann, Jody Hobson-Peters, Agathe M. G. Colmant: A newly discovered flavivirus in the yellow fever virus group displays restricted replication in vertebrates. In: Journal of General Virology. 97, Nr. 5, 2016, S. 1087–1093. doi:10.1099/jgv.0.000430. PMID 26878841. PDF
- NCBI: Fitzroy river virus (species)
- Cheryl A. Johansen et al: Characterization of Fitzroy River Virus and Serologic Evidence of Human and Animal Infection, in: Emerging Infectious Diseases, Band 23, Nr. 8, August 2017
- NCBI: Nanay virus (species)
- NCBI: Modoc virus group
- S Bekal, LL Domier, B Gonfa, NK McCoppin, KN Lambert, K Bhalerao: A novel flavivirus in the soybean cyst nematode. In: Journal of General Virology. 95, Nr. Pt 6, 2014, S. 1272–1280. doi:10.1099/vir.0.060889-0. PMID 24643877.
- NCBI: unclassified Flavivirus