Immunglobulin M
Das Immunglobulin M (IgM) ist ein Antikörpermolekül, bestehend aus fünf Y-förmigen Untereinheiten, die an den langen Enden miteinander verbunden sind.[1] Die Verbindung der einzelnen antigenbindenden Moleküle erfolgt durch zusätzliche intermolekulare Disulfidbrücken und die J-Kette.[1] Seine Konzentration im Blutserum beträgt 1,5 mg/ml.

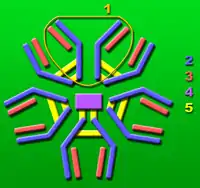
1 Grundeinheit
2: H-Kette
3: L-Kette
4: J-Kette
5: Intermolekuläre Disulfidbrücken
Die Grundeinheit besteht aus zwei langen („schweren“, auch H-Kette (von englisch heavy)) und zwei kurzen („leichten“, auch L-Kette) Proteinketten und hat die Form eines „Y“. An den kurzen Enden des Y befinden sich die Bindungsstellen, die an Antigene (Fremdkörper, zum Beispiel spezifische Oberflächenstrukturen von Bakterienzellen) binden können.[1]
IgM hat eine Funktion als frühestes im Verlauf einer Immunantwort produziertes Immunglobulin zur Aktivierung des Komplementsystems, weshalb ein erhöhter IgM-Antikörperwert bei einer Blutuntersuchung auf eine aktuelle Immunantwort – also eine momentane Infektion – hindeutet.
Natürliches IgM
Natürliche IgM-Antikörper werden von B1-Zellen sezerniert. Beim Menschen sind diese CD20+, CD27+, CD43+ und CD70+. Neben ihrer Rolle bei der Abwehr eindringender Mikroben sind sie auch an der Gewebehomöostase durch Clearance apoptotischer und veränderter Zellen durch komplementabhängige Mechanismen beteiligt. Sie inhibieren die Inflammation, entfernen missgebildete Zellen und regulieren sowohl die pathogenen, autoreaktiven Antikörper des IgG Isotyps, als auch die Autoantikörper-produzierender B-Zellen. Dies eröffnet in der Zukunft evtl. neue therapeutische Möglichkeiten wie die Anregung der Produktion natürlichen IgMs oder die pharmakologische Substitution mono- oder polyklonaler IgM-Präparate. IgM Antikörper treten in der Ontogenese der B-Zellen als erster Isotyp auf und bilden das erste Immunglobulin, das während der Antigen-spezifischen Immunantwort sezerniert wird.
Diagnostik
Der Nachweis spezifischer Antikörper vom IgM-Typ weist auf eine frische Infektion hin, insbesondere bei niedrigen IgG-Titern, die IgM-Titer können jedoch erheblich variieren.[2]
Literatur
- Charles Janeway, Paul Travers, Mark Walport, Mark Shlomchik: Immunologie. 5. Auflage, Spektrum Akademischer Verlag, Heidelberg 2002, ISBN 3-8274-1079-7, Onlineversion in Englisch, 5th edition, 2001.
- V. Kaveri, Gregg J. Silverman, Jagadeesh Bayry: Natural IgM in immune equilibrium and harnessing their therapeutic potential. In: J. Immunol., Band 188, 2012, S. 939–945.
Einzelnachweise
- Stephen J. Perkins, Adam S. Nealis, Brian J. Sutton, Arnold Feinstein: Solution structure of human and mouse immunoglobulin M by synchrotron X-ray scattering and molecular graphics modelling: A possible mechanism for complement activation. In: Journal of Molecular Biology, Band 221, Nr. 4, Oktober 1991, S. 1345–1366, doi:10.1016/0022-2836(91)90937-2.
- J. Van Elslande, E. Houben, M. Depypere, A. Brackenier, S. Desmet, E. André, M. Van Ranst, K. Lagrou, P. Vermeersch: Diagnostic performance of seven rapid IgG/IgM antibody tests and the Euroimmun IgA/IgG ELISA in COVID-19 patients. In: Clinical Microbiology and Infection, Band 26, Nr. 8, August 2020, S. 1082–1087, doi:10.1016/j.cmi.2020.05.023 (PDF).