Magaldrat
Magaldrat ist ein Arzneistoff aus der Gruppe der Schichtgitterantazida, welche eine molekulare Schichtgitterstruktur aufweisen und zur symptomatischen Therapie von Erkrankungen, bei denen überschüssige Magensäure gebunden werden soll, eingesetzt werden.
| Allgemeines | |||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Freiname | Magaldrat | ||||||||||||||||||
| Andere Namen |
| ||||||||||||||||||
| Summenformel | Al5Mg10(OH)31(SO4)2· x H2O | ||||||||||||||||||
| Kurzbeschreibung |
weißes, kristallines und geruchloses Pulver[1] | ||||||||||||||||||
| Externe Identifikatoren/Datenbanken | |||||||||||||||||||
| |||||||||||||||||||
| Arzneistoffangaben | |||||||||||||||||||
| ATC-Code |
A02AD02 | ||||||||||||||||||
| Wirkstoffklasse | |||||||||||||||||||
| Wirkmechanismus | |||||||||||||||||||
| Eigenschaften | |||||||||||||||||||
| Molare Masse | 1097,30 g·mol−1 (wasserfrei) | ||||||||||||||||||
| Löslichkeit |
praktisch unlöslich in Wasser und Ethanol 96 %, leicht löslich in verdünnten anorganischen Säuren[1] | ||||||||||||||||||
| Sicherheitshinweise | |||||||||||||||||||
| |||||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | |||||||||||||||||||
Klinische Angaben
Anwendungsgebiete
Magaldrat eignet sich zur symptomatischen Behandlung bei Hyperazidität und deren akuten Folgen:[3] Dyspeptische Beschwerden im Bereich des Oberbauchs, Refluxösophagitis, Gastritis (Magenschleimhautentzündung), Völlegefühl sowie säurebedingte Magenbeschwerden. Magaldrat kann zur raschen symptomatischen Therapie – bis Protonenpumpeninhibitoren wirken – bei Magengeschwüren (Ulcus ventriculi) oder Zwölffingerdarmgeschwüren (Ulcus duodeni) eingesetzt werden.
Gegenanzeigen
Bei bekannter Überempfindlichkeit gegen Magaldrat darf das Mittel nicht genommen werden.[3]
Wechselwirkungen mit anderen Medikamenten
Es handelt sich um pharmakokinetische Interaktionen: Antazida können die Resorption, Verteilung oder Ausscheidung von gleichzeitig verabreichten Arzneimitteln beeinflussen. Daher sollte grundsätzlich ein Abstand von 2 Stunden zwischen der Einnahme von Magaldrat und anderen Arzneimitteln eingehalten werden. Zu den Arzneistoffen, welche Interaktionen mit Magaldrat verursachen, gehören beispielsweise Digoxin, Benzodiazepine, Bisphosphonate, Cumarin-Derivate, Indometacin, Cimetidin, Azol-Antimykotika, Chenodesoxycholsäure und Ursodeoxycholsäure. Insbesondere wurde unter Antazidaeinnahme eine erhebliche Verminderung der Resorption von Tetracyclinen und Chinolonderivaten (Ciprofloxacin, Ofloxacin, Norfloxacin) beobachtet, so dass während einer Therapie mit diesen Antibiotika eine Einnahme von Magaldrat nicht empfohlen werden kann. Die gleichzeitige Einnahme von aluminiumhaltigen Antazida mit säurehaltigen Getränken (z. B. Fruchtsäfte, Wein) erhöht die intestinale Aluminiumresorption. Diese Eigenschaft gilt für Brausetabletten, die Citronensäure beziehungsweise Weinsäure enthalten. Weiterhin beeinträchtigt Magaldrat – infolge des erhöhten pH-Werts des Magensaftes – die Eisen-Resorption.[4]
Anwendung während Schwangerschaft und Stillzeit
Zur Anwendung in der Schwangerschaft liegen weder kontrollierte Studien bei Tieren noch bei schwangeren Frauen vor. Tierexperimentelle Studien haben für Aluminium-Salze eine Reproduktionstoxizität gezeigt. Untersuchungen haben jedoch gezeigt, dass die Aluminiumspiegel nach der Einnahme von Aluminiumsalzen klar erhöht sind, während die Spiegel nach der Einnahme von Magaldrat, wegen der Schichtgitterstruktur, sich nicht von den Werten ohne Antazidagabe unterscheiden. Trotzdem sollte das Präparat während der Schwangerschaft nur nach strenger Indikationsstellung, kurzfristig und in einer möglichst niedrigen Dosierung angewendet werden. Aluminiumverbindungen gehen in die Muttermilch über. Ein Risiko für das Neugeborene ist nicht anzunehmen, da nur geringe Mengen aufgenommen werden.[3]
Besondere Patientengruppen
Magaldrat darf bei Patienten mit eingeschränkter Nierenfunktion (Creatinin-Clearance < 30 ml/min) nur bei regelmäßiger Kontrolle der Aluminium- und Magnesium-Plasmaspiegel verabreicht werden. Der Serumaluminiumspiegel soll 40 µg·L−1 nicht überschreiten. Auch bei langfristigem Gebrauch sind regelmäßige ärztliche Kontrollen und die Bestimmung der Aluminium- und Magnesium-Plasmaspiegel erforderlich. Der Arzneistoff soll nicht zur Behandlung von Kindern unter 12 Jahren angewendet werden, da in dieser Altersgruppe keine ausreichenden Erfahrungen vorliegen.[3]
Unerwünschte Wirkungen
Sehr häufig treten weiche Stühle auf, sehr selten werden Diarrhoen beobachtet.[3] Bei langdauernder Anwendung in hoher Dosierung ist auf Grund der erhöhten Aluminium- und Magnesiumspiegel eine systemische Toxizität möglich. Es kann zur Anreicherung von Aluminium in Knochen und Zentralnervensystem (ZNS) mit nachfolgender Enzephalopathie kommen.[5] Die Verminderung des Phosphat-Plasmaspiegels (Hypophosphatämie) kann sehr selten eine Osteomalazie (schmerzhafte Knochenerweichung) auslösen.[3]
Pharmakologische Eigenschaften
Physiologische Grundlagen der Magensäureproduktion
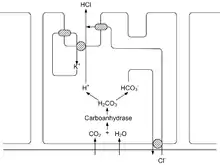
Die verschiedenen sekretorischen Zellen der Magenschleimhaut – Nebenzellen, Belegzellen und Hauptzellen – sezernieren täglich 1–3 Liter Magensaft. Der Magensaft ist eine farblose, leicht opaleszierende, wässrige Flüssigkeit mit einem pH-Wert von 0,9–1,5.[6] Die Sekretion wird durch mechanische und chemische Reizung der Magenwand, durch lokale Hormone des Verdauungstrakts (Gastrin, Sekretin, Histamin) sowie durch den Nervus vagus stimuliert und reguliert. Die Belegzellen, (lat.Exocrinocyti parietales, auch Parietalzellen genannt), ermöglichen die Sekretion von Wasserstoff(+I)-Ionen H+ und Chlor(−I)-Ionen Cl−, welche eine blutisotone Salzsäure (150 mmol·L−1, pH 0,9) bilden. Die Salzsäure überführt nicht nur das Verdauungsenzym des Magens, das Pepsin, in seine wirksame Form, sondern macht auch einen großen Teil der mit der Nahrung aufgenommenen Bakterien unschädlich. Die Protonen entstammen dem Kohlensäure-Hydrogencarbonat-Gleichgewicht, das durch die Carboanhydrase der Belegzellen katalysiert und auf die Seite der Protonenbildung verschoben wird.[7] Sie werden mit Hilfe der Protonenpumpe H+/K+-ATPase im Austausch gegen K+-Ionen in lumenseitige Canaliculi gepumpt. K+ diffundiert anschließend dem Konzentrationsgradienten folgend über einen Kaliumkanal in den Canaliculus zurück, wo es erneut für den Austausch gegen H+ zur Verfügung steht. Bicarbonat wird im Austausch gegen Cl− ins Blut abgegeben. Cl− gelangt dann dem elektrischen Gradienten folgend über einen speziellen Chloridkanal in den Canaliculus. Aus dem Canaliculus gelangen H+ und Cl− ins Lumen, während K+ wieder in die Zelle aufgenommen wird. Dadurch entsteht ein Protonengradient mit einem intrazellulären zu luminalem H+-Konzentrationsverhältnis von 1:106. Die Energie für die Aufrechterhaltung dieses hohen Gradienten entstammt der Hydrolyse von einem Molekül Adenosin-5′-triphosphat (ATP) zu Adenosin-5′-diphosphat (ADP) für den Transport von jeweils 2 H+. Außerdem sezernieren die Belegzellen den für die Vitamin-B12-Resorption im Ileum notwendigen intrinsischen Faktor, ein etwa 50 kDa schweres Glykoprotein mit einem hohen Gehalt an N-Acetylneuraminsäure, die es vor der Spaltung durch Proteasen schützt.[8]
Wirkungsmechanismus
Magaldrat ist eine stabile Komplexverbindung mit definierter kristalliner Schichtgitter-Struktur, ein sogenanntes Schichtgitterantazidum (engl.: Lattice structure antacids), in welchem Magnesium und Aluminium in übereinanderliegenden Gitterschichten strukturchemisch fest gebunden sind. Die antazide Wirkung kommt durch die Bindung von Protonen (H+) durch die Sulfat-Anionen [SO4]2− bzw. Hydroxidionen OH− der Zwischengitterschicht zustande. Mit der Neutralisation löst sich daher die Gitterstruktur auf und oberhalb eines pH-Wertes von 5 kommt die Reaktion zum Stillstand. Durch diese Säurepufferung ergibt sich im Magensaft ein konstanter pH-Bereich von 3–5. 1 g Magaldrat neutralisiert circa 27 mVal Salzsäure.
Zusätzlich zur puffernden Wirkung findet eine dosis- und pH-abhängige chemische Bindung von – durch den duodenogastralen Reflux in den Magen gelangten – cytotoxischen Gallensäuren[9] und Lysolecithin statt.[10] Diese Aggressoren werden – nebst H. pylori – für die Entstehung von Gastritis und Magengeschwüren verantwortlich gemacht. Darüber hinaus bildet es eine Schicht, welche die Magenschleimhaut vor Schäden schützt.[11] Die Peristaltik von Magen und Darm werden durch Magaldrat nicht beeinflusst, und es verursacht keinen Säure-Rebound.
Aufnahme und Verteilung im Körper
Magaldrat wird praktisch nicht aus dem Gastrointestinaltrakt resorbiert. Während des Neutralisationsprozesses werden in geringem Maße Magnesium- und Aluminiumionen freigesetzt. Ein sehr geringer Anteil der Aluminium-Kationen und maximal 5 % der Magnesium-Ionen werden pH-abhängig resorbiert.
Verstoffwechselung: Nicht resorbierte Kationen werden überwiegend während der Darmpassage zu schwer löslichen Phosphaten umgesetzt und mit dem Stuhl ausgeschieden. Resorbierte Al3+-Ionen werden an Plasmaproteine gebunden. Vor allem bei eingeschränkter Nierenfunktion und/oder langer Zufuhr und hoher Dosierung kann es nach Überschreitung der Plasmaeiweiß-Bindungskapazität zu Einlagerungen in Knochen, ZNS und anderen Organen kommen. Die Konzentration von Magnesium und Aluminium im Blutserum bleibt unverändert; es wurden jedoch auch bei nierengesunden Patienten gelegentlich leicht erhöhte Serumspiegel von Aluminium festgestellt.
Die Elimination von Magaldrat erfolgt über den Verdauungstrakt, und der geringe Anteil der resorbierten Aluminiumionen wird renal ausgeschieden.
Chemische und pharmazeutische Informationen
Magaldrat ist der internationale Freiname für das Schichtgitterantazidum, bestehend aus Aluminium- und Magnesiumhydroxiden sowie Al3+ und Mg2+ -Sulfaten. Die Zusammensetzung des Wirkstoffs entspricht etwa der Formel Al5Mg10(OH)31(SO4)2• x H2O und enthält nach Ph. Eur. 5.0–5.8 2006 mindestens 90,0 % und höchstens 105,0 % Magaldrat, berechnet auf die getrocknete Substanz.[1] Es verliert 10–20 % seines Gewichtes bei Trocknung über 4 Stunden bei 200 °C im Trockenschrank.
Entwicklung und Vermarktung
Magaldrat wurde erstmals vom deutschen Chemiker Gunther Hallmann synthetisiert und am 2. Februar 1960 von der damaligen Byk Gulden Lomberg, Chemische Fabrik GmbH in Konstanz, als Patent veröffentlicht.[12] Die Zulassung für Riopan (Originalpräparat) in Deutschland erhielt Byk Gulden 1983.[13] Die Firma wurde 2002 in Altana Pharma umbenannt, deren Pharmasparte 2007 an Nycomed verkauft wurde, die ihrerseits 2011 vom internationalen Pharmakonzern Takeda übernommen wurde. 2013 übernahm Dr. Kade die Zulassung von Riopan (Magen Gel und Kautabletten) für Deutschland von Takeda.[14]
Darreichungsformen und Handelsnamen
Magaldrathaltige Fertigpräparate sind als Tabletten, Kautabletten, Lutschtabletten, Suspensionen und Magengele mit einem Wirkstoffgehalt von 400 mg–1600 mg pro Einzeldosis im Handel. In Deutschland und Österreich unterstehen alle Präparate der Apothekenpflicht. In der Schweiz sind die Arzneimittel in der Abgabekategorie D eingeordnet und können in Apotheken und Drogerien nach medizinischer Fachberatung rezeptfrei bezogen werden.
Handelsnamen: Bisco-Magaldrat (D), Gastripan (D), Glysan (D), Magastron (S), Marax (D), Riopan (D, A, CH), Magaldrat-ratiopharm Kautabletten (D) und andere
Weblinks
- Patent EP0154114: Method for preparing magaldrate. Angemeldet am 12. Januar 1985, veröffentlicht am 11. September 1985, Anmelder: Giulini Chemie, Erfinder: Klaus Schanz.
Literatur
- Europäische Arzneibuch-Kommission (Hrsg.): EUROPÄISCHE PHARMAKOPÖE 5. AUSGABE. Band 5.0–5.8, 2006.
- Ernst Mutschler et al.: Mutschler – Arzneimittelwirkungen Lehrbuch der Pharmakologie und Toxikologie. 9. Auflage. Wissenschaftl. Verlagsgesellschaft, Stuttgart 2008, ISBN 978-3-8047-1952-1.
- Franz v. Bruchhausen (Editor), Siegfried Ebel (Editor), Eberhard Hackenthal (Editor), Ulrike Holzgrabe (Hrsg.): Hagers Handbuch der Pharmazeutischen Praxis: Folgeband 5: Stoffe L–Z. Springer, ISBN 3-540-62646-8.
- Hermann J. Roth: Medizinische Chemie: Targets und Arzneistoffe; 157 Tabellen. Dt. Apotheker-Verlag, Stuttgart 2005, ISBN 3-7692-3483-9.
- Dieter Strauss: Chemie für die pharmazeutische Praxis: Lehrbuch und Nachschlagewerk. Dt. Apotheker-Verlag, Stuttgart 2000, ISBN 3-7692-2606-2.
- Bert Ehgartner: Dirty little secret – die Akte Aluminium. Verlag Ennsthaler 2012, ISBN 3-85068-894-1.
Einzelnachweise
- Europäische Arzneibuch-Kommission (Hrsg.): EUROPÄISCHE PHARMAKOPÖE 5. AUSGABE. Band 5.0–5.8, 2006.
- Für diesen Stoff liegt noch keine harmonisierte Einstufung vor. Wiedergegeben ist eine von einer Selbsteinstufung durch Inverkehrbringer abgeleitete Kennzeichnung von Aluminum magnesium hydroxide sulfate (Al5Mg10(OH)31(SO4)2), hydrate im Classification and Labelling Inventory der Europäischen Chemikalienagentur (ECHA), abgerufen am 7. Juli 2020.
- Mustertext der Fachinformation für Magaldrat des Bundesinstitut für Arzneimittel und Medizinprodukte (BfArM), Stand Oktober 2003.
- Interaktions-Datenbank von Pharmavista.
- W. Forth, D. Henschler, W. Rummel: Allgemeine und spezielle Pharmakologie und Toxikologie. 9. Auflage. URBAN & FISCHER, München 2005, ISBN 3-437-42521-8.
- Eintrag zu Magensaft. In: Römpp Online. Georg Thieme Verlag, abgerufen am 5. Juni 2014.
- Thews, Mutschler, Vaupel: Anatomie, Physiologie, Pathophysiologie des Menschen. Wissenschaftl. Verlagsgesellschaft, 1980, S. 339 f.
- P. Hescheler (Hrsg.); Speckmann Deetjen: Physiologie. Urban & Fischer in Elsevier, München 2006, ISBN 978-3-437-44440-1, S. 591–632.
- Philip R. Debruyne, Erik A. Bruyneel, Xuedong Li, Amazia Zimber, Christian Gespach, Marc M. Mareel: The role of bile acids in carcinogenesis. In: Mutation Research/Fundamental and Molecular Mechanisms of Mutagenesis. Band 480-481, 1. August 2001, S. 359–369, doi:10.1016/S0027-5107(01)00195-6, PMID 11506828.
- C. Baur u. a.: Neutralizing capacity, pepsin inactivation and binding to bile acids and lysolecithin of the antacid magaldrate Arzneimittelforschung 31(3), 1981, S. 504–7. PMID 6784737.
- LE. Borella u. a.: Cytoprotective and antiulcer activities of the antacid magaldrate in the rat. Arzneimittelforschung 39(7), Jul 1989, S. 786–9. PMID 2783181.
- Patent US2923660: Process for the preparation of magnesium aluminate hydrate, and therapeutic agents so produced. Angemeldet am 17. Juli 1956, veröffentlicht am 2. Februar 1960, Anmelder: Byk Gulden Lomberg Chem. Fab., Erfinder: Gunther Hallmann.
- Fachinfo Riopan Magen Tabletten, Stand Dezember 2014.
- Dr. Kade kauft Riopan und Faktu. Apotheke adhoc, 28. März 2013.