Eisen-Stoffwechsel
Der Eisenstoffwechsel oder -metabolismus ist die Aufnahme, Verteilung und Ausscheidung von Eisen im Organismus. Der Begriff ist insofern irreführend, da Eisen als solches nicht „verstoffwechselt“ wird, sondern lediglich gebunden an die verschiedensten organischen Moleküle im Organismus vorliegt.[1]
Eisen
Das Element Eisen ist ein wichtiges Spurenelement im menschlichen Körper. Der Sauerstofftransport, die Sauerstoffaufnahme, Zellfunktionen wie der mitochondriale Elektronentransport, Cytochrom P450 und letztlich der gesamte Energiestoffwechsel sind von einem ausreichenden Eisenangebot abhängig.
Der Körper eines Menschen enthält durchschnittlich 4–5 g Eisen. Es kommt in Enzymen (Zytochromen, Peroxidasen, Katalase), in Hämoglobin und Myoglobin sowie als Depot- oder Reserve-Eisen in Form von Ferritin und Hämosiderin vor. Das Depot-Eisen befindet sich hauptsächlich in Leberzellen und Macrophagen des retikulohistiozytären Systems.[2]
Verteilung im Körper
Die folgende Verteilung findet sich bei Männern mit 70 kg Körpergewicht.[3]
| Hämoglobin | 66,1 % | 2800 mg |
| Depot-Eisen (Ferritin, Hämosiderin) | 18,8 % | 800 mg |
| Nichthämenzym-Eisen | 10 % | 420 mg |
| Myoglobin | 4,7 % | 200 mg |
| Transport-Eisen (Transferrin) | 0,2 % | 10 mg |
| Eisenhaltige Enzyme | 0,2 % | 10 mg |
Täglicher Bedarf
Der tägliche Eisenbedarf beträgt zwischen 0,5–1,5 mg/Tag bei Kleinkindern und 2–5 mg/Tag bei Frauen in der Schwangerschaft. Mit Ausnahme von Menstruationsblutungen sind die täglichen Eisenverluste, zum Beispiel durch Abschilferung von Haut- und Schleimhautzellen und über den Urin, gering. Der tägliche Eisenverlust von ca. 1 mg bei einem gesunden erwachsenen Mann wird normalerweise über die Nahrung ersetzt. Die tatsächlich aufgenommene Menge an Eisen sollte jedoch deutlich über dem täglichen Bedarf liegen, da nur etwa 10–15 % des zugeführten Eisens für den Körper verfügbar sind. Es empfiehlt sich eine Zufuhr von 10 mg/Tag für Männer und 15 mg/Tag für Frauen. Bei Schwangeren und Stillenden kann sich die Menge auf bis zu 30 mg/Tag erhöhen.[4]
Blutverluste können den Eisengehalt des Körpers beträchtlich verringern: pro 2 ml Blut gehen 1 mg Eisen verloren. Der durchschnittliche Blutverlust bei der Menstruation beträgt 30–60 ml, das ist also ein Eisenverlust von 15–30 mg; bei Hypermenorrhoen verliert eine Frau bis zu 800 ml Blut, beim Uterus myomatosus bis zu 1200 ml.
Stoffwechsel
Im Unterschied zu Metallen wie Natrium und Calcium kann der Eisen-Haushalt nur über die Resorption reguliert werden, da die normalen Verluste nicht steuerbar sind. Die Resorptionsquote des in der Nahrung vorhandenen Eisens beträgt zwischen 6 % beim Mann und 12 % bei der Frau, bei Eisenmangel bis zu 20 %.[5]
Resorption (Allgemeines)
Bei der in Europa üblichen Nahrung liegt das Eisen zu einem Drittel als Häm vor, ein Bestandteil von Hämoglobin im Blut und Myoglobin, das in Fleisch vorkommt. Das restliche Nahrungseisen liegt hauptsächlich in Form von Eisen(III)-Komplexen, die in der Regel an Cysteinreste von Proteinen gebunden sind, vor. Wirklich freies Eisen(III) als Fe3+ kommt biologisch nie vor, da es als Hydroxid oder Phosphat unlösliche Niederschläge bilden würde. Sowohl Fe2+ und im stärkeren Maße auch Fe3+ bilden mit quasi allen Biomolekülen (außer Fett) lockere Komplexe, die dafür sorgen, dass das Eisen in Lösung bleibt. In Häm sind vier der sechs Bindungsstellen des Eisens schon fest besetzt, so dass es keine festen oder unlöslichen Komplexe mit anderen Komplexbildnern (Chelatoren) mehr bilden kann. Daher ist die Aufnahme (Resorption) von Häm-Eisen unabhängig von anderen Nahrungsbestandteilen. Obwohl Häm-Eisen nur ein Drittel des Nahrungseisens ausmacht, liefert es daher etwa zwei Drittel des resorbierten Eisens.[6]
Pflanzliche Nahrung enthält einerseits Liganden, welche die Eisenresorption erleichtern, andererseits aber auch Phosphate, Polyphenole und Phytate, die mit Eisen schwer lösliche Verbindungen eingehen. So ist z. B. die geringe Verfügbarkeit des Eisens im Spinat und ähnlichen Gewächsen auf den hohen Gehalt von Oxalsäure zurückzuführen, die mit Eisen schwer lösliche Komplexe bildet. Die Resorption kann bei phytathaltigen Lebensmitteln durch gleichzeitigen Fleischverzehr oder Zusatz von Reduktionsmitteln wie Ascorbinsäure (= Vitamin C) verbessert werden. Ferritin aus Sojabohnen kann Eisenmangel auch bei Vegetariern teilweise ausgleichen.[7]
Die Resorptionsquote des Nahrungs-Eisens liegt normalerweise bei ca. 6 bis 12 %.[5] Sie ist bei Eisenmangel erhöht und kann bis zu 20 % betragen.[5] Die Resorptionsquote wird vom Organismus in Abhängigkeit vom Eisenbedarf und der Eisen-Speichergröße reguliert, wobei die Regulationsmechanismen noch weitgehend unerforscht sind. Genetisch bedingte Fehlsteuerungen bei der Eisenresorption können über Jahre zu einer Eisenüberladung führen, die sich in lebensbedrohlichen Organschäden manifestiert.
Der menschliche Organismus resorbiert sowohl zweiwertige (Fe2+) als auch dreiwertige (Fe3+) Eisen-Ionen. Da Fe3+ und Fe2+ grundsätzlich fest an Nahrungsproteine gebunden ist, ist der Abbau der Proteine durch spezielle Verdauungsenzyme wie zum Beispiel Pepsin eine Voraussetzung für die Eisenaufnahme. Bei ausreichender HCl-Produktion im Magen ist dieser Abbau sichergestellt. Eine Hitzedenaturierung (durch Kochen, Braten, Backen) erleichtert den Abbau der Eisenbindeproteine im Magen, da die natürliche stabile Faltung der Proteine zumindest teilweise zerstört wird und daher mehr Angriffsstellen für die Verdauungsenzyme vorhanden sind. Nach Abbau der Eisenbindeproteine im Magen liegt im Dünndarm das meiste Eisen als Fe3+ in lockeren Komplexen mit anderen Molekülen vor. Alle Nahrungsmoleküle, die sowohl eine Säuregruppe als auch weitere OH-, NH- oder SH-Gruppen enthalten, können mit Fe3+ und Fe2+ lockere Komplexe bilden und gleichzeitig (über die zusätzlichen Gruppen) die Löslichkeit sicherstellen. Diese Moleküle sind Ascorbinsäure, Citronensäure, Glycin, Cystein und viele andere Aminosäuren.
Enterale Resorption, hepatische Regulation
Das Glykoprotein Gastroferrin, ein eisenbindendes Protein des Magensafts, dürfte für die Steigerung der Eisen-Resorption von geringer Bedeutung sein.[8]
Im Darm liegt das Eisen dann in absteigender Menge in lockeren Fe3+-Komplexen, als Fe2+ in Häm, und in lockeren Fe2+ Komplexen vor. Die Löslichkeiten von Fe3+ und Fe2+ aus der anorganischen Chemie beziehen sich auf die Bildung von Hydroxidniederschlägen und sind in diesem Zusammenhang irrelevant, da die lockeren Komplexe dafür sorgen, dass selbst Fe3+ auch beim pH des Dünndarms in Lösung bleibt. Daher ist es nicht verwunderlich, dass trotz der Unlöslichkeit von Fe3+ in (reinem) Wasser bei pH 9 der wichtigste Aufnahmeweg von Eisen im Körper der größten Menge an Eisen in der Nahrung entspricht. Es gibt zurzeit drei bekannte Aufnahmewege:[9]
- MIP-Weg: Fe3+ wird über Mobilferrin, Integrin und Paraferritin aufgenommen. Das Mobilferrin löst dabei Fe3+ aus lockeren Komplexen heraus und bindet es fest. Dies ist nicht möglich, wenn das Fe3+ vorher sehr feste oder gar unlösliche Komplexe gebildet hat.
- Häm-Weg: Das Eisen wird zusammen mit dem Häm aufgenommen, das heißt, es passiert die Zellmembran des Enterozyten. Normalerweise liegt das Eisen in Häm als Fe2+ vor. In der Darmzelle folgt dann eine Häm-Oxygenase, die das im Häm enthaltene Fe2+ freisetzt und in den labilen Eisen-Pool der Darmzelle überführt. Da Eisen im Häm fest gebunden ist, kann es immer aufgenommen werden unabhängig von sonstigen Nahrungsbestandteilen im Darm. Dies geschieht durch das Hem Carrier Protein 1 (HCP1).[10]
- [DMT1]-Weg: Fe2+ wird direkt aufgenommen.[11] Dieser Weg ist im Gegensatz zu den anderen nicht spezifisch für Eisen, sondern es werden auch andere zweiwertige Metallionen damit transportiert (Divalenter Metallionen Transporter). Die Transportproteine sind in der Lage Fe2+ aus lockeren Komplexen zu lösen. Auch Fe2+ steht zum Transport nicht zur Verfügung, wenn es feste oder unlösliche Komplexe gebildet hat. Dreiwertiges Nonhäm-Eisen kann auch für die Resorption zunächst zu Fe2+ reduziert werden. Dies geschieht entweder durch Reduktionsmittel wie Ascorbinsäure oder durch eine Ferrireduktase (membranständiges, duodenales Cytochrom b) in der Darmzellmembran.[12]
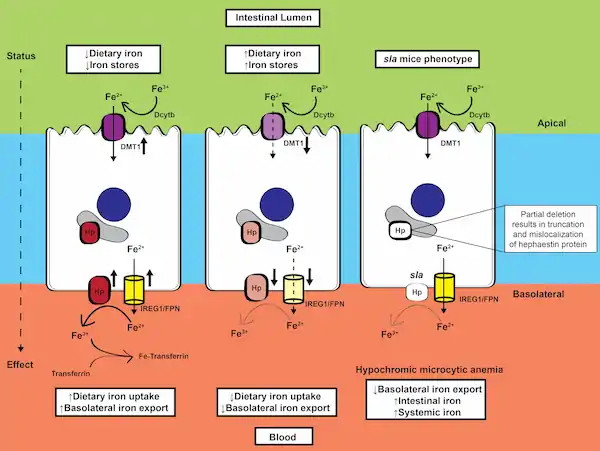
Die Resorption von Eisen erfolgt als Fe2+ auf der apikalen Seite der Enterozyten (Bürstensaummembran) in den oberen Dünndarmabschnitten, dem Duodenum und im oberen Jejunum. Dabei wird Fe3+ nach Reduktion durch eine Membranreduktase, einer dem Cytochrom b ähnlichen duodenalen Ferrireduktase (duodenal cytochrome B, DCYTB) zu seiner zweiwertige Form Fe2+ umgewandelt und über das Membranprotein, dem divalenten Metalltransporter (divalent metall transporter 1, DMT 1) durch die apikale Enterozytenmembran transportiert. Intrazellulär, also in der Darmzelle wird das Fe2+ entweder in Form von intrazellulärem Ferritin gespeichert oder zur basolateralen Zellmembran transportiert. An der basolateralen Enterozytenmembran wird das nicht in Ferritin eingelagerte Eisen in Form von Fe2+ an Ferroportin 1 (iron regulated protein, IREG) gebunden. Ferroportin als zelluläres Eisen-Transportprotein ist auch in der Membran von Monozyten und Hepatozyten lokalisiert und wird in seiner Funktion durch die Interaktion mit Hepcidin reguliert. In seiner Funktion kooperiert Ferroportin mit der Ferrooxidase Hephaestin, welches das Fe2+ in Fe3+ oxidiert.[13][14][15]
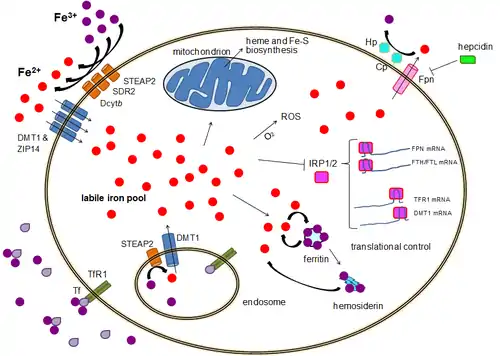
Der Eisenimport kann über die Endozytose des Transferrinrezeptors 1 oder über die Eisenimporteure DMT1 und ZIP14 erfolgen, die die Aktivität der Eisenreduktasen wie STEAP2 (six transmembrane epithelial antigen of the prostate 2, Metalloreductase), SDR-2 (stromal cell-derived receptor 2) und Dcytb (duodenal cytochrome B) erfordern.
Intrazelluläres Eisen kann in Ferritin gespeichert und für die Proteinbiosynthese verwendet werden oder aber auch reaktive Sauerstoffspezies (ROS) erzeugen sowie die Transkription über Eisen-bindende Proteine (iron regulatory protein, IRP1/2) regulieren. Der Export erfolgt durch Ferroportin, oft unterstützt durch Hephaestin (Hp) und / oder Ceruloplasmin (Cp), und wird unterdrückt durch Hepcidin. STEAP2, SDR2 and Dcytb: ferric iron reductases; DMT1 and ZIP14: ferrous iron importers, zinc transporter; Tf: transferrin; TfR1: transferrin receptor 1; ROS: reactive oxygen species; IRP1/2: iron responsive element binding proteins; FTH: ferritin heavy chain gene; FTL: ferritin light chain gene; Fpn: ferroportin; Hp: hephaestin; Cp: ceruloplasmin.
Das Hepcidin ist ein Akute-Phase-Protein und hat die Schlüsselfunktion bei der Regulation der Resorption, Gewebeverteilung und extrazellulären Konzentration von Eisen. Bei einem hohen Körpereisenspiegel, bei Infektionen oder Entzündungen (dadurch Anstieg der Interleukine Il-6, Il-1) wird das Hepcidin kodierende Gen HAMP hochreguliert. Dadurch steigt auch das im Blut zirkulierende Hepcidin. Letzteres bindet an das Ferroportin, wodurch dessen Internalisierung und Ubiquitin-mediierte Degradation induziert wird. Dadurch können die Eisenionen nicht aus dem Darm, durch die Enterozyten, resorbiert werden. Zusätzlich wird auch kein Eisen aus den Monozyten oder Hepatozyten in die Zirkulation freigesetzt. Das lässt den Serum-Eisenspiegel sinken.
Dabei regulieren spezialisierte Endothelzellen in den Lebersinusoiden über die Synthese des Wachstumsfaktors Bmp2 (bone morphogenic protein 2) die Bildung des den Eisenstoffwechsel regulierenden Hormons Hepcidin.[17][18]
Im Enterozyten wird das Eisen entweder als Depot-Eisen in Ferritin gespeichert oder durch das Transportprotein Ferroportin an das Blut abgegeben. Dieser Vorgang wird durch Hepcidin gehemmt, wodurch im Wesentlichen die Eisenaufnahme reguliert wird. Das von Ferroportin abgegebene zweiwertige Eisen wird auf die kontraluminale Zelloberfläche transportiert und durch das Membranprotein Hephästin oxidiert. In dieser oxidierten dreiwertigen Form bindet es sich an Apotransferrin und wird darauf hin an die Bedarfsstellen im Organismus transportiert.
Weitertransport
Durch Ferroportin wird das Eisen als oxidierte Form Fe3+ an das Transferrin weitergegeben, hierbei kooperiert das Transportprotein mit der Ferroxidase Hephaestin. Das Transferrinmolekül hat zwei Bindungsstellen für je ein dreiwertiges Fe3+. Transferrin (Apotransferrin) ist ein Glykoprotein und wird in der Leber synthetisiert, gibt das Eisen durch Einschleusen von Eisen-Ionen an die zu versorgenden Zellen bzw. Gewebe über die Bindung mit dem Transferrin-Rezeptor (TfR-1) der Zelle in Form einer Rezeptor-vermittelten Endozytose (clathrin-coated pits) frei. Nach intrazellularem Auflösen der Clathrinschicht kommt es zu einer Fusion mit den Endosomen. Protonenpumpen der endosomalen Membran senken den pH-Wert auf 5 bis 6 ab. Die Ansäurung bewirkt eine Konformationsänderung im Transferrin-TfR-Komplex und führt zur Freisetzung des dreiwertigen Fe3+. Eine Metalloreductase oder Ferrireductase (STEAP3) reduziert das dreiwertige Eisenion zum zweiwertigen Fe2+, welches dann im Anschluss durch den -divalenten Metalltransporter (DMT 1), divalent metall transporter 1 in das Zytosol der Zelle transportiert werden kann.
Hier stehen dem zweiwertigen Eisenion zwei Wege offen, so kann es direkt durch den Einbau in Proteine (Funktionseisen) verwendet werden oder es wird in Form von dreiwertigem Eisen in Ferritin gespeichert. Die Ferritinspeicherung kommt vor allem in Zellen der Leber, Milz und des Knochenmarks vor. Nur ein geringer Anteil findet sich als Serum-Ferritin. Der Serum-Ferritinspiegel zeigt u. U. eine gewisse Korrelation zum Gesamteisenvorrat im Organismus. Zuerst werden eisenhaltige Enzyme versorgt, danach das rote Knochenmark (Bildung von Hämoglobin) und die Muskulatur (Bildung von Myoglobin). Der tägliche Austausch von Eisen zwischen den Geweben beträgt durchschnittlich circa 40 mg.
Die Expression der Proteine des Ferritins, Transferrin-Rezeptors (TfR-1) und des divalent metall transporter 1 (DMT 1) wird in der Zelle posttranskriptional durch das Iron Response Element oder iron regulatory protein (IRE/IRP) in Abhängigkeit von intrazellulären Eisengehalt reguliert.
Im Verlauf der Häm-Synthese in Säugetieren wird Fe(II) durch Ferrochelatase (synonym Häm-Synthase), ein Enzym der Mitochondrien-Innenmembran, eingelagert.[19] Die für die Reduktion notwendigen Elektronen werden durch die Atmungskette bereitgestellt.
Regulation des Eisenspiegels im Blut
Der Eisenspiegel auf Ebene des Organismus wird wahrscheinlich vor allem durch das später entdeckte Peptid Hepcidin reguliert, welches an Ferroportin im Darm bindet und dem Abbau zuführt.[20] Ist der Eisenspiegel zu niedrig, bremst die Leber ihre Hepcidinproduktion. Als Folge wird die Freisetzung von Eisen aus Zellen ins Blut gesteigert.[21] Ist der Eisenspiegel zu hoch, dann steigert die Leber ihre Hepcidinproduktion und die Eisenfreisetzung sinkt („Mukosablock“). Man hat Hepcidin deswegen auch als Hormon des Eisenstoffwechsels bezeichnet. Auch die Freisetzung von Eisen aus den Zellen des Retikuloendothelialen Systems (RES) und aus Makrophagen wird durch Hepcidin gesteuert.[22]
Krankheiten
Eisenmangel
Hauptartikel: Eisenmangel.
Unter den Anämien, die auf eine Störung der Hämoglobinbildung zurückzuführen sind, hat die Eisenmangelanämie die größte praktische Bedeutung. Sie ist weltweit die häufigste Mangelerkrankung. Bei Eisenmangel können Blutarmut, Abwehrschwäche, starke Müdigkeitserscheinungen, Konzentrationsschwäche sowie trophische Störungen (Ernährungsstörungen) auftreten, die unter dem Begriff Plummer-Vinson-Syndrom zusammengefasst werden. Bei kleinen Kindern können Gedeihstörungen auftreten.
Eisenmangelerscheinungen treten bei Frauen häufiger auf als bei Männern, weil Frauen durch die Menstruation regelmäßig Eisen aus dem Organismus verlieren. In unterentwickelten Gebieten gibt es einen ernährungsbedingten Eisenmangel, der auf einen geringen Proteingehalt der Nahrung, bei hohem Phosphatgehalt, zurückgeführt wird.
Eiseneinbaustörungen bei der Häm-Biosynthese können zu Anämien führen, obwohl die Gesamtkonzentration von Eisen im Körper nicht verringert ist, vgl. z. B. die erythropoetische Protoporphyrie.
Akute Vergiftungen
Akute Vergiftungen mit Eisen sind in Deutschland selten. Sie betreffen meist Kinder, welche 2 bis 10 g Eisen oral aufgenommen haben. Die Symptome sind Kreislaufkollaps, Blutungen im Bereich des Gastrointestinaltrakts, eine verminderte Gerinnungsfähigkeit des Bluts sowie langfristig Leber- und Nierenversagen. Die Therapie besteht im Verhindern der Resorption des eingenommenen Eisens (Magenspülung) sowie im Ausschleusen des bereits resorbierten Eisens aus dem Organismus, z. B. durch intravenöse Gabe von Deferoxamin.
Chronische Vergiftungen
Hauptartikel: Hämochromatose (Eisenüberladung).
Bei einer Eisenüberladung kann es je nach betroffenem Organ zu einer Leberzirrhose, einer Pankreaszerstörung und anderen Organstörungen kommen. Beispiele für solche Krankheiten sind die Eisenspeicherkrankheit und die Hämosiderose. Hämochromatose (Eisenspeicherkrankheit) ist die in Nordeuropa am weitesten verbreitete genetische Erkrankung, ca. einer von zweihundert Nordeuropäern ist diesbezüglich homozygot, in Irland ist es sogar ca. 1 % der Bevölkerung. Heterozygote „Überträger“ der erblichen Hämochromatose, ca. 10–20 % in den genannten weißen Bevölkerungen, speichern geringfügig mehr Eisen als Nichtträger solcher Mutationen. Bereits geringe Eisenspeicherung oberhalb der niedrigen Werte gesunder Kinder führt u. a. zu Insulinresistenz bzw. zum Insulinresistenzsyndrom und seinen Folgen, insbesondere zu diversen gefährlichen Alterskrankheiten wie Typ-2-Diabetes samt Komplikationen, Atherosklerose, Herzinfarkt, Schlaganfall. Dies bietet einen Hinweis darauf, warum Kinder sowie Frauen in jüngeren Jahren (relativ) geschützt sind.
Das Blutspenden bzw. die Aderlasstherapie können die Eisenmenge des Organismus reduzieren. Nach Untersuchungen aus Finnland haben männliche Blutspender (von etwa 50 Jahren aufwärts) ein stark vermindertes Herzinfarktrisiko, nur rund ein Zehntel des Infarktrisikos anderer Männer.[23]
Wie kann man den Eisenhaushalt des Menschen überprüfen?
Bei Verdacht auf Eisenmangel
- Bestimmung des Ferritins[24] (bei Eisenmangel meist erniedrigt; bei Entzündungen trotz Eisenmangel evtl. normal oder sogar erhöht)
- Bestimmung des Löslichen Transferrin-Rezeptors (auch verwertbar bei Entzündungsreaktion oder chronischer Lebererkrankung)[25]
- Bestimmung des Kleinen Blutbilds mit folgenden Einzelwerten:
- Mittleres corpuskuläres Volumen (MCV) (bei Eisenmangel meist erniedrigt = verkleinerte rote Blutkörperchen)
- Mittleres corpuskuläres Hämoglobin (MCH) (bei Eisenmangel meist erniedrigt = blasse rote Blutkörperchen)
- Hämoglobin (Hb) im Blut (i. d. R. erst nach Erschöpfung der Eisenspeicher erniedrigt = Blutarmut)
Die Bestimmung des Eisens im Blut ist nicht geeignet.[26]
Bei Verdacht auf Hämochromatose (Eisenspeicherkrankheit)
- Ferritinspiegel im Blut
- Transferrin
- Transferrinsättigung
- Genanalyse auf hereditäre Hämochromatose
- Eisengehalt der Leber
Siehe auch
- Zu den Folgen der erhöhten Aufnahme eisenhaltiger Verbindungen im pflanzlichen Organismus, siehe Eisentoxizität.
Literatur
- K. Aktories, U. Förstermann, F. Hofmann und K. Starke: Allgemeine und spezielle Pharmakologie und Toxikologie. 10. Auflage. München, Elsevier 2009. ISBN 978-3-437-42522-6.
- G. J. Anderson, G. D. McLaren (Hrsg.): Iron Physiology and Pathophysiology in Humans. Humana Press, New York 2012, ISBN 1-60327-484-7.
- Muckenthaler MU, Galy B, Hentze MW: Systemic iron homeostasis and the iron-responsive element/iron-regulatory protein (IRE/IRP) regulatory network. In: Annu. Rev. Nutr.. 28, 2008, S. 197–213. doi:10.1146/annurev.nutr.28.061807.155521. PMID 18489257.
- Pantopoulos K: Function of the hemochromatosis protein HFE: Lessons from animal models. In: World J. Gastroenterol.. 14, Nr. 45, Dezember 2008, S. 6893–901. doi:10.3748/wjg.14.6893. PMID 19058322. PMC 2773850 (freier Volltext).
- Ye H, Rouault TA: Human iron-sulfur cluster assembly, cellular iron homeostasis, and disease. In: Biochemistry. 49, Nr. 24, Juni 2010, S. 4945–56. doi:10.1021/bi1004798. PMID 20481466. PMC 2885827 (freier Volltext).
Weblinks
- Bewertung von Eisenzufuhr durch Nahrungsergänzungsmittel Bundesinstitut für Risikobewertung
- Verwendung von Mineralstoffen in Lebensmitteln (PDF; 1,7 MB) Bundesinstitut für Risikobewertung
- eiseninfo.de Eisenstoffwechselambulanz des Universitätsklinikum Hamburg-Eppendorf
Einzelnachweise
- Gerhard Lanzer: Grundzüge des Eisenstoffwechsels. Patient Blood Management, 2. Teil, 6/2010 klinik, S. 43–46
- MU Muckenthaler, B Galy, MW Hentze: Systemic iron homeostasis and the iron-responsive element/iron-regulatory protein (IRE/IRP) regulatory network. In: Annu. Rev. Nutr.. 28, 2008, S. 197–213. doi:10.1146/annurev.nutr.28.061807.155521. PMID 18489257.
- Georg Löffler, Petro E. Petrides: Biochemie und Pathobiochemie. 7. Auflage. Springer-Verlag, Berlin / Heidelberg / New York 2002, ISBN 978-3-540-42295-2.
- Bundesinstitut für Risikobewertung, Eisen
- John W. Adamson (für die deutsche Ausgabe: Joachim Peter Kaltwasser und Axel Braner). Eisenmangel und andere hypoproliferative Anämien. In: Manfred Dietel, Joachim Dudenhausen, Norbert Suttorp (Hrsg.) Harrisons Innere Medizin. Berlin 2003, ISBN 3-936072-10-8, S. 733
- M. E. Conrad, J. N. Umbreit: Iron absorption and transport-an update. In: American Journal of Hematology. Band 64, Nummer 4, August 2000, S. 287–298, ISSN 0361-8609. PMID 10911382.
- B. Lönnerdal: Soybean ferritin: implications for iron status of vegetarians. In: The American journal of clinical nutrition. Band 89, Nummer 5, Mai 2009, S. 1680S–1685S, ISSN 1938-3207. doi:10.3945/ajcn.2009.26736W. PMID 19357222.
- W. Forth, W. Rummel, H. Andres: Zur Frage der Regulation der Eisenresorption durch Gastroferrin, ein eisenbindendes Protein des Magensafts. In: Klinische Wochenschrift. 46, Nr. 18, 1968, S. 1003–1005. ISSN 0946-2716. doi:10.1007/BF01745592.
- Marcel E. Conrad, Jay N. Umbreit: Iron absorption and transport – An update In: American Journal of Hematology
- J. Przybyszewska, E. Zekanowska: The role of hepcidin, ferroportin, HCP1, and DMT1 protein in iron absorption in the human digestive tract. In: Przegla?d gastroenterologiczny. Band 9, Nummer 4, 2014, S. 208–213, ISSN 1895-5770. doi:10.5114/pg.2014.45102. PMID 25276251. PMC 4178046 (freier Volltext).
- J. Przybyszewska, E. Zekanowska: The role of hepcidin, ferroportin, HCP1, and DMT1 protein in iron absorption in the human digestive tract. In: Przegla?d gastroenterologiczny. Band 9, Nummer 4, 2014, S. 208–213, ISSN 1895-5770. doi:10.5114/pg.2014.45102. PMID 25276251. PMC 4178046 (freier Volltext).
- A. T. McKie, D. Barrow, G. O. Latunde-Dada, A. Rolfs, G. Sager, E. Mudaly, M. Mudaly, C. Richardson, D. Barlow, A. Bomford, T. J. Peters, K. B. Raja, S. Shirali, M. A. Hediger, F. Farzaneh, R. J. Simpson: An iron-regulated ferric reductase associated with the absorption of dietary iron. In: Science. Band 291, Nummer 5509, März 2001, S. 1755–1759, ISSN 0036-8075. doi:10.1126/science.1057206. PMID 11230685.
- Enrico Rossi: Hepcidin–the iron regulatory hormone. In: The Clinical biochemist. Reviews. Band 26, Nummer 3, August 2005, S. 47–49, PMID 16450011, PMC 1240030 (freier Volltext).
- Ivana De Domenico, Diane M. Ward, and Jerry Kaplan: Hepcidin regulation: ironing out the details. In: The Journal of clinical investigation. Band 117, Nummer 7, Juli 2007, S. 1755–1758, doi:10.1172/JCI32701, PMID 17607352, PMC 1904333 (freier Volltext).
- James F. Collins, Marianne Wessling-Resnick, Mitchell D. Knutson: Hepcidin regulation of iron transport. In: The Journal of Nutrition. Band 138, Nummer 11, November 2008, S. 2284–2288, doi:10.3945/jn.108.096347, PMID 18936232, PMC 2764359 (freier Volltext).
- Matthias W. Hentze, Matthias W. Hentze, Martina U. Muckenthaler, Bruno Galy, Clara Camaschella: Two to Tango: Regulation of Mammalian Iron Metabolism. Cell Volume 142, Issue 1, S. 24–38, 9 July 2010
- Schematische Darstellung der Verhältnisse und Vernetzungen zwischen der Leberzelle und deren Wechselwirkungen mit Makrophagen und Enterozyten; Hepcidin steht dabei im Zentrum der Eisen-Homöostase u. a. wirken Hemojuvelin (HJV) als Ko-Rezeptor das Bone morphogenetic protein (BMP) als Ligand für den BMP-Rezeptor (BMP-Rs).
- Prem Ponka, Bill Andriopoulos: Iron can boost hepcidin both ways. blood 15 September 2007, I Volume 110, Number 6, S. 1703–1704
- G. C. Ferreira, R. Franco, S. G. Lloyd, I. Moura, J. J. Moura, B. H. Huynh: Structure and function of ferrochelatase. In: Journal of bioenergetics and biomembranes. Band 27, Nummer 2, April 1995, S. 221–229, ISSN 0145-479X. PMID 7592569.
- S. Gulec, G. J. Anderson, J. F. Collins: Mechanistic and regulatory aspects of intestinal iron absorption. In: American journal of physiology. Gastrointestinal and liver physiology. Band 307, Nummer 4, August 2014, S. G397–G409, ISSN 1522-1547. doi:10.1152/ajpgi.00348.2013. PMID 24994858. PMC 4137115 (freier Volltext).
- O. Loréal, T. Cavey, E. Bardou-Jacquet, P. Guggenbuhl, M. Ropert, P. Brissot: Iron, hepcidin, and the metal connection. In: Frontiers in pharmacology. Band 5, 2014, S. 128, ISSN 1663-9812. doi:10.3389/fphar.2014.00128. PMID 24926268. PMC 4045255 (freier Volltext).
- T. Ganz: Systemic iron homeostasis. In: Physiological reviews. Band 93, Nummer 4, Oktober 2013, S. 1721–1741, ISSN 1522-1210. doi:10.1152/physrev.00008.2013. PMID 24137020.
- Tuomainen Tomi-Pekka, Salonen Riitta, Nyyssouml;nen Kristiina, Salonen Jukka T. Cohort study of relation between donating blood and risk of myocardial infarction in 2682 men in eastern finland BMJ 1997; 314 :793, doi:10.1136/bmj.314.7083.793
- Lothar Thomas et al.: Neue Parameter zur Diagnostik von Eisenmangelzuständen: Schlusswort. (PDF; 35 kB) In: Dtsch Arztebl 2005; 102(42): A-2878. Bundesärztekammer, 25. August 2009, abgerufen am 5. August 2010: „Ferritin ist bei Verdacht auf Eisenmangel immer zu bestimmen“
- Lothar Thomas et al.: Neue Parameter zur Diagnostik von Eisenmangelzuständen: Retikulozytenhämoglobin und löslicher Transferrinrezeptor. (PDF; 213 kB) In: Dtsch Arztebl 2005; 102(9): A-580–86. Bundesärztekammer, 25. August 2009, abgerufen am 5. August 2010: „bei Akute-Phase-Reaktion oder chronischer Lebererkrankung, … trotz einer Verminderung des Gesamtkörpereisens eine noch normale Serumferritinkonzentration gemessen wird“
- J. Dierkes: Mögliche gesundheitliche Risiken des Fleischverzehrs. Diskussion zum Beitrag von Dipl. oec. troph. Franziska Feldl, Prof. Dr. med. Berthold Koletzko in Heft 11/1998: Ausgewogene Substratversorgung durch Fleischverzehr. In: Bundesärztekammer (Hrsg.): Deutsches Ärzteblatt. 95, Heft 30, 24. Juli 1998 (45), S. A-1851/1852 (aerzteblatt.de [PDF; 44 kB; abgerufen am 28. September 2010] „Für die Diagnose eines Eisenmangels nicht geeignet ist die Serumeisenbestimmung“).