Magnesiumhydroxid
Magnesiumhydroxid ist eine chemische Verbindung des Magnesiums aus der Gruppe der Hydroxide. Es ist ein farbloses Salz und eine starke Base. Aufgrund der geringen Löslichkeit in Wasser hat eine wässrige Anschlämmung aber nur einen pH-Wert von pH ~ 10[3], weshalb Magnesiumhydroxid als scheinbar schwache Base auftritt.
| Kristallstruktur | ||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
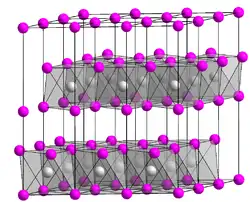 | ||||||||||||||||||||||
| _ Mg2+ _ OH− | ||||||||||||||||||||||
| Allgemeines | ||||||||||||||||||||||
| Name | Magnesiumhydroxid | |||||||||||||||||||||
| Andere Namen | ||||||||||||||||||||||
| Verhältnisformel | Mg(OH)2 | |||||||||||||||||||||
| Kurzbeschreibung |
farb- und geruchloser Feststoff[3] | |||||||||||||||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||||||||||||||
| ||||||||||||||||||||||
| Arzneistoffangaben | ||||||||||||||||||||||
| ATC-Code | ||||||||||||||||||||||
| Eigenschaften | ||||||||||||||||||||||
| Molare Masse | 58,33 g·mol−1 | |||||||||||||||||||||
| Aggregatzustand |
fest | |||||||||||||||||||||
| Dichte |
2,38 g·cm−3 [3] | |||||||||||||||||||||
| Schmelzpunkt | ||||||||||||||||||||||
| Löslichkeit |
sehr schlecht in Wasser (9 mg·l−1 bei 18 °C)[3] | |||||||||||||||||||||
| Sicherheitshinweise | ||||||||||||||||||||||
| ||||||||||||||||||||||
| Toxikologische Daten | ||||||||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | ||||||||||||||||||||||
Gewinnung und Darstellung
Magnesiumhydroxid entsteht aus Magnesiumoxid durch Hydratation, analog zum Kalklöschen von Calciumoxid.[5]
Magnesiumhydroxid kann aus Restlaugen der Kaligewinnung durch Ausfällen mit Kalkmilch[4] (1) oder aus Meerwasser durch Ausfällen mit gebranntem Dolomit (2) gewonnen werden. Das Produkt wird anschließend filtriert und bei etwa 100 °C getrocknet. Besonders reines Magnesiumhydroxid entsteht durch Einwirken von Wasser auf elementares Magnesium (3).
(1)
(2)
(3)
Tafelkreide kann neben Calciumsulfat und Calciumcarbonat auch Magnesiumoxid enthalten. Magnesiumhydroxid bildet sich dann beim feuchten Abwischen von Tafelaufschrieben.
Eigenschaften
Magnesiumhydroxid wird durch die Aufnahme von in der Luft enthaltenem Kohlenstoffdioxid nach und nach zu Magnesiumcarbonat umgewandelt.
Das Kristallgitter von Magnesiumhydroxid (Brucit) besteht aus einer hexagonal-dichtesten Kugelpackung von Hydroxidionen. Jede zweite Oktaeder-Lückenschicht ist mit Magnesiumionen (Mg2+) besetzt.[4] Dies führt zu einer trigonalen Struktur, Raumgruppe P3m1 (Raumgruppen-Nr. 164), Gitterparameter a = 3,148 Å, c = 4,779 Å.[6] In Wasser und alkalischen Lösungen ist Magnesiumhydroxid schwer löslich, dagegen in sauren Lösungen (beispielsweise Salzsäure, Salpetersäure) gut löslich.[7] Auch in Ammoniumsalzlösungen ist Magnesiumhydroxid gut löslich, da durch die Neutralisation von Ammonium und Hydroxid zu Ammoniak und Wasser nur eine geringe Hydroxid-Konzentration erreicht wird und somit das Löslichkeitsprodukt nicht überschritten wird.[8]
Magnesiumhydroxid bildet mit Säuren basische und neutrale Salze.[8]
Bei Temperaturen oberhalb von 350 °C tritt langsam Zersetzung zu Magnesiumoxid ein.[3] Bei 600 °C liegt das Gleichgewicht praktisch auf der Seite des Oxides.[4]
Verwendung
Der größte Teil des für industrielle Zwecke hergestellten Magnesiumhydroxids wird durch Kalzinieren (Brennen) bei 500–600 °C zu Magnesiumoxid weiterverarbeitet.
Magnesiumhydroxid wird als Speiseölzusatz (zum Abbinden von Schwefeldioxid), als Flockungsmittel für die Abwasseraufbereitung, als Flammschutzmittel in thermoplastischen Kunststoffen (Polyolefinen, PVC) und Elastomeren sowie als Zusatzstoff in Reinigungsmitteln verwendet.
In der Medizin kommt es als Antazidum (Arznei zur Neutralisierung der Magensäure) und als mildes Abführmittel zum Einsatz.[9]
Magnesiumhydroxid wird Lebensmitteln als Säureregulator oder Trennmittel zugesetzt. Es ist in der EU als Lebensmittelzusatzstoff mit der E-Nummer E 528 zugelassen.[10][11]
Einzelnachweise
- Eintrag zu E 528: Magnesium hydroxide in der Europäischen Datenbank für Lebensmittelzusatzstoffe, abgerufen am 27. Juni 2020.
- Eintrag zu MAGNESIUM HYDROXIDE in der CosIng-Datenbank der EU-Kommission, abgerufen am 7. März 2020.
- Eintrag zu Magnesiumhydroxid in der GESTIS-Stoffdatenbank des IFA, abgerufen am 22. Dezember 2019. (JavaScript erforderlich)
- Arnold Willmes: Taschenbuch chemische Substanzen. 3. Ausgabe. Harri Deutsch Verlag, 2007, ISBN 9783817117871, S. 682, (eingeschränkte Vorschau in der Google-Buchsuche)
- Bonar Marbun: Kinetik der Hydratation von CaO und MgO. Dissertation, Technische Universität Clausthal, Februar 2006, S. 2 und 4ff. DNB 979684390/34
- L. Desgranges, G. Calvarin, G. Chevrier: Interlayer interactions in M(OH)2: a neutron diffraction study of Mg(OH)2. In: Acta Crystallographica, B52, 1996, S. 82–86, doi:10.1107/S0108768195008275.
- Erwin Riedel, Christoph Janiak: Anorganische Chemie. 7. Auflage. Walter de Gruyter, 2007, ISBN 9783110189032, S. 605, (eingeschränkte Vorschau in der Google-Buchsuche)
- A. F. Holleman, E. Wiberg, N. Wiberg: Lehrbuch der Anorganischen Chemie. 102. Auflage. Walter de Gruyter, Berlin 2007, ISBN 978-3-11-017770-1, S. 1230–1231.
- Eintrag zu Magnesiumhydroxid. In: Römpp Online. Georg Thieme Verlag, abgerufen am 13. Juni 2014.
- Zusatzstoffe in der EU (Memento des Originals vom 8. Dezember 2015 im Internet Archive) Info: Der Archivlink wurde automatisch eingesetzt und noch nicht geprüft. Bitte prüfe Original- und Archivlink gemäß Anleitung und entferne dann diesen Hinweis. (Stand Januar 2015; PDF; 147 kB)
- E 528 - Magnesiumhydroxid, Homepage der Verbraucherinitiative e. V. zu Lebensmittelzusatzstoffen
