Braunkehl-Faultier
Das Braunkehl-Faultier (Bradypus variegatus) ist eine Tierart aus der Familie der Dreifinger-Faultiere (Bradypodidae). Es ist über weite Teile Süd- und Mittelamerikas verbreitet und lebt überwiegend in tropischen Regenwäldern. Das Braunkehl-Faultier ist ein reiner Baumbewohner und ernährt sich von Blättern, wobei einzelne Individuen auf bestimmte Pflanzenarten spezialisiert sind. Es lebt einzelgängerisch und vermehrt sich teils saisonal, wobei jeweils nur ein Junges geboren wird. Charakteristisches Kennzeichen des Braunkehl-Faultiers sind ein namengebender brauner Kehlfleck und ein dunkler Augenstreifen. Die Population des Braunkehl-Faultiers gilt als nicht gefährdet. Die Erstbeschreibung erfolgte im Jahr 1825, allerdings bestand bis weit in das 20. Jahrhundert hinein eine häufige systematische Verwechslung mit dem Weißkehl-Faultier.
| Braunkehl-Faultier | ||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|

Braunkehl-Faultier (Bradypus variegatus) | ||||||||||||
| Systematik | ||||||||||||
| ||||||||||||
| Wissenschaftlicher Name | ||||||||||||
| Bradypus variegatus | ||||||||||||
| Schinz, 1825 |
Beschreibung
Habitus
Das Braunkehl-Faultier erreicht eine Gesamtlänge von 42 bis 80 cm, wobei der Schwanz mit einer Länge von 2,5 bis 9 cm eher stummelartig kurz ist. Das Gewicht variiert von 2,3 bis 5,5 kg, ein ausgesprochener Geschlechtsdimorphismus liegt nicht vor.[1] Allerdings zeigen die einzelnen Populationen merkliche Größenunterschiede. So sind einige Gruppen auf den Inseln vor der Ostküste Mittelamerikas markant kleiner als die des Festlandes. Der kleine rundliche Kopf besitzt 1 bis 1,5 cm lange Ohren, die äußerlich nicht sichtbar, sondern unter dem Fell verborgen sind. Weiterhin ist das Gesicht bräunlich bis gelblich gefärbt, um die Augen herum besteht jedoch eine teils hellere Färbung, zu der je ein dunkler Augenstreifen in Kontrast steht. Der seitliche Kopf, die Kehle, Schultern und der restliche Körper sind braun getönt. Selten treten auch einzelne Tiere mit vollständig heller Fellfärbung auf, was durch Albinismus oder Leuzismus verursacht wird.[2][3] Generell ist die Farbgebung des Fells relativ variabel zwischen den einzelnen Populationen. Bei Männchen tritt auf dem Rücken ein orangefarbener Fleck auf, der von einem vertikalen dunklen Streifen geteilt wird. Die Intensität des Farbflecks nimmt mit dem Lebensalter zu. Allgemein besteht das Fell aus einer dichten, kurzen Unterwolle und darüber liegenden, langen Haaren. Die Langhaare weisen häufig Querbrüche auf, in denen sich symbiotisch lebende Algen einnisten. Dadurch scheint das Fell je nach Lichteinfall einen grünlichen Farbton anzunehmen, was häufiger während der Regenzeit vorkommt. Diese Symbiose dient vor allem der Tarnung vor Fressfeinden.[4] Der Scheitel des Fells liegt, wie bei allen Faultieren, auf dem Bauch, wodurch das Regenwasser besser abfließen kann. Die Arme sind deutlich länger als die Beine. Sowohl Vorder- als auch Hinterbeine enden in Füßen mit je drei funktionalen Zehen, der hintere Fuß ist dabei bis zu 18 cm lang. Vorder- und Hinterfüße tragen hakenförmige Krallen, wobei die jeweils mittlere vergrößert ist. Die vorderen können dabei bis zu 8 cm, die hinteren bis zu 5,5 cm lang werden.[5][6][7]
Schädel- und Gebissmerkmale
Der Schädel wird zwischen 6,8 und 8,6 cm lang. An den Jochbeinen erreicht er eine Breite von maximal 5,4, hinter den Augen aber nur von 3,1 cm. Typisch ist überdies der nicht geschlossene Jochbogen, der aber am vorderen Ansatz einen länglich-schmalen, nach unten gerichteten Fortsatz besitzt. Das Gebiss weist je Hälfte im Oberkiefer 5, im Unterkiefer 4 bis 5 Zähne auf, insgesamt also 18 bis 20. Dabei sind die hinteren Zähne molarenartig gestaltet, der jeweils vordere ist dagegen eher klein, ein Eck- und Schneidezähne sind nicht ausgebildet. Die Länge der oberen Zahnreihe beträgt bis zu 2,7 cm.[1][6]
Lautäußerungen
Es sind nur wenige Lautäußerungen des Braunkehl-Faultiers bekannt. Jungtiere pfeifen, wenn sie von ihrer Mutter getrennt werden, wobei der Laut von 1,9 auf 2,6 kHz ansteigt und knapp eine Sekunde gehalten wird. Aggressive Männchen geben des Weiteren hohe Stimmlaute von sich.[6]
Verbreitung
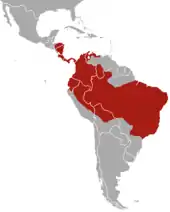
Das Braunkehl-Faultier kommt in weiten Teilen des subtropischen und tropischen Mittel- und des zentralen Südamerikas vor. Sein Hauptverbreitungsgebiet erstreckt sich von Honduras und Nicaragua im Norden über Costa Rica, Panama und Ecuador bis nach Kolumbien, den Norden und Süden Venezuelas, den Osten Perus sowie über weite Teile Brasiliens und Boliviens. Ursprünglich trat es auch im nördlichen Paraguay und Argentinien auf, doch ist es dort wohl ausgestorben. Im nördlichen Südamerika besteht eine Verbreitungslücke nördlich des Amazonas und östlich des Rio Negro bis zum Guayana-Schild. Hier kommt stattdessen das Weißkehl-Faultier (Bradypus tridactylus) vor. Als Lebensraum dienen vor allem die tropische Regen- und Atlantischen Küstenregenwälder (Mata Atlântica). Im östlichen Küstengebiet überschneidet sich der Lebensraum weiterhin mit dem des Kragenfaultiers (Bradypus torquatus), doch kommt lediglich das Braunkehl-Faultier hier in Höhen von über 1500 m vor. Weiterhin sind Vertreter des Braunkehl-Faultiers in teils laubabwerfenden Wäldern, Nebelwäldern und auf Kakaoplantagen nachgewiesen, im Jahr 2017 konnte auch erstmals die Anwesenheit der Art in den Cerrado-Wäldern dokumentiert werden.[8] Die Höhenverteilung insgesamt reicht vom Meeresspiegelniveau bis 2400 m. Das gesamte Verbreitungsgebiet wird mit 10 Millionen Quadratkilometern angegeben und stellt das größte der heute lebenden Faultierarten dar.[9] Dabei ist die Populationsdichte stellenweise recht hoch. Auf Barro Colorado Island im Panama-Kanal beträgt sie bis zu 8,46 Individuen je Hektar (846 Individuen je Quadratkilometer), die Faultierart stellt dabei allein 40 bis 48 % der Biomasse der terrestrischen Säugetiere. In Mamirauá im brasilianischen Bundesstaat Amazonas liegt die Populationsdichte noch bei 6,72 Individuen je Hektar.[10][6] Im kolumbianischen Departamento Antioquia ist sie aber weitaus geringer und wird während der Trockenzeit auf 0,008 bis 0,002 Individuen je Hektar (0,8 bis 0,2 Individuen je Quadratkilometer) berechnet.[11][7]
Lebensweise
Territorialverhalten

Das Braunkehl-Faultier lebt einzelgängerisch und ist sowohl tag- als auch nachtaktiv. Paarbindungen bestehen nur zwischen Mutter- und Jungtier. Überwiegend hält es sich dabei in den Kronen hoher Bäume, häufig mehr als 16 m oberhalb des Erdbodens auf (arboreale Lebensweise). Die meiste Zeit des Tages, zwischen 15 und 18 Stunden, verbringt es mit Schlafen. Zum Schlafen bevorzugt ein Tier Äste oder Astabzweigungen. Diese werden mit den Hinterbeinen umschlungen, der Kopf ruht auf der Brust und die Vorderbeine liegen um den Körper. Diese Position wird auch bei Gewitter eingenommen, da das Braunkehl-Faultier keine natürlichen Unterschlüpfe aufsucht. Die weiteren Tagesaktivitäten umfassen Nahrungsaufnahme, Fortbewegung und Fellpflege. Die einzelnen Häufigkeiten der Aktivitäten im Tagesablauf schwanken aber über das Jahr und sind abhängig von der Jahreszeit. So sind in der Trockenzeit längere Ruheperioden zu beobachten als in der Regenzeit. Die Fortbewegungen erfolgen überwiegend im Geäst sowohl horizontal als auch vertikal und sind sehr langsam. Etwa alle drei Tage wechselt das Braunkehl-Faultier auf einen anderen Baum, was häufig über das Geäst erfolgt.[12][13] Auf dem Boden bewegen sich die Tiere eher unbeholfen fort und vermögen nicht, in eine normale vierfüßige Bewegung zu verfallen. Vielmehr benutzen sie die Hinterfüße, den Ellbogen und die langen Krallen der Vorderfüße. Dagegen sind Braunkehl-Faultiere jedoch ausgezeichnete Schwimmer und halten den Körper dabei weit oben im Wasser.[14] Die täglich (innerhalb von 24 Stunden) für die Nahrungssuche zurückgelegte Strecke liegt bei durchschnittlich 23 bis 38 m, sie kann aber auch auf 133 m ansteigen. Einzelne Tiere benutzen Aktionsräume von 0,1 bis 19,9 ha Größe mit einem Durchschnitt von etwa 5,4 ha.[15] In Gebieten mit einer hohen Populationsdichte erreichen diese nur durchschnittlich 1,6 ha Größe. Allgemein sind kaum Unterschiede in der Ausdehnung der Aktionsräume zwischen den Geschlechtern erkennbar, mitunter können die der weiblichen Tiere geringfügig größer sein als die der männlichen.[10] Innerhalb der Aktionsräume bevorzugen einzelne Tiere nur eine bestimmte Anzahl von Bäumen bevorzugter Baumarten und sind dabei sehr wählerisch. Häufig halten sie sich in Ameisenbäumen auf. Eher selten befindet sich dabei mehr als ein Individuum auf einem Baum. Aggressives Verhalten der Tiere untereinander konnte dabei bisher nur bei wenigen Gelegenheiten beobachtet werden. Es steigt aber in der Fortpflanzungsphase zwischen Männchen und allgemein in Gebieten mit einer hohen Populationsdichte an, dann können auch Weibchen involviert sein. Zumeist kommt es zu Schlägen mit den scharfen Krallen der Vorderfüße, was teilweise mit einer intensiven Lautgebung verbunden ist.[16][17][18] Etwa alle 8 Tage verlässt das Braunkehl-Faultier seinen Baum, um Kot abzulassen. Dafür gräbt es meist mit dem stummelartigen Schwanz eine kleine Kuhle in den Erdboden und verfüllt diese später mit Laub.[6][7]
Nahrung

Das Braunkehl-Faultier ist ein auf weiche Kost spezialisierter Pflanzenfresser. Dadurch nehmen Blätter 99,4 % seiner Gesamtnahrung ein, davon wiederum zu über 67 % junge und zu 27 % ältere Blätter. Untergeordnet frisst es auch Früchte und Blüten. Untersuchte Magenreste ergaben insgesamt 51 verschiedene Pflanzenarten von hauptsächlich Bäumen und Lianen. Einzelne Individuen sind aber jeweils nur auf einige wenige Pflanzenarten spezialisiert, was sie möglicherweise während der Aufzucht vom Muttertier erlernen.[4] Zu den bedeutendsten Nahrungspflanzen gehören Vertreter der Ameisenbäume. Je nach lokaler Verbreitung kommen aber als Ressourcen unter anderem auch Feigen, Lacmellea und Poulsenia in Panama und Coussapoa, Pseudobombax und Piranheiras in Mamirauá in Brasilien vor.[10] Im nördlichen Venezuela konnten auch Zimterlen als benutzte Nahrungsquellen nachgewiesen werden,[12] im nördlichen Kolumbien überdies Cavanillesia, Guazuma und Brownea.[11] Die bevorzugten Pflanzenarten ändern sich weiterhin mit den Jahreszeiten. Beobachtungen in Kolumbien zufolge fraßen einzelne Tiere zur Trockenzeit überwiegend Blätter von Cavanillesia-Vertretern, während sie zur Regenzeit unter anderem jene von Guazuma vertilgten.[13] Da das Braunkehl-Faultier sehr wählerisch ist, verzehrt es in der Regel die Blätter nicht vollständig. Die tägliche Nahrungsmenge liegt bei etwa 192 bis 196 g frischer Blätter, was durchschnittlich 17,3 g Trockenmasse je Kilogramm Körpergewicht entspricht. Die Menge der aufgenommenen Blätter nimmt mit steigender Umgebungstemperatur zu.[19][6][7]
Fortpflanzung
Die Paarungszeit ist wahrscheinlich ganzjährig möglich, jedoch fällt ein Großteil der Geburten saisonal begrenzt in die Regenzeit. Untersuchungen aus Panama zufolge paaren sich die Tiere überwiegend zwischen Januar und März. In der Regel findet die Paarung im Geäst statt, wobei dies Beobachtungen zufolge sowohl mit Männchen und Weibchen im Angesicht zueinander als auch mit dem Männchen auf dem Rücken des Weibchens erfolgen kann. Nach der Paarung trennen sich beide Geschlechter wieder. Bei Studien einer Population in einem stark fragmentierten Waldgebiet in Costa Rica ließ sich ein markant polygynes Verhalten der Männchen feststellen. Demnach erzeugten nur 25 % aller ansässigen Männchen Nachwuchs, wobei 50 % der untersuchten Jungtiere von einem einzigen Männchen abstammten. Eventuell wird diese Fortpflanzungsstrategie durch den waldinsel-artigen Charakter des Lebensraumes hervorgerufen, wodurch einzelne Männchen einen dominanten Status erlangen.[15] Die Tragzeit beläuft sich auf rund sechs Monate (teilweise werden auch nur vier Monate angegeben), danach bringt das Weibchen ein Jungtier zur Welt. Sehr selten wurden bisher Weibchen mit zwei Jungtieren gesichtet.[20] Das Geburtsgewicht beträgt rund 260 bis 340 g, die Länge des Neugeborenen liegt bei 19 cm. Dieses ist vollständig behaart mit dunklem oder hellem Fell und besitzt geöffnete Augen. Die ersten fünf bis sechs Lebensmonate verbringt das Jungtier meist auf dem Bauch, seltener auf dem Rücken der Mutter. Dabei kommt es auch zum gegenseitigen Spielen und Fellputzen miteinander, zudem bewegt sich das Jungtier zeitweise vom Muttertier weg und erlernt das Klettern im Astwerk.[21] Nach rund einem Monat beginnt bereits die Entwöhnung. Die erste feste Nahrung fängt ein Junges nach bereits 4 Tagen an zu fressen, manchmal aber auch erst nach zwei Wochen. Dabei leckt es zuerst Blattreste von den Lippen der Mutter und lernt so die bevorzugte Nahrung kennen. Nach der Entwöhnung ist das Jungtier unabhängig, es bleibt aber bis zu 23 Monate beim Muttertier. Dieses verlässt den Bereich des Aktionsraumes, in dem das Junge großgezogen wurde, mit dem Ende der Säugephase, kehrt aber zu jeder Geburt dorthin zurück. Der Abstand zwischen zwei Geburten liegt bei rund einem Jahr. Das Höchstalter des Braunkehl-Faultiers in freier Wildbahn ist unbekannt.[6][22][7]
Fressfeinde und Feindverhalten

Zu den bedeutendsten Fressfeinden des Braunkehl-Faultiers gehört die Harpyie. Beobachtungen eines nistenden Vogels im östlichen Amazonasgebiet über einen Zeitraum von 15 Monaten ergaben insgesamt 9 erbeutete Braunkehl-Faultiere,[23] wobei weiterhin ermittelt wurde, dass die Greifvögel mitunter mehrfach zum Fressen zu den Kadavern ihrer erbeuteten Tiere zurückkehren.[24] Weiterhin stellt auch der Brillenkauz einen potentiell gefährlichen Räuber für das Braunkehl-Faultier dar,[25] ebenso wie der Jaguar[6] und die Tayra.[26] Vor allem der Abstieg von den Bäumen auf den Erdboden erweist sich für die Tiere als besonders gefährlich, da dadurch die Anzahl an möglichen Beutegreifern signifikant zunimmt. Schätzungsweise etwa die Hälfte aller ausgewachsenen Braunkehl-Faultiere kommt dabei ums Leben.[27]
Parasiten und Kommensalen
Zahlreiche innere und äußere Parasiten befallen das Braunkehl-Faultier. Zu den äußeren gehören vor allem die Zecken der Gattung Amblyomma,[28] weiterhin auch Flöhe wie Polygenis, Moskitos wie Deinocerites und Milben wie Edentalges. Im Fell des Braunkehl-Faultiers leben weiterhin Käfer, so etwa Uroxys und Trichillum, von denen sich wiederum der Gelbkopfkarakara ernährt, indem er sie aus dem Fell herauspickt.[29] Zu den inneren Parasiten zählen hauptsächlich Fadenwürmer. Von Bedeutung sind dabei Leiuris, der sich im Zwölffingerdarm einnistet, und Monierzia.[30] Weiterhin konnten Protozoen wie Endotrypanum und Leishmania sowie der Einzeller Trypanosoma nachgewiesen werden.[6][4]
Eine besondere Beziehung besteht darüber hinaus zu einigen Motten, insbesondere aus der Gattung Cryptoses, die auch „Faultiermotten“ genannt werden. Diese leben ebenfalls im Fell der Faultierart und legen ihre Eier in deren Dung, von dem sich wiederum ihre Larven ernähren.[4] Untersuchungen zufolge besteht ein symbiotisches Verhältnis, da die Motten Stickstoffverbindungen in das Fell abgeben, durch die das Wachstum der im Fell lebenden Algen gefördert wird. Während der Fellpflege frisst das Braunkehl-Faultier die Algen und erhält dadurch wichtige Ergänzungsstoffe, die es durch die eher energiearme Blätterkost nicht aufnehmen kann. Die höhere Konzentration von Algen im Fell verstärkt den Tarneffekt im Geäst, während die Motten durch das Absteigen des Braunkehl-Faultiers vom Baum zur Kotablage so zu ihren Eiablageplätzen gelangen.[27]
Systematik
|
Das Braunkehl-Faultier ist eine von vier Arten aus der Gattung der Dreifinger-Faultiere (Bradypus). Diese wiederum bildet die monotypische Familie der Bradypodidae, die innerhalb der Unterordnung der Faultiere (Folivora) entweder nach skelettanatomischen Merkmalen allen anderen Faultiergruppen als Schwestergruppe gegenübersteht[5][32][33] oder gemäß molekulargenetischen Untersuchungen und Proteinanalysen der Überfamilie der Megatherioidea zugewiesen wird.[34][35] Als nächste verwandte Gruppe innerhalb der heutigen Faultiere sind die Zweifinger-Faultiere (Choloepus) aus der Familie der Choloepodidae anzusehen. Die Faultiere formen gemeinsam mit den Ameisenbären (Vermilingua) die engere Verwandtschaftsgruppe der Zahnarmen (Pilosa), eine Ordnung innerhalb der Nebengelenktiere (Xenarthra). Mit Hilfe molekulargenetischer Untersuchungen konnte eine Abspaltung der Faultiere von der gemeinsamen Linie mit den Ameisenbären im ausgehenden Paläozän vor etwa 58 Millionen Jahren ermittelt werden. Die beiden heute noch lebenden Gattungen Bradypus und Choloepus trennten sich dagegen laut der gleichen Untersuchungen im Oligozän vor rund 29 Millionen Jahren.[31][36]
Innere Systematik der Gattung Bradypus nach Gibb et al. 2015[36]
|

Die Gattung Bradypus diversifizierte sich bereits sehr früh. Im Unteren Miozän vor 19 Millionen Jahren trennte sich zuerst das Kragenfaultier (Bradypus torquatus) von der gemeinsamen Linie des Weißkehl- (Bradypus tridactylus) und des Braunkehl-Faultiers sowie des Zwergfaultiers (Bradypus pygmaeus) ab; die letzten drei Arten bildeten im Verlauf des Mittleren und Oberen Miozän beziehungsweise im Übergang zum Pliozän vor 12 bis 5,7 Millionen Jahren eigene Linien aus.[37][36][38] Die nächstverwandte Art des Braunkehl-Faultiers ist möglicherweise das Zwergfaultier, das sich erst vor rund 10.000 Jahren auf der Insel Escudo de Veraguas vor der Nordküste Panamas durch Inselverzwergung herausdifferenzierte.[5] Fossile Nachweise des Braunkehl-Faultiers sind nicht bekannt.[6][14]
Es werden heute insgesamt sieben Unterarten (ursprünglich neun) unterschieden:[6][14]
- B. v. boliviensis (Gray, 1871); im südwestlichen Amazonasbecken von Bolivien und Brasilien
- B. v. brasiliensis de Blainville, 1840; südöstliches Brasilien in den Hochländern und den angrenzenden atlantischen Tiefländern
- B. v. ephippiger Philippi, 1870; nördliches Kolumbien bis nordwestliches Venezuela, westlich der Anden bis Ecuador, östliches Panama
- B. v. gorgon Thomas, 1926; Kolumbien, auf der Insel Gorgona
- B. v. infuscatus Wagler, 1831, Kolumbien und Venezuela östlich der Anden, östliches Peru und Ecuador, westliches Brasilien,
- B. v. trivittatus Cornalia, 1849; Brasilien, im unteren Amazonasbecken südlich des Amazonas
- B. v. variegatus Schinz, 1825; Brasilien, vom südöstlichen Amazonas bis zur Atlantikküste
Aus genetischer Sicht kann die Population des Braunkehl-Faultiers in zwei Kladen geteilt werden: eine Anden-Gruppe und eine Tieflandgruppe im Amazonasbecken. Beide Gruppen sind monophyletisch, ihre Trennung voneinander erreicht eine zeitliche Tiefe, wie sie auch für die beiden Arten der Zweifinger-Faultiere belegt ist. Aus diesem Grund wurde bereits 2016 vorgeschlagen, die Anden-Klade als eigenständige Art unter der Bezeichnung Bradypus ephippiger anzuerkennen. Die beteiligten Wissenschaftler hoben aber gleichzeitig die Notwendigkeit intensiverer Studien hervor.[39][38]
Die Erstbeschreibung des Braunkehl-Faultiers erfolgte im Jahr 1825 durch Heinrich Rudolf Schinz, den wissenschaftlichen Namen Bradypus variegatus hatte er aber schon im Jahr zuvor informell benutzt. Die Typuslokalität gab erst einhundert Jahre später Robert Mertens mit „Südamerika“, beschränkt auf „Brasilien (wahrscheinlich Bahia)“ an. Im Laufe der Zeit wurden der Faultierart über 50 weitere wissenschaftliche Synonymnamen zugewiesen, darunter auch Bradypus tridactyltus im Jahr 1840 durch Henri Marie Ducrotay de Blainville, der eigentlich für das Weißkehl-Faultier vorbehalten ist. Noch bis in die 1970er Jahre kam es zur häufigen Verwechslung der beiden Arten oder zur falschen Zuordnung von Individuen, was auch für Museumsexemplare gilt. Erst 1982 klärte Ralph M. Wetzel die systematische Zuordnung der wissenschaftlichen Namen für die beiden Faultierarten. Generell unterscheidet sich das Braunkehl-Faultier durch die braune Fellfarbe an der Kehle und die schwarzen Augenstreifen vom Weißkehl-Faultier, dem diese fehlen und das zudem eine goldgelbene Gesichts- und Kehlfarbe besitzt.[40][37] Der Artname variegatus bezieht sich auf die variierenden Farben und Muster der Fellfärbung innerhalb der Faultierart.[6][14]
Gefährdung
Größere Bestandsbedrohungen des Braunkehl-Faultiers sind nicht bekannt. Da die Faultierart in hohem Maße an ihren Lebensraum angepasst ist, reagiert sie aber äußerst empfindlich auf Veränderungen. Die Vernichtung der tropischen Regenwälder stellt dadurch das größte Problem dar, vor allem in Kolumbien und Brasilien, was lokal einzelne Populationen gefährdet. Zudem jagen einige indigene Volksgruppen die Tiere zu Nahrungszwecken. Im nordöstlichen Brasilien und im Amazonasgebiet werden diese zudem zu medizinischen Zwecken verwendet, außerdem dienen gefangene Braunkehl-Faultiere auch als Haustiere. Der illegale Handel nimmt insgesamt zu.[41] Die Art wird in der Roten Liste der IUCN aufgrund der weiten Verbreitung und gebietsweise hohen Populationsdichte als „nicht gefährdet“ (least concern) geführt.[42][6]
Literatur
- D. P. Gilmore, C. P. Da Costa, D. P. F. Duarte: Sloth biology: an update on their physiological ecology, behavior and role as vectors of arthropods and arboviruses. In: Brazilian Journal of Medical and Biological Research. 34 (1), 2001, S. 9–25.
- Virginia Hayssen: Bradypus variegatus (Pilosa: Bradypodidae). In: Mammalian Species. 42, (1), 2010, S. 19–32.
- Jonathan N. Pauli: Bradypodidae (Three-toed sloths). In: Don E. Wilson, Russell A. Mittermeier (Hrsg.): Handbook of the Mammals of the World. Volume 8: Insectivores, Sloths and Colugos. Lynx Edicions, Barcelona 2018, S. 118–132 (S. 130–131) ISBN 978-84-16728-08-4.
Einzelnachweise
- H. Hugh, Genoways, Robert M. Timm: The Xenarthrans of Nicaragua. In: Mastozoologia Neotropical. 10 (2), 2003, S. 231–253.
- Gileno Antonio Araújo Xavier, Maria Adélia Borstelmann de Oliveira, Adriana Alves Quirino, Rinaldo Aparecido Mota: Albinismo Total em Preguiças-de-Garganta-Marrom Bradypus variegatus (Schinz, 1825) no Estado de Pernambuco, Brasil. In: Edentata 11 (1), 2010, S. 1–3.
- Ana Cecília Pires de Azevedo Lopes, Epitacio Correia de Farias Junior, Marco Antônio de Freitas, Karina Theodoro Molina: Primeiro registro de leucismo em Bradypus variegatus (Schinz 1825, Xenarthra: Bradypodidae), município de Maceió, Alagoas, Brasil. In: Edentata 20, 2019, S. 39–43.
- D. P. Gilmore, C. P. Da Costa, D. P. F. Duarte: Sloth biology: an update on their physiological ecology, behavior and role as vectors of arthropods and arboviruses. In: Brazilian Journal of Medical and Biological Research. 34 (1), 2001, S. 9–25.
- Robert P. Anderson, Charles O. Handley, Jr: A new species of three-toed sloth (Mammalia: Xenarthra) from Panamá, with a review of the genus Bradypus. In: Proceedings of the Biological Society of Washington 114, 2001, S. 1–33.
- Virginia Hayssen: Bradypus variegatus (Pilosa: Bradypodidae). In: Mammalian Species 42, (1), 2010, S. 19–32.
- Jonathan N. Pauli: Bradypodidae (Three-toed sloths). In: Don E. Wilson, Russell A. Mittermeier (Hrsg.): Handbook of the Mammals of the World. Volume 8: Insectivores, Sloths and Colugos. Lynx Edicions, Barcelona 2018, S. 118–132 (S. 130–131) ISBN 978-84-16728-08-4.
- Pedro B. Garcia, Flávio H. G. Rodrigues, Adriano G. Chiarello: First record of the brown-throated sloth (Bradypus variegatus Schinz, 1825) in the Cerrado of Minas Gerais, Brazil. In: Edentata 18, 2017, S. 73–77.
- Adriana Garcia Chiarello, Tinka Plese, Nadia Moraes-Barros: Bradypus variegatus. In: Edentata 11 (2), 2010, S. 124–125.
- Adriano Garcia Chiarello: Sloth ecology. An overview of field studies. In: Sergio F. Vizcaíno, W. J. Loughry (Hrsg.): The Biology of the Xenarthra. University Press of Florida, 2008, S. 269–280.
- Juan Fernando Acevedo-Quintero, Diana Sánchez Granada, Tinka Plese: Abundancia y preferencia de hábitat de Bradypus variegatus y Choloepus hoffmanni durante la época seca en dos fragmentos de bosque seco en Arboletes, Antioquia, Colombia. In: Edentata 12, 2011, S. 36–44.
- B. Urbani, C. Bosque: Feeding ecology and postural behaviour of the three-toed sloth (Bradypus variegatus flaccidus) in northern Venezuela. In: Mammalian Biology 72 (6), 2007, S. 321–329.
- Leyn Castro-Vásquez, Marlon Meza, Tinka Plese, Sergio Moreno-Mora: Activity Patterns, Preference and Use of Floristic Resources by Bradypus variegatus in a Tropical Dry Forest Fragment, Santa Catalina, Bolívar, Colombia. In: Edentata 11 (1), 2010, S. 62–69.
- Alfred L. Gardner: Mammals of South America, Volume 1: Marsupials, Xenarthrans, Shrews, and Bats. University of Chicago Press, 2008, S. 158–164 ISBN 978-0-226-28240-4.
- Jonathan N. Pauli, M. Zachariah Peery: Unexpected Strong Polygyny in the Brown-Throated Three-Toed Sloth. In: PLoS ONE 7 (12), 2012, S. e51389, doi:10.1371/journal.pone.0051389.
- Harry W. Greene: Agonistic behavior by three-toed sloths, Bradypus variegatus. In: Biotropica 21, 1989, S. 369–372.
- Elaine Pessoa Pedrosa, Arieno Zevêdo De Araújo, Carla Soraia Soares De Castro: Agonistic interactions in the brown-throated three-toed sloth, Bradypus variegatus (Pilosa: Bradypodidae), in an urban environment in Rio Tinto, Paraíba, Brazil. In: Edentata 19, 2018, S. 42–46.
- Jairo Andrés Díaz Arcia, Julio J. Chacón Pacheco: Nuevos casos de comportamiento agonístico entre machos adultos de Bradypus variegatus en el Caribe colombiano. In: Edentata 20, 2019, S. 26–30.
- Rebecca N. Cliffe, Ryan J. Haupt, Judy A. Avey-Arroyo, Rory P. Wilson: Sloths like it hot: ambient temperature modulates food intake in the brown-throated sloth (Bradypus variegatus). In: PeerJ 3, 2015, S. e875; doi:10.7717/peerj.875.
- Bruna Martins Bezerra, Antonio da Silva Souto, Lewis George Halsey, Nicola Schiel: Observation of brown-throated three-toed sloths: mating behaviour and the simultaneous nurturing of two young. In: Journal of Ethology 26, 2008, S. 175–178.
- C. A. Soares, R. S. Carineiro: Social behavior between mothers and young of sloths Bradypus variegatus Schniz, 1825 (Xenarthra, Bradypodidae). In: Brazilian Journal of Biology 62, 2002, S. 249–252.
- Paula Lara-Ruiz, Adriano Garcia Chiarello: Life-history traits and sexual dimorphism of the Atlantic forest maned sloth Bradypus torquatus (Xenarthra: Bradypodidae). In: Journal of Zoology 267, 2005, S. 63–73.
- Mauro Galetti, Oswaldo de Carvalho Jr.: Sloths in the Diet of a Harpy Eagle Nestling in Eastern Amazon. In: The Wilson Bulletin 112 (4), 2000, S. 535–536.
- Matthew T. Springer, Clayton K. Nielsen, Andrew D. Carver, Nestor J. Correa: Harpy Eagle (Harpia harpyja) Feeding Behavior on a Brown-throated Three-toed Sloth (Bradypus variegates). In: Journal of Raptor Research 45 (1), 2011, S. 100–103.
- James Bryson Voirin, Roland Kays, Margaret D. Lowman, Martin Wikelski: Evidence for Three-Toed Sloth (Bradypus variegatus) Predation by Spectacled Owl (Pulsatrix perspicillata). In: Edentata 8–10, 2009, S. 15–20.
- Carolina Sáenz-Bolaños, Victor Montalvo, Eduardo Carillo, Todd K. Fuller: Tayra (Eira barbara) predation of a brown-throated three-toed sloth (Bradypus variegatus) in Costa Rica. In: Edentata 19, 2018, S. 70–73.
- Jonathan N. Pauli, Jorge E. Mendoza, Shawn A. Steffan, Cayelan C. Carey, Paul J. Weimer, M. Zachariah Peery: A syndrome of mutualism reinforces the lifestyle of a sloth. In: Proceedings of the Royal Society B 281, 2014, S. 20133006, doi:10.1098/rspb.2013.3006.
- Filipe Dantas-Torres, Daniel B. Siqueira, Luciana C. Rameh-De-Albuquerque, Denisson Da Silva E Souza, Alexandre P. Zanotti, Débora R. A. Ferreira, Thiago F. Martins, Michelle B. De Senna, Paulo G. C. Wagner, Marcio A. Da Silva, Maria F. V. Marvulo, Marcelo B. Labruna: Ticks Infesting Wildlife Species in Northeastern Brazil with New Host and Locality Records. In: Journal of Medical Entomology 47 (6), 2010, S. 1243–1246.
- Alan H. Krakauer, Thomas H. Krakaue: Foraging of yellowheaded caracaras in the fur of a three-toed sloth. In: Journal of Raptor Research 33, 1999, S. 270 ()
- Karen D. Sibaja-Morales, Jaqueline B. de Oliveira, Ana E. Jiménez Rocha, Jorge Hernández Gamboa, Jorge Prendas Gamboa, Francisco Arroyo Murillo, Janet Sandí, Yessenia Nuñez, Mario Baldi: Gastrointestinal Parasites and Ectoparasites of Bradypus variegatus and Choloepus hoffmanni Sloths in Captivity from Costa Rica. In: Journal of Zoo and Wildlife Medicine 40 (1), 2009, S. 86–90.
- Frédéric Delsuc, Sergio F Vizcaíno, Emmanuel J. P. Douzery: Influence of Tertiary paleoenvironmental changes on the diversification of South American mammals: a relaxed molecular clock study within xenarthrans. In: BMC Evolutionary Biology 4 (11), 2004, S. 1–13.
- Timothy J. Gaudin: Phylogenetic relationships among sloths (Mammalia, Xenarthra, Tardigrada): the craniodental evidence. In: Zoological Journal of the Linnean Society 140, 2004, S. 255–305.
- Luciano Varela, P. Sebastián Tambusso, H. Gregory McDonald, Richard A. Fariña: Phylogeny, Macroevolutionary Trends and Historical Biogeography of Sloths: Insights From a Bayesian Morphological Clock Analysis. In: Systematic Biology 68 (2), 2019, S. 204–218.
- Frédéric Delsuc, Melanie Kuch, Gillian C. Gibb, Emil Karpinski, Dirk Hackenberger, Paul Szpak, Jorge G. Martínez, Jim I. Mead, H. Gregory McDonald, Ross D.E. MacPhee, Guillaume Billet, Lionel Hautier, Hendrik N. Poinar: Ancient mitogenomes reveal the evolutionary history and biogeography of sloths. In: Current Biology 29 (12), 2019, S. 2031–2042, doi:10.1016/j.cub.2019.05.043.
- Samantha Presslee, Graham J. Slater, François Pujos, Analía M. Forasiepi, Roman Fischer, Kelly Molloy, Meaghan Mackie, Jesper V. Olsen, Alejandro Kramarz, Matías Taglioretti, Fernando Scaglia, Maximiliano Lezcano, José Luis Lanata, John Southon, Robert Feranec, Jonathan Bloch, Adam Hajduk, Fabiana M. Martin, Rodolfo Salas Gismondi, Marcelo Reguero, Christian de Muizon, Alex Greenwood, Brian T. Chait, Kirsty Penkman, Matthew Collins, Ross D. E. MacPhee: Palaeoproteomics resolves sloth relationships. In: Nature Ecology & Evolution 3, 2019, S. 1121–1130, doi:10.1038/s41559-019-0909-z.
- Gillian C. Gibb, Fabien L. Condamine, Melanie Kuch, Jacob Enk, Nadia Moraes-Barros, Mariella Superina, Hendrik N. Poinar, Frédéric Delsuc: Shotgun Mitogenomics Provides a Reference Phylogenetic Framework and Timescale for Living Xenarthrans. In: Molecular Biology and Evolution 33 (3), 2015, S. 621–642.
- Nadia de Moraes-Barros, Juliana A. B. Silva, João Stenghel Morgante: Morphology, molecular phylogeny, and taxonomic inconsistencies in the study of Bradypus sloths (Pilosa: Bradypodidae). In: Journal of Mammalogy 92 (1), 2011, S. 86–100.
- Manuel Ruiz-García, Diego Chacón, Tinka Plese, Ingrid Schuler, Joseph Mark Shostell: Mitogenomics phylogenetic relationships of the current sloth’s genera and species (Bradypodidae and Megalonychidae). In: Mitochondrial DNA Part A 29 (2), 2018, S. 281–299, doi:10.1080/24701394.2016.1275602.
- Nadia Moraes-Barros, Maria Clara Arteaga: Genetic diversity in Xenarthra and its relevance to patterns of Neotropical biodiversity. In: Journal of Mammalogy 96, 2015, S. 690–702.
- Nadia de Moraes-Barros, Ana Paula Giorgi, Sofia Silva, João Stenghel Morgante: Reevaluation of the Geographical Distribution of Bradypus tridactylus Linnaeus, 1758 and B. variegatus Schinz, 1825. In: Edentata 11 (1), 2010, S. 53–61.
- Sergio Moreno, Tinka Plese: The Illegal Traffic in Sloths and Threats to Their Survival in Colombia. In: Edentata 7, 2006, S. 10–18.
- Adriana Garcia Chiarello, Nadia Moraes-Barros, Tinka Plese: Bradypus variegatus. In: IUCN 2013. IUCN Red List of Threatened Species. Version 2013.2. (); zuletzt abgerufen am 6. Februar 2014.
Weblinks
- Bradypus variegatus in der Roten Liste gefährdeter Arten der IUCN 2010. Eingestellt von: Chiarello, A., N. Moraes-Barros & T. Plese, 2008. Abgerufen am 23. Januar 2014.