Glossotherium
Glossotherium ist eine Gattung aus der ausgestorbenen Familie der Mylodontidae, die große bodenlebende Faultiere umfasst. Sie stellt neben Mylodon einen der bekanntesten Vertreter der Familie dar. Rekonstruiert wurden die Tiere zwischen 3 und 4 m lang und möglicherweise bis zu 1700 kg schwer. Der überwiegende Teil der Funde von Glossotherium stammt aus dem Mittleren und Oberen Pleistozän vor circa 300.000 bis 10.000 Jahren, einige wenige datieren älter, möglicherweise bis in das Pliozän vor rund 3 Millionen Jahren zurück. Das Verbreitungsgebiet umfasste weite Teile Südamerikas, östlich der Anden etwa vom 20. bis zum 40. Grad südlicher Breite, wobei im Norden das Amazonasbecken ausgespart blieb. Im westlichen Südamerika sind Funde auch nördlich des Äquators belegt. Die Tiere bewohnten weitgehend die offenen Landschaften der Pampa und der nördlichen Savannenregionen.
| Glossotherium | ||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|

Skelettrekonstruktion von Glossotherium im Naturhistorischen Museum Wien | ||||||||||||
| Zeitliches Auftreten | ||||||||||||
| Spätes Pliozän bis spätes Pleistozän | ||||||||||||
| 3? Mio. Jahre bis etwa 10.000 Jahre | ||||||||||||
| Fundorte | ||||||||||||
| Systematik | ||||||||||||
| ||||||||||||
| Wissenschaftlicher Name | ||||||||||||
| Glossotherium | ||||||||||||
| Owen, 1840 | ||||||||||||
Wie andere Mylodonten war auch Glossotherium an eine mehr oder weniger grashaltige Nahrung angepasst, worauf die breite Schnauze und die Gestaltung der Zähne hinweisen. Bestätigt wird diese Ansicht durch Isotopenuntersuchungen. Der anatomische Bau des Bewegungsapparates lässt auf sich vierfüßig fortbewegende Tiere schließen, die aber auch befähigt waren, in einen zweifüßigen Stand zu wechseln. Bemerkenswert ist der besonders kräftige Bau der Vordergliedmaßen, was zu der Annahme führt, dass Glossotherium im Untergrund wühlte. Große fossile Grabgänge mit entsprechenden Kratzspuren unterstützen diese Vermutung, möglicherweise handelt es sich somit um das größte bekannte grabende Säugetier überhaupt. Der Aufbau des Gehörs zeigt, dass Glossotherium Frequenzen im Infraschall wahrnehmen und mit Hilfe seines voluminösen Nasenraums wohl auch produzieren konnte.
Die Forschungsgeschichte der Gattung ist sehr komplex. Die Erstbeschreibung erfolgte im Jahr 1840 durch Richard Owen. Er verwarf den Gattungsnamen aber bereits zwei Jahre später wieder. In der Folgezeit führte dies zu einer anhaltenden Verwechslung und Gleichsetzung mit Mylodon und anderen Formen, was erst in den 1920er Jahren aufgelöst wurde. Vor allem im Verlauf des 20. Jahrhunderts galt Glossotherium als identisch mit dem nordamerikanischen Paramylodon. Erst seit den 1990er Jahren setzte sich die Erkenntnis durch, dass beide Gattungen unabhängig voneinander sind.
Merkmale
Körpergröße
Glossotherium war ein mittelgroßer bis großer Vertreter der Mylodonten. Rekonstruiert besaßen die Tiere eine Gesamtlänge von 3 bis 4 m.[1] Ein vollständig montiertes Skelett war insgesamt 335 cm lang, wovon etwa 90 cm der Schwanz einnahm.[2] Das Gewicht betrug bei grazileren Formen etwa 500 bis 1000 kg, bei robusteren 1200 bis 1700 kg. Wie alle bodenlebenden Faultiere verfügte Glossotherium über einen massigen Körper mit kurzen und kräftigen Gliedmaßen. Der Kopf war langgestreckt und der Schwanz im Vergleich zu den heutigen baumlebenden Faultieren sehr lang.[3][4][5]
Schädel- und Gebissmerkmale

_BHL33598524.jpg.webp)
_(20860570462).jpg.webp)
Der Schädel von Glossotherium war typischerweise röhrenförmig langgestreckt und rechteckig in der Auf- und Seitenansicht. Seine Länge variierte nach Vermessung an rund einem Dutzend Exemplaren von 39,6 bis 46,8 cm, die Breite betrug im vorderen Schnauzenbereich durchschnittlich 16,0 cm, hinter den Augen 15,4 cm und am hinteren Ende 18,3 cm.[6] Auffälliges Kennzeichen war die sehr verbreiterte Region des vorderen Rostrums. Das verwandte Mylodon besaß dagegen einen anders strukturierten Schädel, der langschmal in der Form war und einen geschlossenen Nasenbogen aufwies, der durch das nach vorn gewölbte und am vorderen Ende mit dem Mittelkieferknochen verwachsene Nasenbein entstand.[7][8] Im Aussehen und in den Größenmaßen überschnitt sich der Schädel von Glossotherium mit dem des nahe verwandten Paramylodon. Allgemein zeigte sich der Schädel von Glossotherium aber deutlich robuster und breiter als der von Paramylodon und besaß in Seitenansicht abweichend von letzterem eine domartige Aufwölbung der Stirnlinie. Auch trat bei Glossotherium in der Aufsicht eine stärkere Einschnürung im Bereich des Tränenbeins auf. Der generell breitere Schädel bei Glossotherium resultierte auch in einer breiteren Nasenöffnung, wobei die Breite die Höhe übertraf. Bei Paramylodon waren Breite und Höhe der Nasenöffnung etwa gleich groß. Darüber hinaus standen auch die parasagittalen Leisten am Scheitelbein weiter auseinander als bei Paramylodon. In Übereinstimmung mit den meisten anderen Faultieren war der Mittelkieferknochen bei Glossotherium nur lose mit dem Nasenbein verbunden, bei Mylodon bestand zwischen beiden Knochen aufgrund des geschlossenen Nasenbogens ein fester Kontakt. Wiederum entsprechend der meisten anderen Faultiere aber abweichend von Paramylodon war der Jochbogen bei Glossotherium nicht geschlossen. Er bestand aus einem vorderen und hinteren Bogenabschnitt. Der hintere, am Schläfenbein ansetzende, besaß eine fingerförmige Gestalt. Der vordere, am Jochbein beginnende, wies drei Fortsätze auf: einen aufsteigenden, einen absteigenden und einen horizontal orientierten. Das Hinterhauptsbein zeigte in Ansicht von hinten eine gedrückte Kontur mit deutlichen Verschmälerungen oben und unten. Dadurch unterschied es sich von der eher ovalen Form bei Lestodon und der fast kreisrunden bei Mylodon.[9] Weitere Besonderheiten waren im Bereich der Schädelbasis ausgebildet. Hier zeigte sich das Gaumenbein bei Glossotherium nicht ganz so lang wie bei Paramylodon, da es hinter dem letzten Backenzahn deutliche Kürzungen aufwies. Dafür waren die Flanken des Flügelbeins bei Glossotherium stärker aufgebläht und somit der Abstand zwischen diesen geringer. Ähnliche Bildungen finden sich auch bei zahlreichen anderen Faultieren, ihre Funktion ist aber unklar.[10][6][11]

_BHL33598539.jpg.webp)
Der Unterkiefer maß bezugnehmend auf rund ein halbes Dutzend Fundobjekte zwischen 30,1 und 37,0 cm in der Länge und war dadurch durchschnittlich kürzer als der von Paramylodon.[6] Der horizontale Knochenkörper verfügte über einen äußerst robusten Bau, er nahm von vorn nach hinten an Höhe zu und erreichte unterhalb des letzten Zahnes ein Maximum von 9,5 cm. Die Unterkante des Unterkiefers verlief wie bei anderen Mylodonten gerade.[12] In Bezug auf den Gelenkfortsatz ragte dieser im Vergleich zum Kronenfortsatz weniger hoch als bei Paramylodon, demzufolge saß das Unterkiefergelenk bei Glossotherium somit durchschnittlich tiefer. Der gesamte Kronenfortsatz erreichte eine Höhe von 14,8 bis 18,0 cm und befand sich deutlich über der Kauebene, der vordere Rand des Fortsatzes war bei Glossotherium stärker aufgewölbt als bei Paramylodon. Ein auffallendes Merkmal stellt die Symphyse dar, die außerordentlich breit war und somit die breite Schnauze widerspiegelt. Sie endete hinten auf Höhe des ersten Zahns, besaß vorn zudem einen für Faultiere typischen löffel- oder spatelartigen Fortsatz, der ebenfalls breit war und in einem Winkel von 45° aufstieg, aber nicht die Kauebene der Zähne erreichte. Als charakteristischer Unterschied zu Paramylodon kragte der seitliche Rand dieses Fortsatzes bei Glossotherium deutlich weiter aus.[10][6][11]
Das Gebiss war entsprechend den anderen Faultieren stark reduziert, es bestand im Oberkiefer aus je fünf Zähnen pro Kieferhälfte und im Unterkiefer aus je vier, insgesamt setzte es sich also aus 18 Zähnen zusammen. Der jeweils vorderste Zahn im Kieferast wies eine eckzahnartige (caniniforme) Gestalt auf, die darauf folgenden waren molarenartig (molariform). Diese Gebisstruktur wird als stammesgeschichtlich urtümlich innerhalb der Faultiere angesehen. Abweichend von Paramylodon und Mylodon hatte Glossotherium die caniniformen Zähne immer ausgebildet. Bei Paramylodon waren die des Oberkiefers teilweise reduziert. Mylodon hingegen besaß überhaupt keine caniniformen Zähne, bei ihm waren die oberen zurück gebildet, die unteren jedoch zu molarenartigen umgestaltet. Die caniniformen Zähne zeigten einen ovalen oder triangulären Querschnitt, zum hinteren Gebiss bestand ein kurzes Diastema. Die molarenartigen Backenzähne von Glossotherium wiesen eine flache Kaufläche mit einem etwas erhöhten Rand auf. Sie besaßen den für Mylodonten typischen zweilappigen Umriss mit einer starken Einschnürung in der Mitte. Nur der vorderste Backenzahn des Oberkiefers war in seiner Form eher quadratisch, was wiederum einen Unterschied zum eher lang-rechteckigen ersten molariformen Zahn bei Paramylodon darstellt. Auch beim zweiten oberen Backenzahn finden sich Unterschiede in der Gestaltung zwischen den beiden Gattungen, da die zweilappige Struktur bei Glossotherium weniger deutlich ausgeprägt war als bei Paramylodon. Wie bei allen Faultieren fehlte den Zähnen typischerweise der Zahnschmelz. Stattdessen bestanden sie im Innern aus einer weicheren, außen aus einer härteren Variante des Zahnbeins (Vasodentin und Orthodentin), hinzu kam noch eine Schicht Zahnzement.[13] Die Länge der oberen Zahnreihe variierte zwischen 11,6 und 16,3 cm, lag im Durchschnitt aber bei 14,4 cm, die molarenartigen Backenzähne nahmen davon rund 11,2 cm ein. Die sich nach vorn verbreiternden Schnauze bedingte, dass die Zahnreihen divergierend zueinander verliefen.[6]
Körperskelett
Die Wirbelsäule bestand aus 7 Hals-, 16 Brust-, 3 Lenden-, 7 Kreuzbein- und wenigstens 20 Schwanzwirbel. Allerdings war das Kreuzbein als Synsacrum ausgebildet, das mit den Lendenwirbeln und dem letzten Brustwirbel eine Einheit formte, da die Dornfortsätze der entsprechenden Wirbel miteinander verbunden und die Wirbelkörper teilweise verwachsen waren. Die Wirbelsäule vollführte eine S-förmige Schwingung, dabei war der tiefste Punkt am vierten Hals-, der höchste Punkt am 15. Brustwirbel erreicht. Die Dornfortsätze der Brustwirbel ragten schräg nach hinten, der des achten Wirbels wurde bis zu 14 cm lang. Alle Brustwirbel trugen Rippen, von denen die ersten neun Paare mit dem Brustbein fest verbunden waren. Die vordersten Schwanzwirbel waren äußerst massiv und ähnelten noch den übrigen Rückenwirbeln mit Wirbelbogen sowie Quer- und Dornfortsätzen. An der Unterseite bestanden zudem Chevronknochen, alles in allem war der vordere Schwanzabschnitt so gestaltet, dass er eine äußerst kräftige Muskulatur tragen konnte. Nach hinten nahm die Größe der Schwanzwirbel aber stark ab.[2][14]
Das postcraniale Skelett ist nur in wenigen Fällen vollständig überliefert, folgende Angaben beziehen sich auf verschiedenste Fundobjekte, deren Anzahl zwischen Einzelstücken bis hin zu über ein Dutzend Exemplare variiert.[15] Der Oberarmknochen besaß eine etwa säulenartige, kurze Gestalt, er verbreiterte sich zum unteren Gelenkende aber massiv und wirkte dort spatelartig. Seine Länge variierte von 32 bis 42 cm. Den Schaft umlief eine massive deltopectorale Leiste, ein Knochenkamm, der als Ansatzstelle für die Oberarm- und Schultermuskulatur diente. Insgesamt war der Humerus auch im Vergleich zu dem des riesenhaften Megatheriums extrem robust gebaut. Ähnliches gilt für Elle und Speiche. Letzterer Knochen wurde 24 bis 30 cm lang, ersterer bis zu 36 cm. An der Elle war das obere Gelenkende, das Olecranon auffallend verlängert. Der Oberschenkelknochen war kurz sowie robust. Er maß zwischen 44 und 52 cm in der Länge. Er hatte typisch für bodenbewohnende Faultiere eine brettartig flache, aber breite Gestalt, der Schaft verjüngte sich allerdings von oben nach unten, so dass er nahe dem oberen Gelenkende rund doppelt so breit war wie nahe dem unteren. Durch die hohe Breite des Schaftes war der dritte Rollhügel (dritter Trochanter) nicht deutlich ausgebildet. Der halbkugelige Gelenkkopf setzte sich markant ab, saß aber nicht auf einem ausgeprägten Hals. Der seitlich anschließende Große Rollhügel verlief nahezu gerade und bog dann in einem rechten Winkel zum Schaft ab. Das untere Gelenkende saß etwas asymmetrisch, wobei die äußere Gelenkrolle deutlich größer war als die innere. Im Vergleich zum Oberschenkelknochen war das Schienbein extrem kurz und erreichte mit Maßen von 23 bis 25 cm nicht einmal dessen Hälfte der Länge. Die Gelenkenden luden weit aus, das obere (Kniegelenk) besaß eine Breite von drei Viertel der Schienbeinlänge. Ähnlich wie beim Femur war der Schaft der Tibia deutlich abgeflacht. Das nahezu dreieckig-prismatisch wirkende Wadenbein war mit dem Schienbein nicht fest verwachsen.[2][14][15][16]
_(20843964616).jpg.webp)
Der Aufbau der Hände und Füße ähnelte dem der anderen großen Mylodonten wie etwa Paramylodon, Mylodon und Lestodon, jedoch gibt es einzelne Abweichungen zueinander. Die Hand besaß insgesamt fünf Strahlen (I bis V), krallentragend waren aber nur die drei inneren Strahlen (I bis III). Die Mittelhandknochen nahmen vom ersten zum vierten Strahl an Größe zu, der dritte Metacarpus wurde teilweise bis zu 11 cm lang. Der fünfte erreichte wiederum die Ausmaße des dritten, besaß aber einen massiven und breiten Bau. Als Besonderheit der großen bodenbewohnenden Faultiere war der Mittelhandknochen des ersten Strahls mit dem Großen Vieleckbein zu einer Einheit verwachsen (der sogenannte Metacrapal Carpal Complex oder MCC), ebenso fusionierten hier die ersten beiden Fingerglieder. An den Strahlen II und III bestanden jeweils drei Fingerglieder, die ersten beiden waren aber sehr kurz. Die jeweiligen Endglieder aller drei Innenstrahlen verfügten über ausgedehnte Krallenfortsätze, was auf dementsprechend große Krallen schließen lässt. Die Fortsätze erreichten Längen von bis zu 16,5 cm und eine Höhe von 4,8 cm. Die Fingerglieder der krallenlosen äußeren Strahlen waren in ihrer Anzahl und Größe stark reduziert.[17][18][19][20] Der Fuß wies insgesamt vier Strahlen (II bis V) auf, der innerste Strahl (I) war vollständig zurückgebildet. Krallen besaßen nur die Zehen II und III, die auch am kräftigsten ausgebildet waren. Die Mittelfußknochen der beiden inneren Strahlen besaßen nur kurze Längen, während die der äußeren, krallenlosen Zehen äußerst massiv und lang wurden. Die beiden ersten Zehenglieder des innersten (zweiten) Strahls waren miteinander verwachsen und entsprachen damit dem ersten Strahl der Hand. Am nachfolgenden dritten Strahl bestanden drei Zehenglieder, was mit Lestodon übereinstimmt aber markant von Paramylodon abweicht, bei dem hier teilweise ebenfalls nur zwei Glieder ausgebildet waren. Die jeweiligen Endphalangen mit Krallen wiesen analog der Hand einen äußerst kräftigen Bau auf und besaßen massive Krallenfortsätze. An den äußeren Strahlen waren die Anzahl und Größe der Zehenglieder wiederum vergleichbar zur Hand stark reduziert.[18][19]
Osteoderme
Mylodonten sind die einzige Faultiergruppe, in deren Haut kleine Knochenplättchen, sogenannte Osteoderme eingebettet waren. Derartige verknöcherte Hautbildungen sind innerhalb der Säugetiere heute nur bei den Gürteltieren belegt. Allerdings bildeten bei den Mylodonten die Knochenplättchen keinen festen Panzer, sondern waren eher regellos in der Haut verteilt, wie Funde von Hautresten von Mylodon zeigen.[21] Von Glossotherium wurden forschungsgeschichtlich schon sehr früh Osteoderme entdeckt, bereits 1865 hatte Hermann Burmeister Funde aus der Gegend des Río Salado in Ecuador vorgestellt. Diese wiesen einen rhombischen, trapezförmigen oder unregelmäßig elliptischen Umriss auf und waren zwischen 0,7 und 2,5 cm lang. Sie besaßen eine geraute Oberfläche mit unregelmäßigen Eintiefungen von 2 bis 3 mm Durchmesser, während die Unterseite glatt und konvex gestaltet war.[22] Die Verteilung der Knochenplättchen über den Körper der Tiere ist unbekannt, an der Fundstelle Toca dos Ossos im brasilianischen Bundesstaat Bahia waren die Skelettreste eines Individuums jedoch mit rund 2500 Osteodermen assoziiert.[23] Untersuchungen dieser knöchernen Strukturen von „Glossotherium“ chapadmalense, dessen Stellung innerhalb der Gattung aber eher unsicher ist, ergaben, dass diese im Querschnitt einfacher strukturiert waren als die der Gepanzerten Nebengelenktiere. Sie hatten einen kompakten Aufbau und bestanden aus zahlreichen Faserbündeln vermischt mit harten Knochenlamellen (Osteome).[24][23]
Verbreitung und wichtige Fossilfunde
Überblick und frühes Auftreten
Glossotherium war in Südamerika weit verbreitet, ist dort aber weitgehend nur aus dem Pleistozän bekannt. Eine Ausnahme bildet die umstrittene Form „Glossotherium“ chapadmalense, die aus dem Mittleren Pliozän (lokalstratigraphisch Chapadmalalan) vor rund 4 bis 3 Millionen Jahren belegt ist. Funde stammen unter anderem aus der Typuslokalität bei Miramar in der argentinischen Provinz Buenos Aires und umfassen einen 39 cm langen Schädel mit Unterkiefer und einen ersten Halswirbel.[25] Weitere Funde in Form von mehreren Unterkieferfragmenten wurden aus Inchasi etwa 50 km südöstlich von Potosí im bolivianischen Departamento Potosí berichtet, die Fundstelle liegt in einer Höhe von 3220 m über dem Meeresspiegel.[26]
Der weitaus überwiegende Teil der Funde von Glossotherium datiert in das jüngere beziehungsweise in das ausgehende Pleistozän (Spätphase der lokalstratigraphischen Stufe Lujanian). Ältere, noch aus dem Mittelpleistozän stammende Funde sind sehr selten, dazu gehört etwa ein rechtes Sprungbein aus La Huaca in der nordperuanischen Region Piura, das etwa 304.000 Jahre alt ist.[27] Im darauffolgenden Jungpleistozän ist dann Glossotherium über weite Teile Südamerikas verbreitet. Östlich der Anden liegen Funde aus einem Bereich zwischen dem 40. und 20. Grad südlicher Breite vor, im westlichen Südamerika auch von Gebieten nördlich des Äquators. Das Amazonas-Becken ist dabei weitgehend ausgespart. Das Hauptverbreitungsgebiet umfasst das zentrale und nördliche Argentinien, Uruguay und das südliche Brasilien. Weitere bedeutende Fundstellen sind unter anderem aus den Küstenbereichen im Südosten und Osten Brasiliens in den Bundesstaaten Paraná, Minas Gerais und Bahia belegt. Herausragend hier ist Toca dos Ossos in Bahia, wo über hundert Fundobjekte zuzüglich zahlreicher Osteoderme mehrerer Individuen zu Tage traten.[23] Darüber hinaus konnte die Gattung in Venezuela, in Kolumbien, in den Küstentiefländern beziehungsweise (seltener) in den Andengebieten von Ecuador, Peru und Chile sowie in Bolivien nachgewiesen werden.[11][28] Aus Chile bildet ein nahezu vollständiges Skelett von Lonquimay in der Región de la Araucanía das bisher einzige Belegstück der Gattung in dem Land.[29] Dagegen kommt aus Ecuador und Peru umfangreiches Schädelmaterial, das neben ausgewachsenen auch mehrere jüngere Individuen einschließt.[30][31] In ebenfalls singulärer Fund in Form eines Schädelknochens konnte von der Insel Trinidad erbracht werden.[32] Die Tiere lebten vor allem in offeneren Landschaften wie etwa die Pamparegionen des zentralen Südamerikas (Argentinien, Uruguay und Brasilien), aber auch die weiter nördlichen Savannenlandschaften. Hauptsächlich in der Pampa überschneidet sich das Vorkommen mit denen der anderen großen Mylodonten des pleistozänen Südamerikas, Mylodon und Lestodon. An einzelnen Fundlokalitäten wie in Arroyo del Vizcaíno[33] im südlichen Uruguay oder am Fluss Chuí[34] im südöstlichen Brasilien kommen alle drei Mylodontengattungen gemeinsam vor.[28]
Terminale Nachweise
Der häufige Nachweis von Glossotherium zum Ende des Pleistozäns verläuft zeitgleich mit dem Verschwinden der Gattung im Zuge der Quartären Aussterbewelle. Die spätesten Funde der Gattung überschneiden sich auch mit der Ankunft früher Jäger-und-Sammler-Gruppen im südlichen Amerika. Ob die frühen menschlichen Besiedler Amerikas aber direkt Einfluss auf das Verschwinden des Bodenfaultiers nahmen, ist ungeklärt, eindeutige Interaktionen sind nur wenige bekannt. Zu den wenigen Fundstellen mit Hinterlassenschaften von Jäger-Sammler-Gruppen vergesellschaftet mit Resten von Glossotherium gehört unter anderem jene von Arroyo Seco 2, einer mehrphasigen archäologischen Fundstelle in der argentinischen Provinz Buenos Aires, deren Alter mit Hilfe der Radiocarbonmethode auf etwa 12.400 bis 7.300 C14-Jahre vor heute datiert wird. Neben zahlreichen Steinartefakten, die vor allem feinere Präparationsabfälle zur Herstellung von Werkzeugen mit scharfen Schneidkanten beinhalten, wurden auch Knochenreste großer Säugetiere gefunden, darunter auch einige wenige Knochen von Glossotherium. Direkte Altersbestimmungen an diesen Funden verweisen darauf, dass die Glossotherium-Reste im früheren Abschnitt der Sedimentbildung eingelagert wurden (vor circa 12.240 bis 10.500 Jahre BP).[35][36] Eine weitere bedeutende Fundstelle ist Paso Otero 5 ebenfalls in der Provinz Buenos Aires gelegen. In der seit 1994 untersuchten archäologischen Fläche kamen mehr als 80.000 Knochenfragmente zu Tage, die aber zum Teil stark zerschlagen waren und so kaum bestimmt werden konnten. Die zuordenbaren Knochen schlossen zwei Knochenfragmente von Glossotherium ein. Daneben wurden auch etwa 80 steinerne Werkzeuge aus Quarzit entdeckt, darunter unter anderem Fischschwanz-Spitzen (fish tail points). Das Alter der Fundstelle liegt bei 10.440 bis 10.190 Jahre BP, die Bestimmung erfolgte in diesem Fall aber nicht an den Resten von Glossotherium, sondern von Megatherium.[37][38][35][39] Vereinzelte Hinweise sind auch aus anderen Teilen Südamerikas überliefert, jedoch in ihrer Interpretation unsicher. Aus dem Abri von Santa Elina im brasilianischen Bundesstaat Mato Grosso beispielsweise wurde in den 1990er Jahren ein Lagerplatz mit Resten einer Feuerstelle untersucht, in dessen Umgebung Kiefer- und Wirbelteile sowie hunderte Osteoderme von Glossotherium lagen. Das Alter der Feuerstelle wurde auf rund 10.120 C14-Jahre BP datiert. Eines der Osteoderme war durchbohrt, was aber auch auf biogene Einflüsse zurückgeführt werden kann. Andererseits ist die direkte Beziehung der Glossotherium-Relikte zu der Feuerstelle weitgehend ungeklärt.[40][41] In Taima-taima an der Küstenzone des nordzentralen Venezuelas kamen neben einem Skelett von Notiomastodon, in dessen Körper eine Projektilspitze des El-Jobo-Typs steckte, einzelne Reste von Glossotherium zu Tage, die möglicherweise aber nicht im direkten Zusammenhang mit dem Jagdplatz stehen. Das Alter der Sedimente, in denen die Funde eingebettet sind, liegt bei etwa 13.390 bis 12.580 Jahre vor heute.[42][43]
Paläobiologie
Sexualdimorphismus
An einigen Schädeln lassen sich Unterschiede in der Ausprägung einzelner Merkmale erkennen. So kommen Individuen mit im Querschnitt ovalen und kleinen caniniformen Zähnen vor, bei anderen sind sie dreieckig und größer. Häufig gehen große eckzahnartige Zähne mit divergierenden Zahnreihen einher, kleinere mit parallel verlaufenden. Dazu kommen auch gewisse metrische Differenzen in der Bezahnung und am Unterkiefer. Die Variationen werden als ein Ausdruck eines Geschlechtsdimorphismus gedeutet mit größeren Zähnen bei männlichen und kleineren bei weiblichen Tieren. Ähnliches ließ sich auch beim nahe verwandten Paramylodon feststellen.[44][23]
Fortbewegung

Entsprechend den anderen großen Bodenfaultieren bewegte sich Glossotherium überwiegend vierfüßig fort. Auffallend ist der für Mylodonten typische sehr kurze untere Beinabschnitt gegenüber dem oberen. So erreicht der Oberschenkelknochen beim Typusexemplar von Glossotherium eine Länge von 48 cm, das Schienbein ist dagegen nur 21 cm lang,[2] was weniger als der Hälfte entspricht.[3][15] Verkürzte untere Beinlängen stehen häufig in Verbindung mit einem schwerfälligen Gang, vergleichbar den heutigen Nashörnern, während lange untere Beinabschnitte wie bei den Pferden mit einer agileren Fortbewegung einhergehen. Bezugnehmend auf einen zu Glossotherium vergleichbar großen Vertreter der Bodenfaultiere besaß Pyramiodontherium aus der Gruppe der Megatheriidae mit 49 beziehungsweise 47 cm annähernd gleich lange obere und untere Beinabschnitte. Das Verhältnis entspricht in etwa dem der heutigen Lamas. Demnach dürften sich die Mylodonten einschließlich Glossotherium deutlich schwerfälliger bewegt haben als die Megatherien.[45] Beim Laufen setzte Glossotherium die Hinterfüße auf die Außenkante, also auf den fünften Strahl, wodurch die Fußsohle nach innen gerichtet war. Die Art der Fortbewegung wird pedolateral bezeichnet und ist mit Ausnahme der Megalonychidae bei allen bodenlebenden Faultieren ausgebildet; die Drehung des Fußes bewirkte einen auffälligen Umbau des Fußskelettes. Zusätzlich zum fünften Strahl berührte bei den Mylodonten das Fersenbein auf seiner gesamten Länge den Boden. Dadurch war der Fuß weniger stark aufgewölbt als bei den verwandten Scelidotheriidae, bei denen nur das hintere Ende des Fersenbeins in Kontakt mit dem Boden stand.[46]
Eindeutige Trittsiegel von Glossotherium sind bisher nicht belegt, mitunter werden aber einzelne Spuren großen Mylodonten zugewiesen wie aus Playa Del Barco und Pehuén-Có, beide Fundstellen liegen bei Bahía Blanca in der argentinischen Provinz Buenos Aires. Vor allem die 1986 entdeckte Fundstelle Pehuén-Có hat eine große Bedeutung, da hier zahlreiche Fährten über eine Fläche von 1,5 km² verstreut überliefert sind. Sie wurden von den verschiedensten Tieren in dem damals weichen Untergrund hinterlassen. Hierzu gehören Kamelartige wie Megalamaichnum (Hemiauchenia), Südamerikanische Huftiere wie Eumacrauchenichnus (Macrauchenia) oder große Gürteltierverwandte wie Glyptodontichnus (Glyptodon), zudem auch einzelne Vertreter der Vögel. Das Alter wird mit rund 12.000 Jahre angegeben. Faultiere sind einerseits mit dem extrem großen Neomegatherichnum belegt, das wohl Megatherium entspricht, andererseits mit Mylodontidichnum, einem Mylodonten. Von Mylodontidichnum liegen rund drei Dutzend Trittsiegel sowohl von der Hand als auch dem Fuß vor. Die Abdrücke ersterer sind durchschnittlich 23 cm lang und 19 cm breit, entsprechende Maße für letzteren lauten 53 cm und 27 cm. Sie besitzen jeweils einen nierenförmigen Umriss, was dem pedolateralen Aufsetzen des Fußes entspricht. Am vorderen Ende sind jeweils drei Strahlen erkennbar, an denen sich noch die Krallen abheben, die bis zu 8 cm lange Spuren hinterließen. Das Überwiegen von Fußabdrücken lässt annehmen, dass sich die Mylodonten einerseits vergleichbar den Megatherien gelegentlich in besonderen Situationen auf den Hinterbeinen aufrichteten, andererseits besteht die Möglichkeit, dass im vierfüßigen Gang die größeren Füße die kleineren Hände überdeckten, wie es auch bei Megatherium und Paramylodon dokumentiert ist.[47][48]
Häufig wird diskutiert, ob Mylodonten zum Graben befähigt waren. Bei Glossotherium sind die sehr kräftigen Vordergliedmaßen, die sich etwa 30 % robuster zeigen als die Hintergliedmaßen, besonders auffällig. Die Elle besitzt einen ausgedehnten oberen Gelenkfortsatz, der hier ansetzende Triceps-Muskel kann dadurch die Hebelkraft des Unterarms enorm verstärken und Kraft entfalten. So beansprucht das Olecranon bei einer Gesamtlänge des Knochens von 36 cm rund 13 cm, was etwa 35 % entspricht. Der Wert liegt im unteren Bereich der heutigen Gürteltiere, die mitunter als gute Gräber in Erscheinung treten.[4] Darüber hinaus sind die Hände mit den markanten krallentragenden Strahlen II und III geeignet, im Erdreich zu wühlen. Demnach widerstanden die symmetrischen und deutlich gebogenen Krallen laut Belastungsanalysen gut den dabei auftretenden Zug- und Kompressionskräften.[49][50] In der Region um Mar del Plata in der argentinischen Provinz Buenos Aires wurden einige alte, begrabene Baue von Tieren ausgegraben, deren Altersdatierung vom Alt- bis zum Jungpleistozän reicht. Es handelt sich teilweise um ausgesprochen große Gangsysteme mit einem Durchmesser bei 80 bis 180 cm und einer Länge, die mitunter bis zu 40 m betragen kann. Die größeren dieser Strukturen könnten mit Glossotherium in Verbindung stehen, dessen Beckenbreite von etwa 120 cm gut zur Gangbreite korreliert. Auch fanden sich an einigen Wänden parallelrillige Kratzspuren von bis zu 110 cm Länge und mit einem Rillenabstand von 3 bis 4 cm, was ebenfalls mit der Hand von Glossotherium übereinstimmt. Teilweise enthalten die Gänge tiefere, bis zu 240 cm durchmessende Kuhlen, deren Entstehung mit dem Scheuern des Fells der Tiere auf dem Untergrund in Verbindung gebracht wird und möglicherweise als Ruheplätze fungierten. Ähnliche Strukturen sind auch aus dem südöstlichen Brasilien bekannt.[51][52] Aufgrund dieser Hinweise könnte der Faultiervertreter eines der größten bekannten Säugetiere sein, das eine grabende Lebensweise verfolgte. Heute nimmt diese Stellung das Erdferkel mit einem Gewicht von bis zu 65 kg ein. Phascolomus, ein ausgestorbener Wombat, der ebenfalls im Pleistozän lebte, galt mit einem geschätzten Körpergewicht von 200 bis 300 kg lange als das größte grabende Säugetier.[53][54] Die möglicherweise grabende Lebensweise wurde dadurch unterstützt, dass der Körperschwerpunkt bei Glossotherium wie bei anderen Bodenfaultieren sehr weit hinten liegt. Dadurch ruhte etwa 69 % der Körperlast auf den Hinterbeinen. Der weit nach hinten verlagerte Körperschwerpunkt befähigte die Tiere auch, sich leichter auf den Hinterbeinen aufzurichten und so die Arme frei für das Graben zu bekommen. Eine halb aufgerichtete oder halb hockende Position ist vor allem von den heutigen Gürteltieren beim Graben bekannt.[4] Als weiteres Indiz für eine grabende Tätigkeit bei Glossotherium kann eine häufig vollständige oder partielle Verwachsung der ersten beiden Brustwirbel gewertet werden, was unter anderem bei zahlreichen Kleinsäugetieren mit entsprechender Lebensweise vorkommt. Es ist aber nicht ganz eindeutig, ob hier ein pathologischer Befund vorliegt oder aber die Verwachsungen evolutiv unterstützend infolge einer starken Beanspruchung des Nackens etwa bei Grabbewegungen mit dem Kopf entstanden. Andere sehr große Bodenfaultiere wie etwa Megatherium weisen solche Bildungen im Bereich der Brustwirbelsäule nicht auf.[55] Als mögliche Ursachen für eine grabende Lebensweise bei Glossotherium werden neben der allgemeinen Suche nach Nahrung unter anderem auch die Flucht vor Fressfeinden genannt, etwa der Säbelzahnkatze Smilodon oder dem Kurzschnauzenbären Arctotherium, die als extrem große Beutegreifer die damals offenen Landschaften der Pampa bewohnten.[56] Da derartig große unterirdische Wohngänge aber auch von großen Raubtieren ohne größere Probleme aufgesucht werden können, ist der in den Bauen gebotene Schutz vor extremen Temperaturschwankungen oder vor Wasserverlust in trockenen Gebieten ein eher wahrscheinlicher Grund für die eventuell grabenden Tätigkeiten von Glossotherium.[53][57][52]
Die angenommene grabende Lebensweise findet bisher keine Unterstützung durch anatomische Untersuchungen des Innenohrs. Die Orientierung sowie Lage der Bogengänge zueinander bestimmen den Gleichgewichtssinn und somit auch die Rotationsfähigkeit des Kopfes mit einem Optimum bei etwa 90 °. Grabende Tiere haben häufig enger stehende Bogengänge, was bei Glossotherium nicht der Fall ist. Zudem hat die Weite der Bogengänge Einfluss auf die Agilität eines Tieres: Bei Tieren mit engen Bogengängen dominieren langsame und bei weiten Bogengängen schnelle Bewegungen. Letzteres trifft auf Glossotherium zu. Im gesamten Bau des Innenohrs ähnelt die Gattung stark Megatherium und weniger deutlich den heutigen Baumfaultieren. Zudem bestehen stärkere Übereinstimmungen mit den Ameisenbären. Ungeklärt ist aber bisher die Auswirkung der Körpergröße bei nahe verwandten Formen, da in diesem Bezug die riesigen Bodenfaultiere deutlich von den kleinen Baumfaultieren abweichen.[58]
Ernährungsweise
Die charakteristischen Zähne von Glossotherium sind sehr hochkronig. Zusammen mit der eher flachen Kaufläche der Backenzähne spricht dies im Vergleich zu anderen Höheren Säugetieren wie den Huftieren für eine Ernährungsweise basierend auf weitgehend harten Pflanzen wie Gräsern. Da das Gebiss der Faultiere aber anders strukturiert ist als das der Huftiere, ist diese Schlussfolgerung nicht eindeutig.[12][59] Allerdings wird die Ansicht einer eher grasfresserischen Ernährung unter anderem durch die Gestaltung des Maules gestützt, das aufgrund der weiten Unterkiefersymphyse auffallend breit ist. Möglicherweise waren bei Glossotherium zusätzlich breite, wulstige Lippen ausgebildet, worauf verschiedene aufgeraute Flächen am Rostrum hindeuten. Dadurch wirkte das Maul bei Glossotherium wie das eines heutigen Breitmaulnashorns. Dieses ernährt sich hauptsächlich von harter Grasnahrung in offenen Landschaften und kann mit seinem breiten Maul eine große Menge an Gras aufnehmen, wobei es dabei wenig selektiv vorgeht. Für Glossotherium wird ähnliches vermutet, ebenso wie diese spezielle Ernährungsweise für einen größeren Teil der Mylodonten wahrscheinlich war.[60][10] Neben den Lippen hatte wohl auch die Zunge eine unterstützende Funktion bei der Nahrungsaufnahme. Geschlossen wird dies aufgrund der weit im Schädel zurückverlagerten Position des Zungenbeins, das zudem robust gebaut ist und kräftige Muskelansatzstellen besitzt. Dadurch war beispielsweise der Musculus geniohyoideus besonders kräftig und lang ausgebildet, welcher in die Bewegung der Zunge eingebunden ist.[61] Die Schädel-Unterkiefer-Verbindung liegt bei Glossotherium auf der Höhe oder etwas oberhalb der Kauebene, das Unterkiefergelenk ist seitlich ausladend und konvex, während die Glenoidgrube, in die das Gelenk am Schädel einrastet und schwach eingedellt erscheint. Ersteres lässt auf eine wohl geringe Beißkraft schließen, was zusätzlich noch durch die etwas vorverlagerte Molarenreihe angedeutet wird. Die Gestaltung der Gelenkverbindung ermöglichte dagegen weite Rotationsbewegungen beim Kauen. Abnutzungsspuren an den Zähnen deuten darauf hin, dass überwiegend vorwärts und seitlich gerichtete Kaubewegungen vorherrschten. Einen einschränkenden Faktor bei den Kaubewegungen stellt der nicht geschlossene Jochbogen dar. Dieser konnte durch den fehlenden Schluss den entgegenwirkenden Kräften der beiden großen Kaumuskel, Musculus masseter und Musculus pterygoideus (Flügelmuskel), nur bedingt widerstehen, weswegen stärker seitlich orientierte Kaubewegungen wahrscheinlich eine untergeordnete Rolle spielten.[10]
Wie alle Mylodonten besitzt Glossotherium eine vergleichsweise sehr niedrige Gesamtkaufläche aller Zähne zusammen. Diese liegt bei 830 bis 1280 mm², ein ähnlich großes Panzernashorn bringt es dagegen mit 2660 bis 5190 mm² auf eine drei- bis viermal so hohe Gesamtkaufläche. Heutige Faultiere haben eine sehr geringe Stoffwechselrate, was entsprechend auch für die ausgestorbenen Formen vorausgesetzt wird. Sofern auch der Magen wie bei den rezenten Vertretern mehrfach gekammert war, verdaute Glossotherium wohl den Großteil seiner Nahrung im Magen-Darm-Trakt und konnte so die geringe Verarbeitungskapazität der Zähne kompensieren. Aufgrund der so anzunehmenden langen Durchlaufzeit der Nahrung, war es möglich, diese stärker aufzuspalten, wodurch die Tiere eventuell befähigt waren, auch stärker faserige Pflanzenteile zu verwerten.[62] Da die Zähne der Faultiere kein Zahnschmelz enthalten, waren Isotopenmessungen für eine direktere Bestimmung der Nahrung bisher nur eingeschränkt durchführbar. Neuere Forschungsansätze ermöglichen die Gewinnung derartiger Informationen auch aus anderen Skelettteilen. Für Glossotherium gelang dies mit Hilfe eines Osteoderms. Im Ergebnis konnte aufgezeigt werden, dass zumindest die Tiere in der Pampa-Region überwiegend von grashaltiger Nahrung lebten, was die anatomischen Indizien bestätigt.[63]
Weichteile und Sinnesleistungen
Das Weichteilgewebe ist bei ausgestorbenen Organismen sehr selten überliefert, über ein etwaiges Fellkleid bei Glossotherium kann daher meist nur spekuliert werden. Die eher kleinen rezenten, baumbewohnenden Faultiere sind dicht behaart, für das ausgestorbene und mit Glossotherium nahe verwandte Mylodon ist fossilisiertes Haar belegt,[64] ebenso wie für einige entfernter verwandte Formen wie Nothrotheriops aus der Gruppe der Nothrotheriidae.[65] Von Glossotherium stammt ein Teilskelett vom linken Ufer des Arroyo Balta, etwa 3 km vor dessen Einmündung in den Río Luján in der argentinischen Provinz Buenos Aires. An der Oberfläche einzelner Knochen, etwa dem Schädel, haftete eine Matrix an, die fossiliertes Haar in Form von röhrchenartigen Bildungen enthielt. Die Röhrchen lassen noch die beschuppte Außenhaut der Cuticula (Schuppenschicht) und die Haarrinde (Cortex) erkennen, die Schuppen sind wellenartig angeordnet. Im Innern sind sie aber hohl. Dabei kann derzeit nicht geklärt werden, ob dieser Hohlraum verwitterungsbedingt entstand oder die Haare analog denen der heutigen Faultiere und den Befunden bei Mylodon keine Markröhre aufwiesen.[66]

Die heutigen Faultiere haben eher schlecht entwickelte Sinnesleistungen, was unter anderem auch das Gehör betrifft. Die Lautsprache ist dadurch stark eingeschränkt, eine Kommunikation findet häufig nur zwischen Jung- und Muttertier statt, wobei letzteres vor allem bei Frequenzbereichen von 2 bis 8 kHz stimuliert wird.[67] Von Glossotherium sind vereinzelt Gehörknöchelchen überliefert. Der Hammer und der Amboss sind außergewöhnlich groß entwickelt, sie haben kombiniert ein Gewicht von 500 mg, die Fußplatte des Steigbügels besitzt eine Fläche von 7,4 mm². Aufgrund der Ausmaße des tympanischen Rings im Mittelohr von 18,4 mal 14,4 mm kann auf eine Fläche des Trommelfells von 200 mm² geschlossen werden. Die Maße liegen etwas über denen des verwandten, aber deutlich größeren Faultiers Lestodon. Zudem gehören sie zu den größten bekannten von landlebenden Säugetieren, beim Asiatischen Elefanten wiegen alle drei Gehörknöchelchen kombiniert etwa 160 bis 320 mg. Vergleichsuntersuchungen zu heutigen Säugetieren lassen annehmen, dass Glossotherium Töne im niederfrequenten Bereich bis hin zu Infraschall wahrnehmen konnte. Demnach lagen die unteren Bereiche der Schallwahrnehmung bei etwa 0,044 kHz, das Optimum bei 1,7 kHz, was etwa im Bereich der rezenten Faultiere liegt. Die mögliche Obergrenze lag wahrscheinlich bei 15 kHz.[68][69] Vor allem die niederfrequenten Töne bieten in offenen Landschaften zahlreiche Vorteile, da diese weniger anfällig sind für Störungen etwa in Form von Vegetation oder Geländebeschaffenheit. Sie stellen damit ein geeignetes Kommunikationsmittel mit Artgenossen über weite Distanzen dar. Dies ist etwa bei den Elefanten der Fall, deren Rufe nach Sonnenuntergang bis zu 10 km weit getragen werden.[70] Die Lautmodulierung bei den rezenten Faultieren erfolgt durch Luftstöße durch die Nasenöffnungen. Bei Glossotherium waren diese mit 9,6 bis 12,1 cm außerordentlich weit. Damit konnten die Tiere nach dem Lautsprecherprinzip theoretisch Töne im Frequenzbereich von 0,6 kHz erzeugen, die wiederum hervorragend für einen Transport über weite Entfernungen geeignet sind.[68][69]
Beutegreifer und Krankheitsbilder

Einige Knochen von Glossotherium weisen typische Merkmale auf, die auf Fraßspuren von Raubtieren zurückgehen. Diese zeigen teils punktuierte Bisse an den Gelenkenden von Langknochen auf, teilweise wurden auch Knochen aufgebrochen und das innere spongiose Material bearbeitet. Einige der Spuren verweisen auf sehr große Vertreter der Raubtiere hin, die etwa aus der Gruppe der Großkatzen oder Bären stammen könnten. Die bereits erwähnten großen Beutegreifer Smilodon und Arctotherium brachten rekonstruiert jeweils 400 kg und mehr auf die Waage. Zumindest für Smilodon wird ein Beutespektrum im Gewichtsbereich von 1 bis 2 t angegeben,[71] wodurch Glossotherium durchaus als potentielles Opfer der Großkatze in Frage kommt. Unklar ist allerdings, ob die Fraßspuren bei Glossotherium auf erbeutete Tiere zurückgehen oder ob es sich um Aasfresserei handelt. Ähnliche Fälle wurden auch beim verwandten Mylodon dokumentiert.[72]
Eine Untersuchung von mehr als 170 Knochen von Glossotherium erbrachte an wenigstens 7,5 % der Fossilreste pathologische Veränderungen. Diese betrafen vor allem die Gelenkstrukturen an den Langknochen und den Wirbeln. Dabei wurden unter anderem Pseudogicht, Osteoarthritis, Schmorl-Knorpelknötchen und Spondylose identifiziert. Ein Teil der Erkrankungen wie die Pseudogicht entstanden vermutlich altersbedingt, andere wiederum sind auf das große Körpergewicht zurückzuführen.[73]
Systematik
Innere Systematik der Mylodontidae nach Boscaini et al. 2019 (basierend auf skelettanatomischen Analysen)[74]
|
Innere Systematik der Faultiere nach Presslee et al. 2019 (basierend auf Proteinanalysen)[75]
|
Glossotherium ist eine ausgestorbene Gattung aus der ebenfalls erloschenen Familie der Mylodontidae. Die Mylodontidae gehören zur Unterordnung der Faultiere (Folivora), innerhalb derer sie zusammen mit den Orophodontidae und den Scelidotheriidae die Überfamilie der Mylodontoidea formen (teilweise werden die Scelidotheriidae und die Orophodontidae aber auch nur als Unterfamilie innerhalb der Mylodontidae geführt[76]). Nach einer klassischen, auf skelettanatomischen Merkmalen beruhenden Gliederung repräsentieren die Mylodontoidea wiederum neben den Megatherioidea die zweite große und bedeutende Faultierlinie. Molekulargenetische Untersuchungen und Proteinanalysen fügen diesen beiden mit den Megalocnoidea eine dritte Linie hinzu. Gemäß den letzteren beiden Studien beinhalten die Mylodontoidea auch die Zweifinger-Faultiere (Choloepus), eine der zwei heute noch lebenden Faultiergattungen.[77][75] Die Mylodontidae bilden eine der vielfältigsten Gruppen innerhalb der Faultiere. Zu ihren Charakteristika gehören hochkronige Zähne mit abweichend von den Megatherioidea flacher (lobater) Kaufläche, was als eine Anpassung an stärker grashaltige Nahrung interpretiert wird. Die hinteren Zähne besitzen einen runden oder ovalen Querschnitt, die vordersten haben eine eckzahnartige Gestalt. Der Hinterfuß ist zudem deutlich gedreht, so dass die Sohle nach innen zeigt.[78][46] Zu den frühesten Nachweisen der Mylodonten zählt Paroctodontotherium, das in Salla-Luribay in Bolivien nachgewiesen ist und in das Oligozän datiert.[79]
Die innere Gliederung der Mylodontidae ist komplex und variiert je nach Bearbeiter. Zumeist anerkannt sind die späten Gruppen der Mylodontinae mit Mylodon als Typusform und der Lestodontinae, deren Charakterform Lestodon darstellt (auf tribaler Ebene Mylodontini und Lestodontini genannt). In letztere werden teilweise auch Paramylodon und Glossotherium eingeordnet.[80] In der Vergangenheit wurden zahlreiche weitere Unterfamilien aufgestellt, etwa die Nematheriinae für Vertreter aus dem Unteren Miozän oder die Octomylodontinae für alle Basalformen, die aber nicht allgemein anerkannt sind.[81] Eine weitere Gruppe bilden die Urumacotheriinae, die erst im Jahr 2004 etabliert wurden und die spätmiozänen Vertreter des nördlichen Südamerikas beinhalten.[82] Prinzipiell mahnen einige Forscher eine Revision für die gesamte Familie an, da zahlreiche der höheren taxonomischen Einheiten keine formale Diagnose besitzen.[83]
Allerdings konnte die Untergliederung der terminalen Gruppe der Mylodonten in die Unterfamilien der Lestodontinae und Mylodontinae in einer der bisher umfangreichsten Studien zur Stammesgeschichte der Faultiere weitgehend bestätigt werden. Die Studie, die im Jahr 2004 durch Timothy J. Gaudin ihre Veröffentlichung fand, beruhte auf Schädelmerkmalen und legt eine enge Beziehung von Glossotherium mit anderen Lestodontinen nahe. Darüber hinaus ergab die Studie eine Nahverwandtschaft von Paramylodon zu Mylodon, ersteres zeigt aber anatomisch starke Ähnlichkeiten zu Glossotherium, das hier näher an Lestodon herangerückt ist.[84] Zwar konnte diese Verwandtschaftsbeziehung in der Folgezeit mehrfach reproduziert werden,[85][86] doch andere Autoren sahen dies nachfolgend kritischer, wie es beispielsweise eine Untersuchung von Luciano Varela und Forscherkollegen aus dem Jahr 2019 unter Einbeziehung zahlreicher Taxa aus der gesamten Unterordnung der Faultiere darstellt. Demnach formen Glossotherium und Paramylodon eine enge Einheit, Lestodon gruppiert mit einzelnen Formen aus dem nördlichen Südamerika und Mylodon leitet die Entwicklung der modernen Mylodonten ein.[76] Eine höherauflösende phylogenetische Analyse der Mylodonten aus dem gleichen Jahr, bereitgestellt von einem Arbeitsteam um Alberto Boscaini, untermauert die Zweigliederung der terminalen Vertreter. Abweichend von Varela und Kollegen bilden Glossotherium und Paramylodon hier zusammen mit Mylodon eine gemeinsame Klade. Ein fundamentaler Unterschied zwischen den Mylodontinae und Lestodontinae findet sich in der Ausprägung der eckzahnartigen vorderen Zähne, die bei letzteren groß und durch ein langes Diastema von den hinteren Zähnen getrennt sind, bei ersteren aber nur kleine Ausmaße haben oder teilweise reduziert sind und dichter an den molarenartigen Zähnen anstehen. Dieser Untersuchung zufolge gehört Glossotherium in das unmittelbare Beziehungsumfeld um Paramylodon und Mylodon innerhalb der Mylodontinae.[74] Unterstützung fand diese Konstellation durch die bereits erwähnten biochemischen Analysen, ebenfalls publiziert 2019.[75] Eine bereits 2009 publizierte Studie von Robert K. McAfee führte die Nahverwandtschaft von Glossotherium und Paramylodon anhand schädelmorphologischer Aspekte aus und kam zu dem Schluss, dass sich beide Gattungen höchstwahrscheinlich einen gemeinsamen Vorfahren teilen. Einende Merkmale der beiden Gattungen finden sich etwa im Gebissaufbau mit den vorderen caniniformen Zähnen und in der Zahnstruktur, etwa des zweiten Backenzahns. Auch ist die Lage der Knochennaht zwischen Gaumenbein und Oberkiefer nahe dem hintersten Zahn sehr markant. Mylodon dagegen besitzt ein reduziertes Gebiss, einfacher gestaltete Zähne und eine vorverlagerte Knochenverbindung zwischen Gaumenbein und Oberkiefer, es weicht somit markanter von den beiden anderen Gattungen ab.[6]
Im Laufe der Zeit wurden zahlreiche Arten innerhalb der Gattung Glossotherium beschrieben, in der Literatur finden sich folgende Arten häufiger und werden teils als valid geführt:[30][29][23]
- G. lettsomi Gervais & Ameghino, 1880
- G. phoenesis Cartelle, De Iuliis, Boscaini & Pujos, 2019
- G. robustum (Owen, 1842)
- G. tarijensis Ameghino, 1902
- G. tropicorum Hoffstetter, 1952
- G. wegneri Spillmann, 1931
Die bei weitem bedeutendste und bekannteste Art stellt G. robustum dar. Teilweise werden die weiteren, oben genannten Arten auch mit G. robustum synonym geführt, was allerdings nicht sehr einheitlich geschieht.[6][11][87] Morphologische Studien zeigen, dass auffällige Unterschiede vor allem im Zahn- und Schädelbau zwischen einigen eher nördlich verbreiteten Fossilresten zu solchen weiter südlich aufgefundenen bestehen. Demnach könnte die Gattung Glossotherium tatsächlich mehrere Arten umfassen. In diesem Fall beschränken sich die Reste von G. robustum auf den 40. bis 20. südlichen Breitengrad, die weiter nördlich vorkommenden Fossilreste müssten einer oder mehreren anderen Arten zugewiesen werden. Einige jüngere Arbeiten erkennen daher zumindest G. tropicorum und G. wegneri als eigenständig an.[11][30] Vor allem aus der frühen Forschungsperiode stammen zahlreiche Arten, die heute als synonym zu G. robustum anzusehen sind. Hierzu gehört unter anderem das 1865 von Hermann Burmeister eingeführte Mylodon gracilis,[22] weiterhin auch Formen wie Pseudolestodon reinhardtii, Pseudolestodon morenoii und teilweise auch Pseudolestodon myloides, die allesamt im Jahr 1880 von Henri Frédéric Paul Gervais und Florentino Ameghino etabliert wurden,[88] ebenso wie Pseudolestodon hexaspondylus von Max Rautenberg aus dem Jahr 1906.[14][6][15][87] Andere Formen wiederum wurden aus der Gattung Glossotherium ausgeschlossen und anderen Vertretern wie beispielsweise Mylodonopsis zugewiesen.[89]
Innere Systematik von Glossotherium nach De Iuliis et al. 2020[31]
|
Eine phylogenetische Studie aus dem Jahr 2019 unter Berücksichtigung einiger Arten von Glossotherium ließ zunächst annehmen, dass die Gattung keine in sich geschlossene Gruppe bildet und Pleurolestodon mit einschloss. Diese Form war deutlich kleiner und trat bereits im Miozän in Erscheinung. Als Konsequenz müsste entweder Pleurolestodon in Glossotherium eingegliedert oder aber letztere Gattung aufgespalten werden. Da jedoch bis auf G. robustum von den anderen Vertretern zu wenig Material vorliegt, wurde keiner dieser Schritte im weiteren Verlauf vollzogen.[23] Eine im Folgejahr veröffentlichte Studie hingegen basierte auf einem größeren Artenspektrum von Glossotherium und folgerte für die Gattung eine einheitliche Gruppe. Pleurolestodon ist hierin nicht in Glossotherium eingebettet, vielmehr steht es eher basal zu den entwickelten Mylodonten.[31]
Als problematisch gilt die Art „Glossotherium“ chapadmalense, welche im Jahr 1925 von Lucas Kraglievich eingeführt worden war und auf einem Schädel aus der Nähe von Miramar in der argentinischen Provinz Buenos Aires basiert.[25] Der Fund datiert in das Mittlere Pliozän, womit „G.“ chapadmalense der älteste Vertreter von Glossotherium wäre. Die Art ist zudem aus zeitgleichen Schichten in Nordamerika bekannt und wird teilweise auch als Vorläufer des dortigen Paramylodon betrachtet (unter Umständen wird sie dort dann als Paramylodon garbanii bezeichnet). Insgesamt ist die Form etwas kleiner als Glossotherium und zeigt einzelne Abweichungen zum eigentlichen Glossotherium wie eine schmalere Schnauze. Sollte „G.“ chapadmalense tatsächlich den Vorfahr von sowohl Glossotherium als auch Paramylodon repräsentieren, müsste die Art einer neuen Gattung zugewiesen werden. Anbieten würde sich hierbei Eumylodon, eine Bezeichnung, die Kraglievich bereits bei der Aufstellung der Art verwendet, drei Jahre später aber wieder verworfen hatte.[7] Gegenwärtig ist das Fundmaterial dieser frühen Art zu gering und das Originalmaterial zu stark beschädigt, um eine eindeutige Entscheidung zur systematischen Stellung zu treffen.[6]
Forschungsgeschichte
Erstbeschreibung

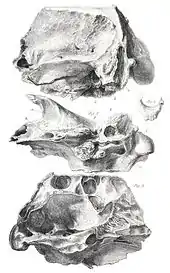
Die taxonomische Geschichte von Glossotherium ist komplex und geprägt von einer lang anhaltenden Gleichsetzung, Vermischung und Verwechslung mit Mylodon und Paramylodon. Die wissenschaftliche Bezeichnung geht auf Richard Owen (1804–1892) zurück, einem der bedeutendsten Forscher des Viktorianischen Zeitalters. Owen untersuchte von 1836 an fossile Funde, die Charles Darwin von seiner wegweisenden Reise mit der HMS Beagle aus Südamerika mitgebracht hatte. Darunter befand sich auch ein hinterer Teil eines Schädels (Exemplarnummer NHM 16586) aus dem Bett des Arroyo Sarandí im heutigen uruguayischen Department Soriano. Owen verwies im Jahr 1840 das Schädelfragment in die von ihm neu geschaffene Gattung Glossotherium, ohne ihr aber eine spezielle Art einzugliedern. Der Name ist griechischen Ursprungs und setzt sich aus den Wörtern γλῶσσα (glossa) für „Zunge“ und θηρίον (thērion) für „Tier“ zusammen. Dabei verleitete Owen eine rundliche Eintiefung von rund 2,5 cm Durchmesser nahe der Ohrregion zur Vergabe des Namens. Die Eintiefung dient als Ansatzpunkt für das Zungenbein, welches wiederum die Zunge unterstützt. Aufgrund der Größe und Ausbildung dieser Ansatzstelle schlussfolgerte Owen auf eine enorm große Zunge, die den Tieren offensichtlich bei der Nahrungsaufnahme behilflich war. Aus diesem Grund sah er auch den Schädel näher zu den Ameisenbären und Schuppentieren stehend und prognostizierte eine insektenfresserische Lebensweise für Glossotherium.[90]
Mylodon, Glossotherium und Grypotherium
In der gleichen Schrift stellte Owen die Gattung Mylodon auf, die er in verwandtschaftlicher Nähe zu den anderen damals bekannten großen Bodenfaultieren wie Megatherium oder Megalonyx sah. Mylodon basiert dabei auf einem mit vier molarenartigen Zähnen ausgestatteten Unterkiefer, den Darwin bei Punta Alta im Süden der argentinischen Provinz Buenos Aires geborgen hatte. Zu Ehren von Darwin benannte Owen die Art als Mylodon darwinii (teilweise wird auch die Schreibweise Mylodon darwini verwendet) und etablierte sie als Typusform der Gattung.[90] Nur zwei Jahre später aber verwarf Owen den Namen Glossotherium wieder. Zu diesem Zeitpunkt veröffentlichte er eine Schrift, in der er einen nahezu vollständigen Schädel mit zugehörigem Körperskelett (Exemplarnummer NHM M2500) beschrieb. Die Funde waren im Jahr zuvor von M. Pedro in den Überschwemmungsebenen des Río de la Plata nördlich von Buenos Aires entdeckt worden. Der Schädel zeichnete sich durch eine breite Schnauze aus, im Gebiss waren insgesamt 18 Zähne ausgebildet, der jeweils vorderste Zahn hatte eine eckzahnartige Gestaltung. Zusammen mit der Beschreibung des Skelettes führte Owen für dieses die neue Art Mylodon robustus ein, das Schädelfragment, das er ursprünglich zu Glossotherium gestellt hatte, brachte er in dem Aufsatz nun mit Mylodon darwinii in Verbindung.[2][91][6]
.jpg.webp)
Im Jahr 1879 erschien die Beschreibung eines Schädels samt Unterkiefers aus Pergamino, ebenfalls in der Provinz Buenos Aires gelegen, die der dänische Zoologe Johannes Theodor Reinhardt (1816–1882) verfasst hatte. Markant war die schmale Schnauze des Schädels, die zudem einen vorn geschlossenen Nasenbogen aufwies, da das Nasenbein mit dem Mittelkieferknochen fest verwachsen war. Zusätzlich bestand das Gebiss aus insgesamt 16 Zähnen, der obere vordere eckzahnähnliche Zahn war reduziert, im Unterkiefer saßen dagegen vier molarenartige Zähne. Reinhardt erkannte dabei, dass der Unterkiefer dem von Mylodon darwinii ähnelte, der Schädel aber mit seiner schmalen Schnauze von dem breitschnauzigen von Mylodon robustus abwich. Weiterhin wies Reinhardt auf Übereinstimmungen des Schädelfragments, das Owen ursprünglich zu Aufstellung der Gattung Glossotherium verwendet und später zu Mylodon darwinii geordnet hatte, mit entsprechenden Schädelabschnitten bei Mylodon robustus hin. Reinhardt propagierte daraufhin die neue Gattung Grypotherium mit Grypotherium darwinii als Typusform.[92] Florentino Ameghino (1854–1911) bestätigte später, im Jahr 1889, die Trennung der beiden Arten auf Gattungsebene. Er sah aber abweichend von Reinhardt den Unterkiefer von Mylodon darwinii und das Schädelfragment von Glossotherium als zusammengehörig an, zudem wies er auf die bei diesem Szenario bestehende Namenspriorität von Glossotherium gegenüber Mylodon und Grypotherium hin und führte so Glossotherium darwinii ein. Die Art Mylodon robustus ließ Ameghino unverändert.[93] Dagegen folgte Arthur Smith Woodward (1864–1944) im Jahr 1900 der Argumentation von Reinhardt. In einem Artikel stellte er Funde von Bodenfaultieren aus dem südlichen Patagonien vor und revidierte dabei die Sammlung von Charles Darwin. Er setzte den Unterkiefer von Mylodon darwinii mit Reinhardts Grypotherium gleich und stellte darauf folgend Grypotherium darwinii wieder her. Das Schädelfragment von Glossotherium verwies er dagegen zu Mylodon robustus.[94][95][91][6]
Ende der 1920er Jahre beschäftigte sich Lucas Kraglievich (1886–1932) mit der Taxonomie der südamerikanischen Bodenfaultiere und speziell mit Mylodon, Glossotherium und Grypotherium. Er arbeitete dabei anhand der Schädelmerkmale heraus, dass die drei Bezeichnungen eindeutig zwei unterschiedlichen Gattungen zuzuweisen sind. Die Beschreibung von Mylodon darwinii durch Owen verband den Gattungsnamen fest mit dem Artepitheton. Kraglievich stellte Mylodon darwinii als Typusart der Gattung heraus und ordnete ihr den vollständigen, schmalschnauzigen Schädel und Unterkiefer von Reinhardts Grypotherium aus Pergamino zu, ebenso den Unterkiefer aus Punta Alta, den Owen in seiner Erstbeschreibung der Art verwendet hatte. Letzterer bildet das Typusexemplar der Art. Owens Mylodon robustus, basierend auf einem Schädel mit breiter Schnauze, verwies er dagegen in die Gattung Glossotherium, die Owen damals aber mit keiner Art verbunden hatte. Gleichzeitig fand Kraglievich die Bezeichnung Glossotherium robustum für die Typusart der Gattung als nicht geeignet, vielmehr vergab er diese Stellung an die neu etablierte Form Glossotherium uruguayensis. Dabei gründete Kraglievich die neue Art auf das Schädelfragment, das Owen einst zur Beschreibung von Glossotherium 1840 genutzt hatte.[7] Kraglievich unterließ es, seinen ungewöhnlichen Schritt mit einer Herausarbeitung unterschiedlicher Merkmale der beiden Arten zu untermauern, was auch durch nachfolgende Autoren nicht geschah. Da das Originalskelett von Mylodon robustus bei der Bombardierung Londons während des Zweiten Weltkriegs zerstört worden war, ist dies im Nachhinein nicht mehr möglich. Generell wird heute Glossotherium robustum als Typusart der Gattung anerkannt, während Glossotherium uruguayensis als Synonym gilt.[6]
Glossotherium und Paramylodon

Neben Mylodon darwinii hatte Owen 1840 mit Mylodon harlani noch einen weiteren Vertreter der Gattung eingeführt. Grundlage für diese Art bildete ein Unterkiefer und ein Schlüsselbein vom Big Bone Lick im Boone County im US-Bundesstaat Kentucky, die Funde hatte bereits Richard Harlan im Jahr 1831 unter der Artzuweisung Megalonyx laqueatus beschrieben.[96] Owen erkannte anhand des Unterkiefers Übereinstimmungen mit seinem Mylodon darwinii und benannte Harlans Form um.[90] Dadurch waren in den 1840er Jahren bereits drei Arten von Mylodon beschrieben, womit der Faultiervertreter eine sehr weite Verbreitung erhielt, die vom südlichen Südamerika bis nach Nordamerika reichte. Ein starker Fundanstieg an Fossilresten im weiteren Verlauf des 19. Jahrhunderts auch in Nordamerika führte im Jahr 1903 zur Aufstellung der Gattung Paramylodon durch Barnum Brown. Paramylodon ähnelte mit seiner breiten Schnauze deutlich Glossotherium (das Brown unter der Bezeichnung Mylodon robustus führte), hatte im Gegensatz zu diesem aber die vorderen oberen eckzahnähnlichen Zähne reduziert.[97] Allerdings vereinte Chester Stock rund 14 Jahre später unter Bezugnahme auf seine Forschungen zu den Mylodonten aus den Asphaltgruben von Rancho La Brea im Süden von Kalifornien Paramylodon wieder mit Mylodon.[98]
Erst 1928 verwies Kraglievich in seinem Aufsatz zur taxonomischen und systematischen Trennung von Glossotherium und Mylodon alle nordamerikanischen Funde Paramylodon zu,[7] eine Meinung, die acht Jahre später auch Ángel Cabrera vertrat. Die starke Ähnlichkeit von Glossotherium und Paramylodon führte in der nachfolgenden Zeit dazu, dass beide Gattungen gleichgesetzt wurden. So wies George Gaylord Simpson im Jahr 1945 in seiner generellen Taxonomie der Säugetiere darauf hin, dass wenn Paramylodon nicht eindeutig von Glossotherium getrennt werden könne, aufgrund eben dieser Namenspriorität die Bezeichnung Glossotherium vorzuziehen sei.[99] Robert Hoffstetter führte im Jahr 1952 Paramylodon dann als Untergattung von Glossotherium, womit letzteres wie zuvor schon Mylodon eine weit über den amerikanischen Doppelkontinent reichende Verbreitung erhielt. Zudem besaß die Gattung dadurch auch eine hohe Variabilität. In dieser Zeit entwickelte sich Glossotherium zu einem „Abfalleimer“-Taxon, in das zahlreiche nahe verwandte mylodonte Formen eingestellt wurden. Die Kongenerität der beiden Gattungen wurde von zahlreichen Forschern im weiteren Verlauf des 20. Jahrhunderts befürwortet.[100] Erst im Jahr 1995 hob H. Gregory McDonald jedoch hervor, dass bisher keine Untersuchungen vorliegen, in der die Synonymität der beiden Gattungen nachgewiesen wurde. Er trennte im Folgenden das nordamerikanische Paramylodon vom südamerikanischen Glossotherium, wobei seiner Meinung nach die Isolierung von Paramylodon in Nordamerika eher die Eigenständigkeit der Form unterstütze.[95] Zu Beginn des 21. Jahrhunderts konnte in mehreren Schädelstudien die eindeutige Trennung der beiden Gattungen untereinander und zuzüglich auch von Mylodon herausgearbeitet werden.[6][8]
Literatur
- Richard A. Fariña, Sergio F. Vizcaíno und Gerardo De Iuliis: Megafauna. Giant beasts of Pleistocene South America. Indiana University Press, 2013, ISBN 978-0-253-00230-3, S. 209–212 und 248–254
- Robert K. McAfee: Reassessment of the cranial characters of Glossotherium and Paramylodon (Mammalia: Xenarthra: Mylodontidae). Zoological Journal of the Linnean Society 155, 2009, S. 885–903
Einzelnachweise
- Darin A. Croft und Velizar Simeonovski: Horned armadillos and rafting monkeys. The fascinating fossil mammals of South Amerika. Indiana University Press, 2016, S. 1–304 (S. 228–229)
- Richard Owen: Description of the skeleton of an extinct gigantic Sloth, Mylodon robustus, Owen, with observations on the osteology, natural affinities, and probable habitats of the Megatherioid quadrupeds in general. London, 1842, S. 1–176 (speziell S. 154) ()
- Richard A. Fariña, Sergio F. Vizcaíno und María S. Bargo: Body mass estimations in Lujanian (Late Pleistocene-Early Holocene of South America) mammal megafauna. Mastozoología Neotropical 5 (2), 1998, S. 87–108
- M. Susana Bargo, Sergio F. Vizcaíno, Fernando M. Archuby und R. Ernesto Blanco: Limb bone proportions, strength and digging in some Lujanian (Late Pleistocene-Early Holocene) mylodontid ground sloths (Mammalia, Xenarthra). Journal of Vertebrate Paleontology 20 (3), 2000, S. 601–610
- Per Christiansen und Richard A. Fariña: Mass estimation of two fossil ground sloths (Mammalia, Xenarthra, Mylodontidae). Senckenbergiana biologica 83 (1), 2003, S. 95–101
- Robert K. McAfee: Reassessment of the cranial characters of Glossotherium and Paramylodon (Mammalia: Xenarthra: Mylodontidae). Zoological Journal of the Linnean Society 155, 2009, S. 885–903
- Lucas Kraglievich: “Mylodon darwini” Owen es la especie genotipo de “Mylodon” Ow. Rectificacíon de la nomenclatura genérica de los Milodontes. Physis 9, 1928, S. 169–185
- Diego Brandoni, Brenda S. Ferrero und Ernesto Brunetto: Mylodon darwini Owen (Xenarthra, Mylodontinae) from the Late Pleistocene of Mesopotamia, Argentina, with Remarks on Individual Variability, Paleobiology, Paleobiogeography, and Paleoenvironment. Journal of Vertebrate Paleontology 30 (5), 2010, S. 1547–1558
- Luciano Brambilla und Damián A. Ibarra: The occipital region of late Pleistocene Mylodontidae of Argentina. Boletín del Instituto de Fisiografía y Geología 88, 2018, S. 1–9
- M. Susana Bargo und Sergio F. Vizcaíno: Paleobiology of Pleistocene ground sloths (Xenarthra, Tardigrada): biomechanics, morphogeometry and ecomorphology applied to the masticatory apparatus. Ameghiniana 45 (1), 2008, S. 175–196
- Vanessa Gregis Pitana, Graciela Irene Esteban, Ana Maria Ribeiro und Cástor Cartelle: Cranial and dental studies of Glossotherium robustum (Owen, 1842) (Xenarthra: Pilosa: Mylodontidae) from the Pleistocene of southern Brazil. Alcheringa: An Australasian Journal of Palaeontology 37 (2), 2013, doi:10.1080/03115518.2012.717463
- M. Susana Bargo, Gerardo De Iuliis und Sergio F. Vizcaíno: Hypsodonty in Pleistocene ground sloths. Acta Palaeontologica Polonica 51 (1), 2006, S. 53–61
- Daniela C. Kalthoff: Microstructure of Dental Hard Tissues in Fossil and Recent Xenarthrans (Mammalia: Folivora and Cingulata). Journal of Morphology 272, 2011, S. 641–661
- Max Rautenberg: Über Pseudolestodon hexaspondylus. Stuttgart, 1906, S. 1–50
- Vanessa Gregis Pitana: Estudo do gênero Glossotherium Owen, 1840 (Xenarthra, Tardigrada, Mylodontidae), Pleistoceno do Estado do Rio Grande do Sul, Brasil. Universidade Federal do Rio Grande do Sul, Porto Alegre, 2011, S. 1–183
- Robert K. McAfee: Description of New Postcranial Elements of Mylodon darwinii Owen 1839 (Mammalia: Pilosa: Mylodontinae), and Functional Morphology of the Forelimb. Ameghiniana 53 (4), 2016, S. 418–443
- Cástor Cartelle: Estudo comparativo do rádio e esqueleto da mao de Glossotherium (Ocnotherium) giganteum Lund, 1842. Anais da Academia Brasileira de Ciências 52 (2), 1980, S. 359–376
- Chester Stock: Structure of the pes in Mylodon harlani. University of California Publications. Bulletin of the Department of Geology 10 (16), 1917, S. 267–286
- Chester Stock: Cenozoic gravigrade edentates of western North America with special reference to the Pleistocene Megalonychinae and Mylodontidae of Rancho La Brea. Carnegie. Institute of Washington 331, 1925, S. 1–206
- José A. Haro, Adan A. Tauber und Jerónimo M. Krapovickas: The Manus of Mylodon darwinii Owen (Tardigrada, Mylodontidae) and Ist Phylogenetic Implications. Journal of Vertebrate Paleontology 36 (5), 2016, S. e1188824, doi:10.1080/02724634.2016.1188824
- F. P. Moreno und A. Smith Woodward: On a Portion of Mammalian Skin, named Neomylodon listai, from a Cave near Consuelo Cove, Last Hope Inlet, Patagonia. By Dr. F. P. Moreno, C.M.Z.S. With a Description of the Specimen by A. Smith Woodward, F.Z.S. Proceedings of the Zoological Society1899, S. 144–156.
- Hermann Burmeister: Hautpanzer bei Mylodon. Archiv für Anatomie, Physiologie und wissenschaftliche Medicin 1865, S. 334–336
- Cástor Cartelle, Gerardo De Iuliis, Alberto Boscaini und François Pujos: Anatomy, possible sexual dimorphism, and phylogenetic affinities of a new mylodontine sloth from the late Pleistocene of intertropical Brazil. Journal of Systematic Palaeontology 17 (23), 2019, S. 1957–1988, doi:10.1080/14772019.2019.1574406
- Robert V. Hill: Comparative Anatomy and Histology of Xenarthran Osteoderms. Journal of Morphology 267, 2005, S. 1441–1460
- Lucas Kraglievich: Cuatro nuevos gravigrados de la fauna Araucana „Chapadmalense“. Anales del Museo Nacional de Historia Natural de Buenos Aires33, 1925, S. 215–235
- Federico Anaya und Bruce J. MacFadden: Pliocene mammals from Inchasi, Bolivia: The endemic fauna just before the Great American Interchange. Bulletin of the Florida Museum of Natural History 39 (3), 1995, S. 87–140
- François Pujos und Rodolfo Salas: A systematic reassessment and paleogeographic review of fossil Xenarthra from Peru. Bulletin de l'Institut Français d'Etudes Andines, 33, 2004, S. 331–378
- Luciano Varela und Richard A. Fariña: Co-occurrence of mylodontid sloths and insights on their potential distributions during the late Pleistocene. Quaternary Research 85, 2016, S. 66–74
- Hans P. Püschel, Thomas A. Püschel und David Rubilar-Rogers: Taxonomic comments of a Glossotherium specimen from the Pleistocene of Central Chile. Boletín del Museo Nacional de Historia Natural, Chile 66 (2), 2017, S. 223–262
- Gerardo De Iuliis, Cástor Cartelle, H. Gregory McDonald und François Pujos: The mylodontine ground sloth Glossotherium tropicorum from the late Pleistocene of Ecuador and Peru. Papers in Palaeontology 3 (4), 2017, S. 613–636
- Gerardo De Iuliis, Alberto Boscaini, François Pujos, Robert K. McAfee, Cástor Cartelle, Leonard J. S. Tsuji und Lorenzo Rook: On the status of the giant mylodontine sloth Glossotherium wegneri (Spillmann, 1931) (Xenarthra, Folivora) from the late Pleistocene of Ecuador. Comptes Rendus Palevol 19 (12), 2020, S. 215–232, doi:10.5852/cr-palevol2020v19a12
- Timothy J. Gaudin und Joseph Broome: Isolated petrosal of the extinct sloth Glossotherium tropicorum (Xenarthra, Folivora, Mylodontidae) from the island of Trinidad. Bulletin of the Florida Museum of Natural History 58 (3), 2021, S. 51–64 ()
- Richard A. Fariña, P. Sebastián Tambusso, Luciano Varela, Ada Czerwonogora, Mariana Di Giacomo, Marcos Musso, Roberto Bracco und Andrés Gascue: Arroyo del Vizcaíno, Uruguay: a fossil-rich 30-ka-old megafaunal locality with cut-marked bones. Proceedings of the Royal Society B 281, 2014, S. 20132211, doi:10.1098/rspb.2013.2211
- Jamil Corrêa Pereira, Renato Pereira Lopes und Leonardo Kerber: New remains of Late Pleistocene mammals from the Chuí Creek, Southern Brazil. Revista Brasileira de Paleontologia 15 (2), 2012, S. 228–239
- Marína A. Gutiérrez und Gustavo A. Martínez: Trends in the faunal human exploitation during the Late Pleistocene and Early Holocene in the Pampean region (Argentina). Quaternary International 191, 2008, S. 53–68
- Gustavo G. Politis, Clara Scabuzzo und Robert H. Tykot: An Approach to Pre-Hispanic Diets in the Pampas during the Early/ Middle Holocene. International Journal of Osteoarchaeology 19, 2009, S. 266–280
- Gustavo Martínez, María Gutiérrez und José Luis Prado: New Archaeological Evidences from the Late-Pleistocene/Early-Holocene Paso Otero 5 Site (Pampean Region, Argentina). Current Research in the Pleistocene 21, 2004, S. 16–18
- Gustavo Martínez: Arqueolgía del curso medio del Río Quequén Grande: Estado actual y aportes a la arqueología de la región Pampeana. Relaciones de la Sociedad Argentina de Antropología 31, 2006, S. 249–275
- Gustavo Martínez, María A. Gutiérrez und Eduardo P. Tonni: Paleoenvironments and faunal extinctions: Analysis of the archaeological assemblages at the Paso Otero locality (Argentina) during the Late Pleistocene-Early Holocene. Quaternary International 299, 2013, S. 53–63
- Agueda Vilhena Vialou, Thierry Aubry, Mohammed Benabdelhadi, Cástor Cartelle, Levy Figuti, Michel Fontugne, Maria Eugenia Solari und Denis Vialou: Découverte de Mylodontinae dans un habitat préhistorique daté du Mato Grosso (Brésil): l'abri rupestre de Santa Elina. Comptes Rendus de l'Academie Sciences Paris 320, 1995, S. 655–661
- Alex Hubbe, Mark Hubbe und Walter A. Neves: The Brazilian megamastofauna of the Pleistocene/Holocene transition and its relationship with the early human settlement of the continent. Earth Science Review 118, 2013, S. 1–10
- Alan J. Bryan, Rodolfo M. Casamiquela, José M. Cruxent, Ruth Gruhn und Claudio Ochsenius: An El Jobo Mastodon Kill at Taima-Taima, Venezuela. Science 200, 1978, S. 1275–1277
- Ruth Gruhn und Alan J. Bryan: The record of Pleistocene megafaunal extinction at Taima-taima, Northern Venezuela. In: Paul S. Martin und Richard G. Klein (Hrsg.): Quaternary Extinctions. A Prehistoric Revolution. The University of Arizona Press, Tucson AZ, 1984, S. 128–137
- H. Gregory McDonald: Sexual dimorphism in the skull of Harlan's ground sloth. Contribution in Science 510, 2006, S. 1–9
- Gerardo De Iuliis, Guillermo H. Ré und Sergio F. Vizcaíno: The Toro Negro megatheriine (Mammalia, Xenarthra): A new species of Pyramiodontherium and a review of Plesiomegatherium. Journal of Vertebrate Paleontology 24 (1), 2004, S. 214–227
- H. Gregory McDonald: Evolution of the Pedolateral Foot in Ground Sloths: Patterns of Change in the Astragalus. Journal of Mammalian Evolution 19, 2012, S. 209–215
- Cristina Bayón, Teresa Manera, Gustavo Politis und Silvia Aramayo: Following the Tracks of the First South Americans. Evolution: Education and Outreach 4, 2011, S. 205–217, doi:10.1007/s12052-011-0335-4
- Silvia A. Aramayo, Teresa Manera de Bianco, Nerea V. Bastianelli und Ricardo N. Melchor: Pehuen Co: Updated taxonomic review of a late Pleistocene ichnological site in Argentina. Palaeogeography, Palaeoclimatology, Palaeoecology 439, 2015, S. 144–165, doi:10.1016/j.palaeo.2015.07.006
- Santiago Pantiño und Richard A. Fariña: Ungual phalanges analysis in Pleistocene ground sloths (Xenarthra, Folivora). Historical Biology 29 (8), 2017, S. 1065–1075, doi:10.1080/08912963.2017.1286653
- Santiago Pantiño, Jorge Peréz Zerpa und Richard A. Fariña: Finite element and morphological analysis in extant mammal's claws and Quaternary sloth' ungual phalanges. Historical Biology, 2019, doi:10.1080/08912963.2019.1664504
- Francisco Segikurch de Carvalho Buchmann, Heinrich Theodor Frank, Victor Moreira Sandim Ferreira und Erick Antal Cruz: Evidência de vida gregária em paleotocas attribuítas a Mylodontidae (Preguiças-gigantes). Revista Brasileira de Paleontologia 19 (2), 2016, S. 259–270
- Renato Pereira Lopez, Heinrich Theodor Frank, Francisco Sekiguchi de Carvalho Buchmann und Felipe Caron: Megaichnus igen. nov.: Giant paleoburrows attributed to extinct Cenozoic mammals from South America. Ichnos 24 (2), 2017, S. 133–145, doi:10.1080/10420940.2016.1223654
- Sergio F. Vizcaíno, Marcelo Zaráte, M. Susana Bargo und Alejandro Dondas: Pleistocene burrows in the Mar del Plata area (Argentina) and their probable builders. Acta Palaeontologica Polonica 46 (2), 2001, S. 289–301
- Alejandro Dondas, Federico I. Isla und José L. Carballido: Paleocaves exhumed from the Miramar Formation (Ensenadan Stage-age, Pleistocene), Mar del Plata, Argentina. Quaternary International 210, 2009, S. 44–50
- P. Sebastián Tambusso, Luciano Varela und H. Gregory McDonald: Fusion of anterior thoracic vertebrae in Pleistocene ground sloths. Historical Biology 32 (2), 2020, S. 244–251, doi:10.1080/08912963.2018.1487419
- Hervé Bocherens, Martin Cotte, Ricardo Bonini, Daniel Scian, Pablo Straccia, Leopoldo Soibelzon und Francisco J. Prevosti: Paleobiology of sabretooth catSmilodon populatorin the Pampean Region (Buenos Aires Province, Argentina) around the Last Glacial Maximum: Insights from carbon and nitrogen stable isotopes in bone collagen. Palaeogeography, Palaeoclimatology, Palaeoecology 449, 2016, S. 463–474
- Richard A. Fariña, Sergio F. Vizcaíno und Gerardo De Iuliis: Megafauna. Giant beasts of Pleistocene South America. Indiana University Press, 2013, ISBN 978-0-253-00230-3, S. 209–212 und 248–254
- Alberto Boscaini, Dawid A. Iurino, Guillaume Billet, Lionel Hautier, Raffaele Sardella, German Tirao, Timothy J. Gaudin und François Pujos: Phylogenetic and functional implications of the ear region anatomy of Glossotherium robustum (Xenarthra, Mylodontidae) from the Late Pleistocene of Argentina. The Science of Nature 105, 2018, S. 28, doi:10.1007/s00114-018-1548-y
- Sergio F. Vizcaíno: The teeth of the “toothless”: novelties and key innovations in the evolution of xenarthrans (Mammalia, Xenarthra). Paleobiology 35 (3), 2009, S. 343–366
- M. Susana Bargo, Néstor Toledo und Sergio F. Vizcaíno: Muzzle of South American Pleistocene Ground Sloths (Xenarthra, Tardigrada). Journal of Morphology 267, 2006, S. 248–263
- Leandro M. Pérez, Néstor Toledo, Gerardo De Iuliis, M. Susana Bargo und Sergio F. Vizcaíno: Morphology and Function of the Hyoid Apparatus of Fossil Xenarthrans (Mammalia). Journal of Morphology 271, 2010, S. 1119–1133
- Sergio F. Vizcaíno, M. Susana Bargo und Guillermo H. Cassini: Dental occlusal surface area in relation to body mass, food habits and other biological features in fossil xenarthrans. Ameghiniana 43 (1), 2006, S. 11–26
- Ada Czerwonogora, Richard A. Fariña und Eduardo Pedro Tonni: Diet and isotopes of Late Pleistocene ground sloths: first results for Lestodon and Glossotherium (Xenarthra, Tardigrada). Neues Jahrbuch für Geologie und Paläontologie, Abhandlunge 262, 2011, S. 257–266
- W. O. Ridewood: On the Structure of the Hairs of Mylodon Listai and other South American Edentata. Quaternary Review of Microscopic Science 44, 1901, S. 393–411
- Richard Swann Lull: A remarkable ground sloth. Memoirs of the Peabody Museum of Yale University 3, 1929, S. 344–352
- Héctor Arzani, Sonia L. Lanzelotti, Gabriel E. Acuña Suárez und Nelson M. Novo: Primer Registro de Pelos Fósiles en Glossotherium robustum (Xenarthra, Mylodontidae), Pleistoceno Tardío, Mercedes, Provincia de Buenos Aires, Argentina. Ameghiniana 51 (6), 2014, S. 585–590
- G. G. Montgomery und M. E. Sunquist: Contact-Distress Calls of Young Sloths. Journal of Mammalogy 55 (1), 1974, S. 211–213
- R. Ernesto Blanco und Andrés Rinderknecht: Estimation of Hearing Capabilities of Pleistocene Ground Sloths (Mammalia, Xenarthra) from Middle-Ear Anatomy. Journal of Vertebrate Paleontology 28 (1), 2008, S. 274–276
- R. Ernesto Blanco und Andrés Rinderknecht: Fossil evidence of frequency range of hearing independent of body size in South American Pleistocene ground sloths (Mammalia, Xenarthra). Comptes Rendus Palevol 11, 2012, S. 549–554
- Michael Garstang, David Larom, Richard Raspet und Malan Lindeque: Atmospheric controls on elephant communication. Journal of Experimental Biology 198, 1995, S. 939–951
- Aldo Manzuetti, Daniel Perea, Washington Jones, Martín Ubilla und Andrés Rinderknecht: An extremely large saber-tooth cat skull from Uruguay (late Pleistocene–early Holocene, Dolores Formation): body size and paleobiological implications. Alcheringa: An Australasian Journal of Palaeontology 44 (2), 2020, S. 332–339, doi:10.1080/03115518.2019.1701080
- Karina Vanesa Chichkoyan, Borja Figueirido, Margarita Belinchón, José Luis Lanata, Anne-Marie Moigne und Bienvenido Martínez-Navarro: Direct evidence of megamammal-carnivore interaction decoded from bone marks in historical fossil collections from the Pampean region. PeerJ 5, 2017, S. e3117, doi:10.7717/peerj.3117
- Fernando H. de S. Barbosa, Kleberson de O. Porpino, Hermínio I. de Araújo Júnior, Lilian P. Bergqvist und Bruce M. Rothschild: Articular and vertebral lesions in the Pleistocene sloths (Xenarthra, Folivora) from the Brazilian Intertropical Region. Historical Biology: An International Journal of Paleobiology 31 (5), 2019, S. 544–558
- Alberto Boscaini, François Pujos und Timothy J. Gaudin: A reappraisal of the phylogeny of Mylodontidae (Mammalia, Xenarthra) and the divergence of mylodontine and lestodontine sloths. Zoologica Scripta 48 (6), 2019, S. 691–710, doi:10.1111/zsc.12376
- Samantha Presslee, Graham J. Slater, François Pujos, Analía M. Forasiepi, Roman Fischer, Kelly Molloy, Meaghan Mackie, Jesper V. Olsen, Alejandro Kramarz, Matías Taglioretti, Fernando Scaglia, Maximiliano Lezcano, José Luis Lanata, John Southon, Robert Feranec, Jonathan Bloch, Adam Hajduk, Fabiana M. Martin, Rodolfo Salas Gismondi, Marcelo Reguero, Christian de Muizon, Alex Greenwood, Brian T. Chait, Kirsty Penkman, Matthew Collins und Ross D. E. MacPhee: Palaeoproteomics resolves sloth relationships. Nature Ecology & Evolution 3, 2019, S. 1121–1130, doi:10.1038/s41559-019-0909-z
- Luciano Varela, P. Sebastián Tambusso, H. Gregory McDonald und Richard A. Fariña: Phylogeny, Macroevolutionary Trends and Historical Biogeography of Sloths: Insights From a Bayesian Morphological Clock Analysis. Systematic Biology 68 (2), 2019, S. 204–218
- Frédéric Delsuc, Melanie Kuch, Gillian C. Gibb, Emil Karpinski, Dirk Hackenberger, Paul Szpak, Jorge G. Martínez, Jim I. Mead, H. Gregory McDonald, Ross D.E. MacPhee, Guillaume Billet, Lionel Hautier und Hendrik N. Poinar: Ancient mitogenomes reveal the evolutionary history and biogeography of sloths. Current Biology 29 (12), 2019, S. 2031–2042, doi:10.1016/j.cub.2019.05.043
- H. Gregory McDonald und Gerardo de Iuliis: Fossil history of sloths. In: Sergio F. Vizcaíno und W. J. Loughry (Hrsg.): The Biology of the Xenarthra. University Press of Florida, 2008, S. 39–55
- Bruce J. Shockey und Federico Anaya: Grazing in a New Late Oligocene Mylodontid Sloth and a Mylodontid Radiation as a Component of the Eocene-Oligocene Faunal Turnover and the Early Spread of Grasslands/Savannas in South America. Journal of Mammalian Evolution 18, 2011, S. 101–115
- Malcolm C. McKenna und Susan K. Bell: Classification of mammals above the species level. Columbia University Press, New York, 1997, S. 1–631 (S. 94–96)
- Andrés Rinderknecht, Enrique Bostelmann T., Daniel Perea und Gustavo Lecuona: A New Genus and Species of Mylodontidae (Mammalia: Xenarthra) from the Late Miocene of Southern Uruguay, with Comments on the Systematics of the Mylodontinae. Journal of Vertebrate Paleontology 30 (3), 2010, S. 899–910
- Francisco Ricardo Negri und Jorge Ferigolo: Urumacotheriinae, nova subfamília de Mylodontidae (Mammalia, Tardigrada) do Mioceno Superior-Plioceno, América do Sul. Revista Brasileira de Paleontologia 7 (2), 2004, S. 281–288
- Ascanio D. Rincón, H. Gregory McDonald, Andrés Solórzano, Mónica Núñez Flores und Damián Ruiz-Ramoni: A new enigmatic Late Miocene mylodontoid sloth from northern South America. Royal Society Open Science 2, 2015, S. 140256, doi:10.1098/rsos.140256
- Timothy J. Gaudrin: Phylogenetic relationships among sloths (Mammalia, Xenarthra, Tardigrada): the craniodental evidence. Zoological Journal of the Linnean Society 140, 2004, S. 255–305
- Ascanio D. Rincón, Andrés Solórzano, H. Gregory McDonald und Mónica Núñez Flores: Baraguatherium takumara, Gen. et Sp. Nov., the Earliest Mylodontoid Sloth (Early Miocene) from Northern South America. Journal of Mammalian Evolution 24 (2), 2017, S. 179–191
- Luciano Brambilla und Damián Alberto Ibarra: Archaeomylodon sampedrinensis, gen. et sp. nov., a new mylodontine from the middle Pleistocene of Pampean Region, Argentina. Journal of Vertebrate Paleontology 38 (6), 2018, S. e1542308, doi:10.1080/02724634.2018.1542308
- Rafael Labarca Encina: La meso y megafauna terrestre extinta del Pleistoceno de Chile. Publicación Ocasional del Museo Nacional de Historia Natural, Chile 63, 2015, S. 401–465
- Henri Gervais und Florentino Ameghino: Les mammifères fossiles de l´Ámérique du Sud. Paris-Buenos Aires, 1880, S. 1–225 (S. 160–161) ()
- Castor Cartelle: Um novo Mylodontinae (Edentata, Xenarthra) do Pleistoceno Final da Região Intertropical Brasileira. Anais da Academia Brasileira de Ciências 63 (2), 1991, S. 161–170
- Richard Owen: Fossil Mammalia. In Charles Darwin (Hrsg.): Zoology of the Voyage of H.M.S Beagle, under the command of Captain Fitzroy, during the years 1832 to 1836. Part I. Fossil Mammals London, 1840, S. 12–111 (S. 57–73) ()
- Juan Carlos Fernicola, Sergio F. Vizcaíno und Gerardo De Iuliis: The fossil mammals collected by Charles Darwin in South America during his travels on board the HMS Beagle. Revista de la Asociación Geológica Argentina 64 (1), 2009, S. 147–159
- Johannes Theodor Reinhardt: Beskrivelse af Hovedskallen af et Kæmpedovendyr, Grypotherium darwini. Det Kongelige Danske Videnskabernes Selskabs Skrifter. 5 Række. Naturvidenskabelig og Mathematisk Afdeling 12 (5), 1879, S. 351–381 ()
- Florentino Ameghino: Contribución al conocimiento de los mamíferos fósiles de la República Argentina. Actas de la Academia Nacional de Ciencias 6, 1889, S. 1–1027 (S. 734–744) ()
- Arthur Smith-Woodward: On some remains of Grypotherium (Neomylodon) listai and associated mammals from a cavern near Consuelo Cave, Last Hope Inlet, Patagonia. Proceedings of the Zoological Society 5, 1900, S. 64–79 ()
- H. Gregory McDonald: Gravigrade xenarthrans from the early Pleistocene Leisey Shell Pit 1A, Hillsborough County, Florida. Bulletin of the Florida Museum of Natural History 37, 1995, S. 345–373 ()
- Richard Harlan: Description of the jaws, teeth, and clavicle of the Megalonyx laqueatus. The Monthly American journal of geology and natural science 1, 1831, S. 74–76 ()
- Barnum Brown: A new genus of ground sloth from the Pleistocene of Nebraska. Bulletin of the American Museum of Natural History 29, 1903, S. 569–583
- Chester Stock: Further observation on the skull structure of the mylodont sloths from Rancho La Brea. University of California Publications, Bulletin of the Department ofGeology 10, 1917, S. 165–178
- George Gaylord Simpson: The Principles of Classification and a Classification of Mammals. Bulletin of the American Museum of Natural History 85, 1945, S. 1–350 (S. 71)
- Jesse S. Robertson: Latest Pliocene mammals from Haile XVA, Alachua County, Florida. Bulletin of the Florida Museum of Natural History. 20, 1976, S. 111–186 ()