Kragenfaultier
Das Kragenfaultier (Bradypus torquatus) ist eine Art aus der Familie der Dreifinger-Faultiere (Bradypodidae). Sie stellt den größten Vertreter der Gattung Bradypus dar. Typische Merkmale sind eine einheitlich braune Fellfärbung und eine dunkle Mähne am Nacken. Das hauptsächliche Verbreitungsgebiet des Kragenfaultiers sind die Atlantischen Küstenwälder im östlichen Brasilien. Dort lebt es weitgehend baumbewohnend und einzelgängerisch und ernährt sich zum Großteil von Blättern, selten von Früchten und Blüten. Die Lebensweise ist im Weiteren jedoch nur wenig erforscht. Der Bestand des Kragenfaultiers ist durch Waldzerstörung gefährdet, die Art gehört zu den am stärksten bedrohten Säugetieren Südamerikas.
| Kragenfaultier | ||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|

Kragenfaultier (Bradypus torquatus) | ||||||||||||
| Systematik | ||||||||||||
| ||||||||||||
| Wissenschaftlicher Name | ||||||||||||
| Bradypus torquatus | ||||||||||||
| Illiger, 1811 |
Merkmale
Habitus
Das Kragenfaultier ist die größte Art der Dreifinger-Faultiere. Erwachsene Tiere werden zwischen 59 und 75 cm lang, der kurze Schwanz erreicht 4,0 bis 5,4 cm Länge. Die Weibchen sind dabei etwas größer und weisen ein Gewicht von 5,1 bis 10,1 kg auf, bei Männchen liegt dies bei 4,6 bis 9 kg.[1] Dabei variiert die Körpergröße auch innerhalb verschiedener Populationen: Die Individuen aus niedrigen Höhen (0 bis 350 m) sind signifikant schwerer und größer als diejenigen aus den höheren Lagen (600 bis 1000 m).[2] Am kleinen rundlichen Kopf sind keine äußeren Ohren erkennbar, da diese im Fell verborgen bleiben. Das Fell besitzt eine dichte Unterwolle, darüber befinden sich längere und deutlich gröbere Haare, die dem Kragenfaultier seine uniforme, hellbraune bis braune Färbung geben. Nur im Schulterbereich treten lange, schwarze Haare auf, die eine Art Mähne formen, welche bei Männchen meist stärker ausgeprägt ist. Bei Weibchen bilden sich manchmal nur zwei unregelmäßige Büschel aus, bei Jungtieren fehlt die Mähne gänzlich. Abweichend von den anderen Dreifinger-Faultieren ist bei den Männchen des Kragenfaultiers kein Rückenfleck vorhanden. Die einzelnen Haare sind teilweise quer gebrochen, wobei sich in diesen Brüchen symbiotisch lebende Algen einnisten, so dass das Fell hauptsächlich in der Regenzeit je nach Lichteinfall grünlich schimmert. Diese Symbiose dient teilweise der Tarnung vor Fressfeinden. Der Scheitel des Fells liegt wie bei allen Faultieren auf dem Bauch, so dass das Regenwasser besser abfließen kann. Die Arme sind deutlich länger als die Beine. Arme und Beine enden jeweils in dreistrahligen Händen und Füßen, die mit langen, hakenförmigen Krallen ausgestattet sind, wobei die jeweils mittlere Kralle vergrößert ist. Die Hinterfußlänge beträgt etwa 11 cm.[3][2][4][5]
Schädel- und Gebissmerkmale
Der Schädel ist zwischen 7,3 und 8,4 cm lang und am Jochbein bis zu 4,1, hinter den Augen aber nur 2,4 cm breit. Dort tritt zudem am Ansatz des Jochbogens ein länglich-schmaler, nach unten gerichteter Fortsatz auf, weiterhin ist der Bogen typischerweise nicht geschlossen. Das Gebiss weist im Oberkiefer je Hälfte 5, im Unterkiefer je 4 Zähne auf, insgesamt also 18, von denen die hinteren molarenartig gestaltet sind. Eck- und Schneidezähne kommen nicht vor. Die Länge der oberen Zahnreihe liegt bei 2,3 cm.[3]
Verbreitung
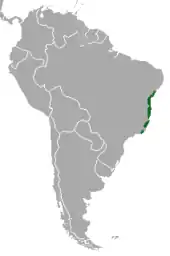
Das Kragenfaultier bewohnt einen schmalen Küstenstreifen im östlichen Brasilien, allerdings ist das Verbreitungsgebiet zersplittert. Der Schwerpunkt liegt vom südlichen Teil des Bundesstaates Bahia bis zum Bundesstaat Espírito Santo. Zwischen 2004 und 2009 konnten erstmals wieder mehrere Nachweise der Art im nördlich an Bahia angrenzenden Bundesstaat Sergipe erbracht werden, die allerdings in stark fragmentierten Waldresten erfolgten.[6] Ursprünglich reichte die Verbreitung noch weiter bis nach Pernambuco, doch kommt das Kragenfaultier dort heute nicht mehr vor. Eine natürliche biogeographische Lücke von fast 100 km Ausdehnung besteht zwischen dem Rio Mucuri und dem Rio Doce im nördlichen Espírito Santo, was möglicherweise mit dem höheren Anteil laubabwerfender Bäume in dieser Region zusammenhängt.[7] Wieder angesiedelt wurde das Kragenfaultier unter anderem im Bundesstaat Rio de Janeiro. Das Verbreitungsgebiet überschneidet sich mit den östlichen Habitaten des Braunkehl-Faultiers (Bradypus variegatus).[8][9][5]
Der bevorzugte Lebensraum umfasst die Atlantischen Küstenregenwälder (Mata Atlântica), wo das Kragenfaultier vom Meeresniveau bis in Höhenlagen um 1290 m auftritt, überwiegend jedoch die tieferen Regionen bis 200 m bewohnt. Dort lebt es in tropischen Regenwäldern, aber auch in Sekundärwäldern und in sogenannten cabrucas, Kakaoplantagen in naturbelassenen Wäldern, mit einem Jahresniederschlag von 1200 mm und mehr. Auch in Waldfragmenten von nur 20 ha Größe wurden einzelne Tiere gesichtet, so im Bundesstaat Sergipe, doch ist deren langfristige Überlebenschance dort eher gering. Gelegentlich nutzen sie auch halb laubabwerfende Wälder. Das Kragenfaultier ist somit an dichte Wälder gebunden. In fragmentierten Landschaften mit rund 35 % Waldbedeckung geht die Anzahl der Tiere stark zurück, bei weniger als 20 % Waldbedeckung tritt die Art nicht mehr auf.[10] Das gesamte Verbreitungsgebiet wird mit 90.000 km² angegeben, Schätzungen für das tatsächlich bewohnte Gebiet belaufen sich auf etwa 1000 km².[8][9] Die Populationsdichte beträgt etwa 0,09 bis 1,25 Individuen je Hektar.[3][5]
Lebensweise
Territorialverhalten
Das Kragenfaultier ist ein Einzelgänger, der überwiegend baumbewohnend (arboreal) in den Atlantischen Küstenwäldern lebt. Die einzigen engeren sozialen Kontakte bestehen zwischen Muttertier und dem Nachwuchs. Die Individuen leben in Aktionsräumen von 0,6 bis 10,8 ha, bei einer Durchschnittsgröße von 5,4 bis 5,6 ha. Untersuchungen an drei Individuen über einen Zeitraum von 14 Monaten ergaben, dass die Aktivitätszeiten sich zusammensetzen aus 60 bis 80 % Ruhe, 7 bis 17 % Fressen, 6 bis 17 % Bewegung und 1 bis 2 % sonstigem wie Fellpflege. Die verwendete Zeit für die Nahrungsaufnahme erhöht sich in der Trockenzeit um fast das Doppelte gegenüber der Regenzeit. Auf den Waldboden steigt das Kragenfaultier nur herab, um zu einem anderen Baum zu gelangen, innerhalb von 24 Stunden legt ein Tier dabei etwa 24 m zurück.[11] Die Zeit der Aktivität der einzelnen Populationen scheint unterschiedlich zu sein. So sind Gruppen im Flachland eher dämmerungs- und nachtaktiv, solche im Hochland dagegen eher tagaktiv. Grund dafür dürften die bestehenden Temperaturunterschiede zwischen Hoch- und Flachlandregionen sein.[3][4][12][5]
Ernährung
Das Kragenfaultier ist ein reiner Pflanzenfresser und ernährt sich zu etwa 99 % von Blättern, daneben frisst es auch vereinzelt Früchte und Blüten. In den bereits erwähnten Untersuchungen dreier Individuen über einen Zeitraum von mehr als einem Jahr konnten 21 bevorzugte Pflanzenarten beobachtet werden, darunter 16 Baum- und 5 Lianenarten. Einzelindividuen fraßen dabei aber nur von 7 bis 12 Arten, wobei Jungblätter vor allem während der Regenzeit überwogen. Zu den wichtigsten Nahrungspflanzen gehören Vertreter von Prunus, Ficus, Micropholis und Mandevilla, die jeweils zwischen 12,2 und 19,5 % der gesamten Nahrungsmenge ausmachen. Von letzterem werden auch die Blüten und zusätzlich von Cecropia die Früchte verzehrt. Weiterhin lässt sich ein sehr selektives Nahrungsverhalten der Einzeltiere nachweisen, da diese an nur wenigen Baumarten fressen, die weniger als 4 % des Gesamtbestandes aller Bäume eines Habitats umfassen und zudem nicht die weitverbreitetsten darstellen.[13] Da einzelne Individuen des Kragenfaultiers nur bestimmte Pflanzenarten nutzen, sind sie sehr spezialisierte Blattfresser, die gesamte Population einer Region vertilgt aber Blätter von wesentlich mehr Baumarten und ist dadurch weniger selektiv.[3][4][12][5]
Fortpflanzung
Über die Fortpflanzung des Kragenfaultiers ist wenig bekannt, sie wurde nur selten in freier Wildbahn beobachtet. Das Kragenfaultier wird mit rund drei Jahren geschlechtsreif. Die Paarungszeit ist höchstwahrscheinlich ganzjährig, jedoch fallen die meisten Geburten jahreszeitlich bedingt in die Zeit vom Ende der Regen- bis hin über die erste Hälfte der Trockenzeit und damit in eine eher stressarme Phase, da die Temperaturen dann höher sind und die bevorzugten Nahrungsquellen häufiger. Dadurch wird aufgrund der für andere Dreifinger-Faultiere bekannten Tragzeit von sechs Monaten wahrscheinlich, dass die meisten Paarungen zu Beginn der Trockenzeit stattfinden. Das Weibchen bringt stets ein Junges zur Welt. Die Länge des Neugeborenen liegt bei 20 cm, das Geburtsgewicht beträgt 300 bis 350 g.[1] Die ersten Lebensmonate verbringt das Jungtier auf dem Bauch oder dem Rücken der Mutter. Das Jungtier frisst bereits mit zwei Wochen erstmals Blätter. Die Entwöhnung erfolgt erst nach zwei Monaten und kann bis zu vier andauern. Insgesamt bleibt das Jungtier acht bis elf Monate bei der Mutter. Die Lebenserwartung des Kragenfaultiers in freier Wildbahn ist unbekannt, das älteste untersuchte Tier war etwa 12 Jahre alt und immer noch fortpflanzungsfähig.[2][4][3][5]
Parasiten und Kommensalen
Nahezu alle Kragenfaultiere sind von Zecken der Gattung Amblyomma, oft von der Art Amblyomma varium befallen. Von und in ihrem Fell leben zahlreiche Mottenformen der Unterfamilie Chrysauginae, die häufigste Gattung ist dabei Cryptoses. Untersuchungen am nahe verwandten Braunkehl-Faultier (Bradypus variegatus) ergaben eine symbiotische Beziehung zwischen den Motten, den Algen im Fell und dem Dung der Faultierart. Die Faultiere profitieren dabei von den Motten, die Stickstoffverbindungen in das Fell und somit auch an die Algen abgeben. Diese werden wiederum von den Faultieren bei der Fellpflege gefressen, wodurch sie neben ihrer eher energiearmen Pflanzenkost wichtige Ergänzungsstoffe erhalten.[14] Von der Motte wird weiterhin angenommen, dass ihr das Kragenfaultier zu einem gewissen Grad Schutz vor Beutegreifern bietet. Darüber hinaus parasitiert Trichilium, eine Käfergattung, überwiegend im Oberschenkelbereich.[3][4]
Systematik
|
Das Kragenfaultier ist eine Art innerhalb der Gattung der Dreifinger-Faultiere (Bradypus), welcher drei weitere Arten zuzuweisen sind. Die Dreifinger-Faultiere gehören zur heute monotypischen Familie der Bradypodidae, die innerhalb der Unterordnung der Faultiere (Folivora) entweder nach skelettanatomischen Merkmalen allen anderen Faultiergruppen als Schwestergruppe gegenübersteht[16][17][18] oder gemäß molekulargenetischen Untersuchungen und Proteinanalysen der Überfamilie der Megatherioidea zugewiesen wird.[19][20] Die nächste verwandte Gruppe innerhalb der rezenten Faultiere bilden die Zweifinger-Faultiere (Choloepus) aus der Familie der Choloepodidae. Mit den Faultieren wiederum formen die Ameisenbären (Vermilingua) einen engeren Verwandtschaftskreis, beide Gruppen gemeinsam stellen die Ordnung der Zahnarmen (Pilosa). Die Faultiere spalteten sich von der gemeinsamen Linie mit den Ameisenbären laut molekulargenetischen Untersuchungen im ausgehenden Paläozän vor etwa 58 Millionen Jahren ab, die beiden heute noch lebenden Gattungen Bradypus und Choloepus trennten sich dagegen im Oligozän vor rund 30 Millionen Jahren.[15][21]
Innere Systematik der Gattung Bradypus nach Gibb et al. 2015[21]
|
Die Aufsplitterung der Gattung Bradypus begann bereits sehr früh im Unteren Miozän vor 19 Millionen Jahren, als sich das Kragenfaultier von der gemeinsamen Linie des Braunkehl- (Bradypus variegatus) und des Weißkehl-Faultiers (Bradypus tridactylus) sowie des Zwergfaultiers (Bradypus pygmaeus) abspaltete; die drei letzteren trennten sich im weiteren Verlauf des Miozäns und im Übergang zum Pliozän vor etwa 12 bis 5,7 Millionen Jahren.[22][21][23] Teilweise wird das Kragenfaultier in die eigene Untergattung Scaeopus gestellt, was in den auffallenden morphologischen Unterschieden zu den anderen Dreifinger-Faultieren seine Begründung findet. Die Untergattung ist monotypisch und enthält somit nur eine Art.[24] Die abweichende Morphologie verbunden mit der sehr frühen Abspaltung des Kragenfaultiers befürwortet nach Ansicht einzelner Autoren die generische Selbständigkeit von Scaeopus.[25]
Auch die Art selbst wird als monotypisch angesehen. Allerdings bestehen zwischen den nördlicheren Populationen in Bahia und den südlichen in Espírito Santo und Rio de Janeiro markante genetische Unterschiede. Diese wurden höchstwahrscheinlich durch die natürliche biogeographische Lücke zwischen dem Rio Mucuri und dem Rio Doce im Norden Espírito Santos hervorgerufen, die keinen Genfluss zulässt. Molekulargenetische Befunde geben eine Trennung beider Populationen im Unteren Pleistozän vor 2,5 bis 1,8 Millionen Jahren an. Bisher ist unklar, ob beide Gruppen eigenständige Unterarten repräsentieren, die aber äußerlich dann nicht zu unterscheiden sind.[26] Fossilfunde des Kragenfaultiers sind nicht bekannt.[3]
Die Erstbeschreibung des Kragenfaultiers erfolgte im Jahr 1811 durch Johann Karl Wilhelm Illiger, allerdings ohne Angabe einer Typuslokalität. Die Autorenschaft Illigers wurde in der Vergangenheit teilweise angezweifelt, da er in der Erstbeschreibung zusätzlich den wissenschaftlichen Namen Choloepus torquatus verwendete, demnach wäre Anselme Gaëtan Desmarest mit einer Erwähnung des Kragenfaultiers aus dem Jahr 1816 der Erstbeschreiber. Allerdings verweisen heute zahlreiche Wissenschaftler auf Illiger.[24] Der Artname torquatus ist lateinischen Ursprungs und bedeutet so viel wie „gebändert“.[3]
Gefährdung
Da das Kragenfaultier in hohem Maße an seinen Lebensraum angepasst ist, reagiert es äußerst empfindlich auf Störungen. Vor allem die Zerstörung der Atlantischen Küstenregenwälder hat seit den 1980er Jahren dramatisch zugenommen. Die Flächen dienen nun als Ackerland, Bergbaugebiet oder der Ausdehnung der menschlichen Siedlungen. Die Wälder erstrecken sich heute nur noch über etwa 7 % ihres ursprünglichen Verbreitungsgebietes.[26] Weiterhin wurden vor allem in südlichen Bahia aufgrund ökonomischer Zwänge zahlreiche Kakaoplantagen in Weideland umgewandelt. Obwohl in Brasilien gesetzlich verboten, werden einzelne Tiere auch als Nahrungsressource getötet, untergeordnet fallen Kragenfaultiere gelegentlich Verkehrsunfällen zum Opfer. In der Roten Liste der IUCN wird die Art als „gefährdet“ (vulnerable) geführt. Das Kragenfaultier gilt als eines der am stärksten vom Aussterben bedrohten Säugetiere Südamerikas.[4] Zu den Schutzmaßnahmen der IUCN gehört ein Programm zur Schaffung geeigneter Korridore, das die geringe genetische Diversität der einzelnen, teils voneinander getrennt lebenden Populationen zu erhöhen ermöglichen soll. Zudem sollen eingefangene oder konfiszierte Tiere einer genetischen Untersuchung unterzogen werden, um geeignete Aussiedlungsgebiete zu finden. Eine Umsiedlung von mehreren Individuen war im Jahr 1994 erfolgreich.[27] Es wird auch darauf hingewiesen, dass für die nördlichen und südlichen Populationen getrennte Schutzmaßnahmen erfolgen sollten, um eine genetische Vermischung dieser beiden, seit langer Zeit getrennten Gruppen zu verhindern.[26] Das Kragenfaultier ist in mehreren Schutzgebieten präsent, so unter anderem im Nationalpark Poco das Antas im Bundesstaat Rio de Janeiro und im Nationalpark Augusto Ruschi im Bundesstaat Espírito Santo.[8][9]
Literatur
- D. P. Gilmore, C. P. Da Costa, D. P. F. Duarte: Sloth biology: an update on their physiological ecology, behavior and role as vectors of arthropods and arboviruses. In: Brazilian Journal of Medical and Biological Research. 34 (1), 2001, S. 9–25.
- Virginia Hayssen: Bradypus torquatus (Pilosa: Bradypodidae). In: Mammalian Species. 829, 2009, S. 1–5.
- Markus Lambertz: Notes on the original description of the maned three-toed sloth, Bradypus torquatus (Mammalia, Pilosa, Bradypodidae), by Johann Karl Wilhelm Illiger in 1811. In: Bionomina. 6, 2013, S. 49–51.
- Jonathan N. Pauli: Bradypodidae (Three-toed sloths). In: Don E. Wilson, Russell A. Mittermeier (Hrsg.): Handbook of the Mammals of the World. Volume 8: Insectivores, Sloths and Colugos. Lynx Edicions, Barcelona 2018, S. 118–132 (S. 131–132) ISBN 978-84-16728-08-4.
Einzelnachweise
- Bernardo B. Dias, Luis Alberto Dias dos Santos, Paula Lara-Ruiz, Camila Righetto Cassano, Laurenz Pinder, Adriano G. Chiarello: First observation on mating and reproductive seasonality in maned sloths Bradypus torquatus (Pilosa: Bradypodidae). In: Journal of Ethology. 27, S. 97–103, doi:10.1007/s10164-008-0089-9.
- Paula Lara-Ruiz, Adriano Garcia Chiarello: Life-history traits and sexual dimorphism of the Atlantic forest maned sloth Bradypus torquatus (Xenarthra: Bradypodidae). In: Journal of Zoology. 267, 2005, S. 63–73.
- Virginia Hayssen: Bradypus torquatus (Pilosa: Bradypodidae). In: Mammalian Species. 829, 2009, S. 1–5.
- D. P. Gilmore, C. P. Da Costa, D. P. F. Duarte: Sloth biology: an update on their physiological ecology, behavior and role as vectors of arthropods and arboviruses. In: Brazilian Journal of Medical and Biological Research. 34 (1), 2001, S. 9–25.
- Jonathan N. Pauli: Bradypodidae (Three-toed sloths). In: Don E. Wilson, Russell A. Mittermeier (Hrsg.): Handbook of the Mammals of the World. Volume 8: Insectivores, Sloths and Colugos. Lynx Edicions, Barcelona 2018, S. 118–132 (S. 130–131) ISBN 978-84-16728-08-4.
- Renata Rocha Déda Chagas, João Pedro Souza-Alves, Leandro Jerusalinsky, Stephen F. Ferrari: New Records of Bradypus torquatus (Pilosa: Bradypodidae) from Southern Sergipe, Brazil. In: Edentata. 8-10, 2009, S. 21–23.
- André Hirsch, Adriano Garcia Chiarello: The endangered maned sloth (Bradypus torquatus) of the Brazilian Atlantic forest: a review and update of geographical distribution and habitat preference. In: Mammal Review. 42 (1), 2012, S. 35–54.
- Adriano Garcia Chiarello, Nadia Moraes-Barros: Bradypus torquatus. In: Edentata. 11, 2010, S. 119–120.
- Adriano Garcia Chiarello, Nadia Moraes-Barros: Bradypus torquatus. In: IUCN 2013. IUCN Red List of Threatened Species. Version 2013.2. (iucnredlist.org); zuletzt abgerufen am 9. Januar 2014.
- Paloma Marques Santos, Larissa Lynn Bailey, Milton Cezar Ribeiro, Adriano Garcia Chiarello, Adriano Pereira Paglia: Living on the edge: Forest cover threshold effect on endangered maned sloth occurrence in Atlantic Forest. In: Biological Conservation. 240, 2019, S. 108264, doi:10.1016/j.biocon.2019.108264.
- Adriano G. Chiarello: Activity budgets and ranging patterns of the Atlantic forest maned sloth Bradypus torquatus (Xenarthra: Bradypodidae). In: Journal of Zoology. (London). 246, 1998, S. 1–10.
- Adriano Garcia Chiarello: Sloth ecology. An overview of field studies. In: Sergio F. Vizcaíno, W. J. Loughry (Hrsg.): The Biology of the Xenarthra. University Press of Florida, 2008, S. 269–280.
- Adriano G. Chiarello: Diet of the Atlantic forest maned sloth Bradypus torquatus (Xenarthra: Bradypodidae). In: Journal of Zoology. (London). 246, 1998, S. 11–19.
- Jonathan N. Pauli, Jorge E. Mendoza, Shawn A. Steffan, Cayelan C. Carey, Paul J. Weimer und M. Zachariah Peery: A syndrome of mutualism reinforces the lifestyle of a sloth. In: Proceedings of the Royal Society. B 281, 2014, S. 20133006, doi:10.1098/rspb.2013.3006.
- Frédéric Delsuc, Sergio F Vizcaíno, Emmanuel J. P. Douzery: Influence of Tertiary paleoenvironmental changes on the diversification of South American mammals: a relaxed molecular clock study within xenarthrans. In: BMC Evolutionary Biology. 4 (11), 2004, S. 1–13.
- Robert P. Anderson, Charles O. Handley, Jr: A new species of three-toed sloth (Mammalia: Xenarthra) from Panamá, with a review of the genus Bradypus. In: Proceedings of the Biological Society of Washington. 114, 2001, S. 1–33.
- Timothy J. Gaudin: Phylogenetic relationships among sloths (Mammalia, Xenarthra, Tardigrada): the craniodental evidence. In: Zoological Journal of the Linnean Society. 140, 2004, S. 255–305.
- Luciano Varela, P. Sebastián Tambusso, H. Gregory McDonald, Richard A. Fariña: Phylogeny, Macroevolutionary Trends and Historical Biogeography of Sloths: Insights From a Bayesian Morphological Clock Analysis. In: Systematic Biology. 68 (2), 2019, S. 204–218.
- Frédéric Delsuc, Melanie Kuch, Gillian C. Gibb, Emil Karpinski, Dirk Hackenberger, Paul Szpak, Jorge G. Martínez, Jim I. Mead, H. Gregory McDonald, Ross D.E. MacPhee, Guillaume Billet, Lionel Hautier, Hendrik N. Poinar: Ancient mitogenomes reveal the evolutionary history and biogeography of sloths. In: Current Biology. 29 (12), 2019, S. 2031–2042, doi:10.1016/j.cub.2019.05.043.
- Samantha Presslee, Graham J. Slater, François Pujos, Analía M. Forasiepi, Roman Fischer, Kelly Molloy, Meaghan Mackie, Jesper V. Olsen, Alejandro Kramarz, Matías Taglioretti, Fernando Scaglia, Maximiliano Lezcano, José Luis Lanata, John Southon, Robert Feranec, Jonathan Bloch, Adam Hajduk, Fabiana M. Martin, Rodolfo Salas Gismondi, Marcelo Reguero, Christian de Muizon, Alex Greenwood, Brian T. Chait, Kirsty Penkman, Matthew Collins, Ross D. E. MacPhee: Palaeoproteomics resolves sloth relationships. In: Nature Ecology & Evolution. 3, 2019, S. 1121–1130, doi:10.1038/s41559-019-0909-z.
- Gillian C. Gibb, Fabien L. Condamine, Melanie Kuch, Jacob Enk, Nadia Moraes-Barros, Mariella Superina, Hendrik N. Poinar, Frédéric Delsuc: Shotgun Mitogenomics Provides a Reference Phylogenetic Framework and Timescale for Living Xenarthrans. In: Molecular Biology and Evolution. 33 (3), 2015, S. 621–642.
- Nadia de Moraes-Barros, Juliana A. B. Silva, João Stenghel Morgante: Morphology, molecular phylogeny, and taxonomic inconsistencies in the study of Bradypus sloths (Pilosa: Bradypodidae). In: Journal of Mammalogy. 92 (1), 2011, S. 86–100.
- Manuel Ruiz-García, Diego Chacón, Tinka Plese, Ingrid Schuler, Joseph Mark Shostell: Mitogenomics phylogenetic relationships of the current sloth’s genera and species (Bradypodidae and Megalonychidae). In: Mitochondrial DNA Part A. 29 (2), 2018, S. 281–299, doi:10.1080/24701394.2016.1275602.
- Alfred L. Gardner: Mammals of South America, Volume 1: Marsupials, Xenarthrans, Shrews, and Bats. University of Chicago Press, 2008, ISBN 978-0-226-28240-4, S. 158–164.
- Manuel Ruiz-García, Diego Chacón, Tinka Plese, Joseph Mark Shostell: Molecular phylogenetics of Bradypus (Three-toed sloth, Pilosa: Bradypodidae, Mammalia) and phylogeography of Bradypus variegatus (Brown-throated three-toed sloth) with mitochondrial gene sequences. In: Journal of Mammalian Evolution., 2019, doi:10.1007/s10914-019-09465-w.
- Paula Lara-Ruiz, Adriano G. Chiarello, Fabrício R. Santos: Extreme population divergence and conservation implications for the rare endangered Atlantic Forest sloth, Bradypus torquatus (Pilosa: Bradypodidae). In: Biological Conservation. 141, 2008, S. 1332–1342.
- Adriano G. Chiarello, David J. Chivers, Clarisse Bassi, Maria Amélia F. Maciel, Leandro S. Moreira, Mariel Bazzalo: A translocation experiment for the conservation of maned sloths, Bradypus torquatus (Xenarthra, Bradypodidae). In: Biological Conservation. 118, 2004, S. 421–430.
Weblinks
- Bradypus torquatus in der Roten Liste gefährdeter Arten der IUCN 2010. Eingestellt von: A. Chiarello, P. Lara-Ruiz & Members of the IUCN SSC Edentate Specialist Group, 2008. Abgerufen am 9. Januar 2014.
- B. Bullinger, S. Frost: Bradypus torquatus. In: Animal Diversity Web. 2009. (englisch)