Osteoderm
Als Osteoderme (von altgriechisch ὀστέον ostéon ‚Knochen‘ und δέρμα dérma ‚Haut‘),[1] Osteodermata oder Hautknochenplatten werden bei Landwirbeltieren innerhalb der Lederhaut (Dermis) liegende und dort gebildete Knochen bezeichnet. Diese sind meist plattig, seltener kalottenförmig oder stachelförmig zugespitzt. Osteoderme sind Teil des sogenannten Dermalskeletts, dem auch alle weiteren Knochen, an deren Bildung die Haut Anteil hat, zugerechnet werden, so unter anderem das Schädeldach und die Schlüsselbeine. Benachbart liegende Osteoderme können in Abhängigkeit von ihrer Funktion durch Gelenke und Bänder miteinander verbunden sein (wie bei Krokodilen und ihren frühen Verwandten) oder entlang ihrer Kanten miteinander verzahnt oder verwachsen sein (wie bei Gürteltieren). Auf diese Art und Weise können Osteoderme zusammenhängende Knochenpanzer bilden.

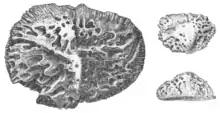

Osteoderme kommen bei heutigen Kriechtieren, Amphibien sowie bei den Gürteltieren als einziger Säugetiergruppe vor. Sie sind in vielen miteinander nicht nah verwandten ausgestorbenen Gruppen nachgewiesen und waren bereits bei manchen frühen Landwirbeltieren des Karbon (vor ca. 360 bis 300 Millionen Jahren) vorhanden. Entgegen den Gemeinsamkeiten im Aufbau ihrer Knochengewebe weist das verstreute Auftreten der Osteoderme darauf hin, dass sie im Verlauf der Stammesgeschichte vielfach unabhängig voneinander durch konvergente Evolution entstanden sind und sich allenfalls eine bestimmte Veranlagung zur Bildung von Osteodermen auf einen gemeinsamen Vorfahren zurückführen lässt.
Lage und Ausmaß der Körperbedeckung mit Osteodermen stehen mit ihrer Funktion in Zusammenhang: Neben der Panzerung können Osteoderme Teil einer aktiven Abwehreinrichtung, zum Beispiel einer Schwanzkeule, sein, der Zurschaustellung dienen, einen Calcium-Vorrat für Zeiten erhöhten Calciumbedarfs bilden oder für die Regulierung des Wärmehaushalts von Bedeutung sein. Bei Tieren, die im Wasser leben, können Osteoderme zur Erhöhung der Körperdichte beitragen. Reihen von Rückenosteodermen verhindern in vielen Fällen zu extreme Rumpfbewegungen und können auf diese Weise schädigende Belastungen, die bei der Fortbewegung an Land auftreten, von der Wirbelsäule fernhalten.
Die wissenschaftliche Untersuchung der Osteoderme, unter anderem ihres Erscheinungsbildes (im Rahmen der Morphologie), ihrer Gewebestruktur (im Rahmen der Skelett-Histologie) und ihrer Entwicklungsvorgänge (im Rahmen der Entwicklungsbiologie), um daraus Schlussfolgerungen zur Funktion, Lebensweise und Stammesgeschichte ausgestorbener Tiere zu ziehen, ist gegenwärtig ein aktives Forschungsfeld der Paläobiologie.
Abgrenzung von anderen Skelettbestandteilen der Wirbeltiere
Osteoderme sind knöcherne Bestandteile der Haut von Landwirbeltieren, die, zusammen mit Knochen des Schädels und Schultergürtels, an deren Bildung die Haut beteiligt ist, das sogenannte Dermalskelett bilden. Sie unterscheiden sich von den Skelettelementen in der Haut mancher Fische durch das Fehlen von Zahnbein (Dentin), welches sich von Knochengewebe in seiner Zusammensetzung, Mikrostruktur und Art der Bildung unterscheidet.[2][3]
Oftmals werden verknöcherte Hautschuppen, die sowohl bei landwirbeltierähnlichen Fischen (der Gruppe der Fleischflosser) als auch bei vielen urtümlichen Landwirbeltieren der Gruppe Temnospondyli auftreten,[4] als ein weiterer von Osteodermen zu unterscheidender Typ der Hautverknöcherung aufgefasst. Die Abgrenzung beruht darauf, dass verknöcherte Hautschuppen im Unterschied zu Osteodermen wiederkehrende, auch für unverknöcherte Hautschuppen typische Überlappungsmuster zeigen, keine Ornamentierung der Außenseite aufweisen und weiter außen in der Lederhaut nahe der Grenze zur Oberhaut (Epidermis) gebildet werden.[2][5] So gibt es unter den urtümlichen Landwirbeltieren manche, bei denen sowohl verknöcherte Schuppen als auch Osteoderme auftreten – manchmal übereinander liegend.[6]
Manche Autoren hingegen verweisen auf die Verschiedenheit der Osteoderme hinsichtlich ihrer Lage, Form, Oberflächenstruktur, Kompaktheit, Gewebestruktur und Ontogenese und fassen verknöcherte Hautschuppen als Teil des Spektrums an Landwirbeltier-Hautverknöcherungen auf, für welche sie zusammenfassend den Begriff „Osteoderm“ verwenden. Hautverknöcherungen der Fische – auch solche ohne jeden Dentin-Anteil – und die Hautschuppen der Blindwühlen, die einen Dentin-Anteil aufweisen, definieren jedoch auch diese Autoren als nicht zu den Osteodermen gehörig.[7][3] Im Folgenden wird der Begriff Osteoderm im engeren Sinne, das heißt ohne Einbezug verknöcherter Landwirbeltier-Hautschuppen, verwendet.
Skeletogenese und Knochenmikrostruktur
Die Bildung des Skeletts im Verlauf der Entwicklung eines Individuums vom Embryo zum erwachsenen Tier bezeichnet man auch als Skeletogenese. Osteoderme und andere Dermalknochen unterscheiden sich in ihrer Skeletogenese von vielen Knochen des Wirbeltier-Innenskeletts dahingehend, dass sie nicht als sogenannter Ersatzknochen aus einem Knochenvorläufer, der aus Knorpel besteht, hervorgehen.[2][8] Die einzige Ausnahme stellten Osteoderme der ausgestorbenen Meeresreptiliengruppe Placodontia dar, die Anteile von Knorpel aufwiesen.[9] Die meisten Osteoderme sind entweder Produkt einer (intra-)membranösen Verknöcherung oder einer Umwandlung von Hautgewebe in Knochen, die man auch als metaplastische Verknöcherung bezeichnet, oder einer Kombination von beidem.[3]
Intramembranöse und metaplastische Verknöcherung
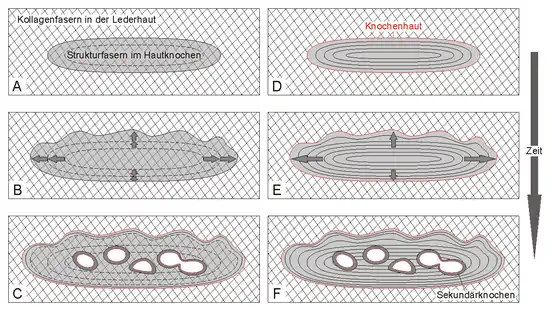
Bei der intramembranösen Verknöcherung bildet sich innerhalb der Dermis eine Verdichtung von Bindegewebszellen, die Osteoid abscheiden. Das Osteoid-Gewebe wird von knochenbildenden Zellen (Osteoblasten) und einer Knochenhaut (Periosteum) umlagert. Diese wandeln das Osteoid in echtes Knochengewebe um und lagern ähnlich wie beim Wachstum des Innenskeletts kontinuierlich von innen nach außen neues Knochengewebe an.[8] Meist besteht das Knochengewebe derart gebildeter Osteoderme aus parallelfaserigem Knochen oder Lamellenknochen. In diesen Knochengewebetypen sind die Kollagen-Fasern, an denen sich das Mineral Hydroxylapatit in Form feiner Kriställchen (Kristallite) abscheidet, parallel zur Knochenoberfläche ausgerichtet.[2] Unterschiede im Wachstum bewirken Unterschiede in der Dichte, Zellstruktur und Faserausrichtung aufeinanderfolgender Lagen, die unter dem Lichtmikroskop als Zonierung sichtbar sind.
Osteodermgewebe, das aus der Umwandlung (Metaplasie) von dichtem Hautgewebe hervorgegangen ist, fehlt diese Lagigkeit. Die metaplastische Verknöcherung führt zur Apatit-Mineralisierung von Bereichen der Lederhaut, ohne dass eine Knochenhaut vorliegt.[10] Die oftmals in regelmäßiger Verflechtung angeordneten Bindegewebsfasern der Haut bleiben nach der Umwandlung als mineralisierte Strukturfasern im metaplastischen Knochen bestehen. Nach außen kann dieses Gewebe von Knochen, der durch eine Knochenhaut gebildet wurde, umlagert sein.[11]
Knochenumbau und Sharpey-Fasern
Oftmals findet im Verlauf der Entwicklung des Osteodermträgers ein innerer Umbau der Osteoderme vergleichbar dem Umbau anderer Knochen statt. Dabei wird zuerst gebildeter Knochen (Primärknochen) durch Knochenfresszellen (Osteoklasten) aufgelöst und es entsteht eine schwammartige Mittelschicht, die der Spongiosa anderer Knochen gleicht und auch als Diploë bezeichnet wird. Hohlräume können wiederum mit neu gebildetem Knochen (Sekundärknochen) ausgekleidet sein. Die kompakteren Rindengewebe des Osteoderms, die die Mittelschicht umschließen, beinhalten oftmals senkrecht oder schräg zur Oberfläche einwachsende Fasern des angrenzenden Hautgewebes sowie von Muskeln oder Bändern, die als Sharpey-Fasern bezeichnet werden.[2]
Timing der Osteoderm-Bildung im Verlauf der Individualentwicklung
Das Einsetzen der Osteoderm-Skeletogenese im Verlauf der Individualentwicklung ist bei vielen Osteodermträgern gegenüber der Bildung des übrigen Skeletts verzögert: Bei manchen osteodermtragenden Arten der Froschlurche weist das Fehlen von Osteodermen noch kurz nach der Metamorphose auf die späte Ausbildung dieser Hautverknöcherungen hin.[7][3]
Beim Mississippi-Alligator setzt die Osteoderme-Bildung deutlich später als die des übrigen Skeletts (einschließlich der Dermalknochen des Schädels, dessen Verknöcherung besonders früh beginnt) nach dem Schlüpfen der Jungtiere ein. Dabei nimmt die Verknöcherung des Panzers seinen Anfang bei den Osteodermen im Bereich der Halswirbel und setzt sich von dort aus nach und nach seitlich und schwanzwärts fort.[12]
Eine späte Bildung der Osteoderme im Verlauf der Individualentwicklung ist ebenfalls bei den Schuppenechsen zu beobachten: Die perlenförmigen Osteoderme der Krustenechsen gehören zu den Skelettelementen dieser Gruppe, deren Verknöcherung am spätesten erfolgt. Bei den Blindschleichen weisen sogar halbwüchsige (subadulte) Individuen noch keine Anzeichen für Hautverknöcherungen auf (wie sie bei ausgewachsenen Tieren vorliegen).[13][3]
Beim Neunbinden-Gürteltier beginnt die Skeletogenese der Osteoderme zwar später als die des restlichen Skeletts, jedoch bereits vor der Geburt im Verlauf der Embryogenese. Die Bildung der Osteoderme läuft asynchron ab, das heißt zeitlich versetzt von Panzersegment zu Panzersegment sowie innerhalb jedes Panzersegments. Meist beginnt die Verknöcherung der einzelnen Segmente am mittleren vorderen Ende und setzt sich (auf ähnliche Weise wie beim Alligator-Rückenschild) seitlich und schwanzwärts fort.[14]
Für ausgestorbene Gruppen osteodermtragender Tiere liegen nur manchmal Individuen unterschiedlicher Lebensalter und Entwicklungsstadien vor, so dass sich die Frage nach dem Timing der Osteoderm-Entwicklung nur selten so wie für die Stegosaurier-Osteoderme, deren Bildung und Wachstum wie bei heutigen Osteodermträgern deutlich verzögert ist,[15] beantworten lässt.
Vorkommen, Ursprung und Evolution
Osteoderme liegen bei Vertretern der heutigen Froschlurche, Schildkröten, Echsen, Krokodile und Gürteltiere und somit in drei der vier konventionellen Klassen der Landwirbeltiere vor. Hinzu kommen zahlreiche Belege in vorzeitlich ausgestorbenen und nur durch Fossilien belegten Gruppen. Im folgenden Verzweigungsdiagramm sind die Verwandtschaftsverhältnisse der Landwirbeltiere vereinfacht dargestellt und, mit Ausnahme der wenig bekannten Reptiliengruppe Hupehsuchia,[16] alle Gruppen, für die Osteoderme belegt sind, aufgeführt (Schema vereinfacht in Anlehnung an Ruta u. a. 2003[17] und Hill 2005[18]):
Da die einzelnen hier aufgeführten Osteodermträger-Gruppen oft übergeordneten Gruppen angehören, deren letzter gemeinsamer Vorfahr keine Hautverknöcherung aufwies, so bei den Nebengelenktieren, welche wie alle anderen heutigen Säugetiergruppen von einem Säugetier ohne Osteoderme abstammen, müssen Osteoderme im Verlauf der Stammesgeschichte der Landwirbeltiere vielfach unabhängig voneinander durch massive konvergente Evolution entstanden sein. So sind beispielsweise innerhalb der Archosaurier die Osteoderme der Krokodile, der thyreophoren Dinosaurier und der sauropoden Dinosaurier keine homologen Strukturen, das heißt, nicht auf einen gemeinsamen Vorläufer-Osteodermtyp zurückzuführen.[25][11] Auch innerhalb der Froschlurche sind Osteoderme nach heutiger Kenntnis mehrfach parallel hervorgegangen.[7][5]
Osteoderme als „Tiefenhomologie“?
Embryologische Studien belegen, dass die Bildung funktionsgleicher Organe im Verlauf der Embryonalentwicklung entfernt verwandter Gruppen – zum Beispiel die Bildung der Beine bei Gliederfüßern und Landwirbeltieren – auf der Wirkung der gleichen gestaltbildenden (morphogenen) Substanzen und der Aktivität der gleichen gestaltbildenden Gene beruht. Daher haben Evolutionsbiologen und Entwicklungsbiologen die Theorie der Tiefenhomologie (deep homology) begründet, die besagt, dass das unabhängige Auftreten ähnlicher Merkmale im Erscheinungsbild (Phänotyp) verschiedener Organismengruppen auf eine Homologie der Mechanismen, welche die Ausbildung dieser Merkmale im Verlauf der Entwicklung steuern, zurückgeführt werden kann.[27][28]
Die Hypothese, Osteoderme seien „tiefenhomolog“, besagt, dass innerhalb der gemeinsamen Vorfahren aller Osteodermträger die Fähigkeit zur Bildung von Osteodermen erstmals aufgetreten ist und daraufhin an die Nachkommenschaft weitervererbt wurde. Danach kam es in manchen Nachfahren zur Einleitung der osteodermbildenden genetischen Steuerungsmechanismen und in vielen anderen Nachfahren nicht, obschon sie die dafür notwendigen genetischen Anlagen besitzen. In vergleichenden Studien zu den Osteoderm-Knochengeweben wird „Tiefenhomologie“ vielfach als Grund für Gemeinsamkeiten in der Struktur und Entwicklung der Osteoderme angeführt.[11][18][6]
Älteste Belege und die Frage nach dem Ursprung der ersten Osteoderme

Bereits die ausgestorbenen Gruppen der Fleischflosser (Sarcopterygii) des Devon und Karbon, die den Landwirbeltieren (ihren Nachfahren) näher stehen als jeder heutigen Fischgruppe und die man auch als Stammgruppe der Landwirbeltiere oder „Stamm-Landwirbeltiere“ bezeichnet, tragen verknöcherte Schuppen, auf welche sich die verknöcherten Hautschuppen der frühen Landwirbeltiere zurückführen lassen.[4]
Osteoderme im engeren Sinne sind erstmals für urtümliche Landwirbeltiere des Karbon und Perm belegt: Manche Vertreter der Temnospondyli, aus denen wahrscheinlich die heutigen Lurche (Lissamphibia) hervorgegangen sind,[17] und Chroniosuchier, die wahrscheinlich der Stammgruppe der Amniontiere (Amniota) angehören, weisen vergleichsweise dicke Knochenplatten auf, die oftmals ähnlich wie Knochen des Schädeldachs eine skulpturierte Oberfläche mit ornamentartigem Relief zeigen.[6][19] Für Osteoderme beider Gruppen wurde die Fähigkeit zur Hautknochenbildung durch Umwandlung von Hautgewebe (metaplastische Verknöcherung) nachgewiesen,[6] die für fossile Fische nicht belegt ist.[29]
Insofern die Osteoderme der Temnospondylen und heutigen Amphibien mit denen der Chroniosuchier, Reptilien und Säugetiere hinsichtlich der Osteoderm-Entwicklungsvorgänge und ihrer Steuerungsmechanismen homolog sind, muss der letzte gemeinsame Vorfahr all dieser Gruppen, der wahrscheinlich im frühen Karbon vor ca. 350 Millionen Jahren lebte, schon das Potential zur Ausbildung von Osteodermen besessen haben.[6] Demnach wäre der Ursprung der Osteoderme womöglich mit der frühesten Evolution der Landwirbeltiere nach dem Landgang der Knochenfische im Devon verbunden gewesen. Ein später Vertreter der ursprungsnahen Gruppe Colosteidae weist Hautverknöcherungen auf, die manchmal als Osteoderme interpretiert werden.[5]
Evolutionäre Trends innerhalb einzelner Osteodermträger-Gruppen

In mehreren Gruppen treten Osteoderme bei urtümlichen Vertretern zunächst als eine Reihe schmaler Schilde entlang der Rückenmittellinie auf, während spätere Vertreter eine ausgedehntere Osteoderm-Bedeckung oder einen Knochenpanzer aufweisen: Für Pareiasaurier wird solch ein Trend von großen urtümlichen Formen wie Bradysaurus mit mittiger Osteodermreihe zu kleineren Formen wie Anthodon, dessen Rücken vollständig mit Osteodermen bedeckt war, angenommen.[25] Innerhalb der Placodontier, einer Gruppe von Meeresreptilien, liegt bei Placodus und anderen Placodontoidea eine Mittelreihe von Osteodermen vor, während die späteren abgeleiteten Cyamodontoidea schildkrötenähnliche Panzer aufweisen.[9] Chroniosuchier zeigen verschieden breite Rückenosteoderm-Reihen, wobei jedoch sehr breite Osteodermsysteme wie bei Chroniosaurus mit zu den ältesten und möglicherweise urtümlichsten zählen, so dass ein Trend zu verstärkter Panzerung nicht deutlich ist.[30][19]
Bei nahen Verwandten der Archosaurier wie Euparkeria und Proterochampsa sowie bei vielen urtümlichen triaszeitlichen Archosauriern der Krokodil-Linie (Crurotarsi) wie Phytosauriern, manchen Rauisuchiern, Ornithosuchiden und Sphenosuchiern treten ebenfalls zunächst einfache Osteodermsysteme auf, die aus ein oder zwei Reihen entlang der Rücken-Mittellinie bestehen. Aus solchen Formen gehen dann die umfangreicheren Schilde und Panzer der Aetosaurier und Krokodile hervor.[24] Die Aetosaurier, die nur in der Trias auftraten, tragen eine mittig gelegene Doppelreihe stark verbreiterter Osteoderme, die durch Reihen seitlicher Osteoderme und einen Bauchpanzer ergänzt werden.[31][32] Bei den späteren Krokodilen, besonders den Vertretern der Gruppe Eusuchia, zu der auch alle heutigen Krokodile zählen, liegen meist vier oder mehr Reihen von Osteodermen, die einen Großteil der Körperrückseite bedecken, vor. Oftmals kommt ein Bauchpanzer hinzu.[33][34]
- Crurotarsi (Krokodile und Verwandte): Aus Einzel- oder Doppelreihen von Rückenosteodermen gehen im Verlauf der Stammesgeschichte Rückenpanzer hervor.
 Osteoderm-Doppelreihe beim Phytosaurier Redondasaurus.
Osteoderm-Doppelreihe beim Phytosaurier Redondasaurus.
 Rückenpanzer beim Brillenkaiman, einem Vertreter der Eusuchia.
Rückenpanzer beim Brillenkaiman, einem Vertreter der Eusuchia.
Innerhalb der Krokodile ist eine Flexibilisierung des Rücken-Osteodermsystems zu beobachten: Während bei urtümlichen Krokodilen die mit der Wirbelsäule durch Bänder verbundenen Schildsegmente entlang der Körperlängsachse eine deutlich Überlappung zeigen und durch zapfenförmige Fortsätze und seitlich angewinkelte Teilstücke nur wenig Bewegung gegeneinander zulassen, tritt bei den heutigen Krokodilen kaum Überlappung auf. Wahrscheinlich stand dieser Wandel mit dem Umbau der Wirbelsäule im Zusammenhang: Urtümliche Krokodile wiesen bikonkave (amphicoele) Wirbel auf und besaßen daher Wirbelgelenke, die anfällig gegenüber Knickbelastungen waren, welche jedoch von den miteinander in Verzahnung tretenden Osteodermen abgeblockt wurden. Vertreter der Eusuchia hingegen besitzen konvex-konkave (procoele) Wirbel und infolgedessen weniger belastungsanfällige Wirbelgelenke, die keine Abblockung durch das Osteodermsystem erforderlich machen.[34]
Bei den schildtragenden Dinosauriern (Gruppe Thyreophora) zeigen die Osteoderme einen Trend zum extremen Dickenwachstum: Gegenüber den verhältnismäßig flachen Rückenplatten der ursprungsnahen Formen Scelidosaurus und Scutellosaurus weisen die abgeleiteten Ankylosaurier und Stegosaurier Sporne, lange Stacheln, aufgerichtete Rückenplatten und Schwanzkeulen auf. Diesen Änderungen liegt offenbar ein Funktionswandel oder eine Funktionserweiterung zugrunde.[11][15][35]
Ursprung des Schildkrötenpanzers
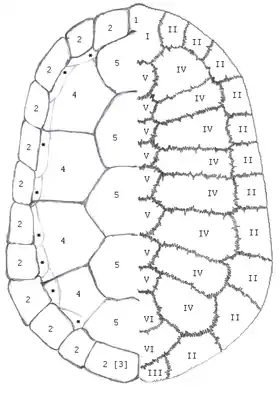
Zum Ursprung des Knochenpanzers der Schildkröten werden zwei gegensätzliche Hypothesen diskutiert:
- Da embryologischen Studien zufolge die plattigen Knochen, die den Panzer aufbauen, im Verlauf der Embryonalentwicklung aus Auswüchsen der Rippen und Wirbel hervorgehen, ist anzunehmen, dass es sich beim Schildkrötenpanzer um eine Neubildung innerhalb der Stammlinie der Schildkröten handelt, die sich nicht auf Hautknochen einer Vorläuferform zurückführen lässt.[36]
- Der Schildkrötenpanzer ist aus dem Zusammenwachsen vieler einzelner Osteoderme und schließlich aus dem Verwachsen des Osteodermschilds mit dem darunter liegenden Innenskelett hervorgegangen.[37]
In Übereinstimmung mit der zweiten Hypothese, dass auch Hautknochen an der Bildung des Panzers beteiligt waren, wurden Strukturfasern verknöcherten Hautgewebes (Anzeichen metaplastischer Verknöcherung) in den Panzersegmenten früher Schildkröten nachgewiesen.[38] Falls im Verlauf der Stammesgeschichte eine Verschmelzung der embryonalen Anlagen für die Knochen des Panzers und für die Rippen oder Wirbel stattgefunden hat, dann wäre das ein Grund dafür, warum in der Embryonalentwicklung der heutigen Schildkröten keine zusätzlichen Verknöcherungszentren in der Haut vorliegen, obwohl der Panzer ursprünglich tatsächlich aus den Osteodermen und nicht aus dem Innenskelett entstanden ist.[37]
Der kürzlich veröffentlichte Fund von Chinlechelys tenerstesta aus der späten Trias der Chinle-Formation New Mexicos hat besonders zur Diskussion über den Ursprung des Schildkrötenpanzers beigetragen. Chinlechelys zeigt im Bereich des Brustkorbs Rippen, die kaum in Verbindung mit den darüber liegenden Costalknochen des Rückenpanzers stehen, was einer Interpretation dieser Panzersegmente als Rippenauswüchse gemäß der erstgenannten Theorie widerspricht.[37] Das Vorliegen von Osteodermen entlang des Halses und Schwanzes von Chinlechelys deutet nach Ansicht der Autoren der Studie darauf hin, dass der Panzer lediglich eine Verwachsung eines Teils der Osteoderme, die die Körper ursprünglicher Schildkröten bedeckten, darstellt. Da es sich bei Chinlechelys und weiteren triaszeitlichen Schildkröten wie Proganochelys quenstedti und Proterochersis robusta nach Merkmalen der Gliedmaßen und der Knochengewebe des Panzers wahrscheinlich um Landbewohner handelt,[38] könnte der Schildkrötenpanzer so wie die Osteodermsysteme der Krokodile und ihrer Verwandten an Land entstanden sein.
Zu beinahe gegensätzlichen Schlussfolgerungen gelangen die Autoren der 2008 veröffentlichten Erstbeschreibung von Odontochelys semitestacea aus der späten Trias der Falang-Formation von Südwest-China:[39] Da dem Skelett Osteoderme fehlen und nur der Bauchpanzer (Plastron) als zusammenhängender knöcherner Schild vorliegt, während vom Rückenpanzer (Carapax) ähnlich wie in einem embryonalen Entwicklungsstadium heutiger Schildkröten nur die Mittelreihe der Neuralknochen vorhanden ist und die Rippen im Rumpfbereich verbreitet sind, sei Odontochelys ein Beleg für die evolutionäre Entstehung des Rückenpanzers nach der des Bauchpanzers und für ein Hervorgehen der Schildkrötenpanzerung ohne Osteoderm-Vorläufer aus den Rippen und Wirbeln des Innenskeletts. Da Odontochelys aus marinen Ablagerungen stammt und die (alleinige) Ausbildung eines Bauchpanzers am ehesten einem Bewohner der Meeresküsten genützt haben könnte, seien die ersten Schildkröten wahrscheinlich Wasserbewohner gewesen. Diese Interpretation wurde unter anderem in einem parallel zur Erstbeschreibung veröffentlichten Artikel in Zweifel gezogen:[40] Ähnlich wie bei späteren im Wasser lebenden Schildkröten wie den Weichschildkröten sei ein Rückenpanzer bei Odontochelys vorhanden, aber nicht voll verknöchert gewesen. Dies zeige jedoch nicht den generellen Zustand des Panzers bei den ersten Schildkröten an, sondern nur die Rückbildung des Rückenpanzers in einer bereits spezialisierten, an das Wasser angepassten Form.
Funktion


Panzerung
Der Schutz vor Fressfeinden durch eine Osteoderm-Panzerung wird in vielen Gruppen als ein bedeutender Faktor angesehen, der die Evolution von Osteoderm-Systemen ausgelöst oder zu wesentlichen Anteilen beeinflusst hat.[3] Dabei kann es wie bei vielen thyreophoren Dinosauriern[35] und manchen Echsen[3] zur Ausbildung von Feldern der Hautoberfläche kommen, die durch viele getrennte in meist kleinem Abstand liegende Hautknochenplatten bedeckt sind, oder aber zur flächenhafter Ausbildung von Osteodermen, die einander berühren und durch Bänder, Überlappungsflächen oder auch komplizierte Gelenke mehr oder weniger beweglich miteinander verbunden sind. Letzteres trifft unter anderem auf die Rückenpanzer vieler Krokodile,[34] Aetosaurier,[31] mancher Chroniosuchiden[19][41] und mancher Pareiasaurier zu.[23] Rückpanzerungen können durch einen Bauchpanzer ergänzt werden – so zum Beispiel bei manchen Krokodilen[42] und Aetosauriern.[31]
Starre Rücken- und/oder Bauchpanzer aus miteinander verzahnten oder verschweißten Osteodermen kommen bei den Placodontiern der Gruppe Cyamodontoidea,[9] gepanzerten Nebengelenktieren (Cingulata)[22] und wahrscheinlich bei Schildkröten[37] (siehe Diskussion des Osteoderm-Ursprungs der Schildkrötenpanzer oben) vor, wobei unter anderem die Gürteltiere als überlebende Vertreter der Cingulaten mehrere zueinander bewegliche Schildsegmente aufweisen, die jeweils aus unbeweglich ineinander greifenden (jedoch selten verschweißten) Osteodermen bestehen.[43]
Aktive Verteidigung


Keulenförmig verdickte oder stachelige Osteoderme nahe dem Schwanzende traten konvergent bei Stegosauriern,[11][15] Ankylosauriden,[35] urtümlichen Sauropoden wie Shunosaurus[44] und Spinophorosaurus[45] sowie gepanzerten Nebengelenktieren der ausgestorbenen Gruppe Glyptodontidae auf.[46] Derartige Hautknochen fungierten nicht als Teil der Panzerung, sondern bildeten eine Schwanz-Schlagwaffe, wofür unter anderem die Struktur ihrer Knochengewebe und biomechanische Modellierungen möglicher Schlagabläufe sprechen.[46][47][35]
Thermoregulation
Dass Osteoderme zur Thermoregulation beitrugen, indem sie den Wärmeaustausch mit der Umgebung beförderten, wurde unter anderem für die aufrecht stehenden Rückenplatten der Stegosaurier vorgeschlagen. Diese sind leicht gebaut und dicht von Gefäßen durchzogen, was dafür zu sprechen schien, dass sie anstelle einer Schutzfunktion eine Sonnenkollektor-ähnliche Funktionsweise innehatten.[48] In einer neueren Studie zeigte sich allerdings, dass die Gefäße der Osteoderm-Innen- und Außenseiten nicht im Sinne eines Kreislaufsystems in Verbindung standen, sondern die dichte Gefäßführung eher ein „bautechnisches Artefakt“ darstellte, welches nicht auf eine thermoregulatorische Funktion im ausgewachsenen Tier zurückzuführen ist, sondern auf die zeitweilig hohen Wachstumsraten der Platten, die eine gute Durchblutung erforderte.[11] Zwar könnte ein rein äußeres Gefäßsystem zum Wärmeaustausch bestanden haben, dafür gibt es jedoch keine Belege. Zudem erforderte auch die äußere Osteoderm-Hülle aus Horn eine Versorgung durch Blutgefäße. Daher sei eine thermoregulatorische Funktion, falls überhaupt, nur in einigen Stegosauriern vorgekommen und habe allenfalls eine untergeordnete Rolle gespielt.[11]
Für das Osteodermsystem des heutigen Mississippi-Alligators wurde ebenfalls erwogen, dass es zur Regulation der Körpertemperatur beigetragen haben könnte.[49] Auch für die leicht gebauten Platten und Stacheln mancher Ankylosaurier der Teilgruppen Ankylosauridae und Polacanthidae, welche Netzwerke pfeifenartiger Gefäße gleich denen der Alligator-Osteoderme aufweisen, wurde in einer neueren histologischen Studie Thermoregulation als mögliche Funktion vorgeschlagen.[35]
Zurschaustellung
Für die hoch aufragenden Platten und seitlich abstehenden Stacheln mancher Stegosaurier, Ankylosaurier und Aetosaurier wird unter Berücksichtigung ihrer histologischen Merkmale in Betracht gezogen, dass sie nicht oder nicht nur als Verteidigungseinrichtungen oder Organe zur Thermoregulation dienten, sondern (auch) der Zurschaustellung im Rahmen des Imponierverhaltens gegenüber Geschlechtspartnern oder innerartlichen Konkurrenten.[11][15][35]
Die Hypothese, die plattenförmigen Stegosaurier-Rückenosteoderme dienten hauptsächlich der Zurschaustellung, folgt besonders der Beobachtung, dass ihr Gefäßsystem kaum eine Flüssigkeitszirkulation wie bei einem Organ zur Thermoregulation unterstützte[11] und dass sich diese Osteoderme im Vergleich zu Knochen des Innenskeletts sehr spät entwickelten und daher womöglich erst bei geschlechtsreifen Tieren eine Funktion innehatten.[15] Hinzu kommt das Argument, dass besonders die Stegosaurier-Rückenplatten in seitlicher Ansicht die Körpersilhouette deutlich vergrößerten und dass aus diesem Grund Tiere mit verhältnismäßig großen Platten womöglich bei der sexuellen Selektion einen Vorteil hatten.[15]
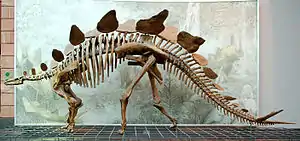
Auch die stachel- und plattenförmigen Osteoderme mancher Ankylosaurier könnten nur nachrangig eine Schutzfunktion gehabt haben. Besonders die Stacheln bei Angehörigen der Familie Polacanthidae und die Panzerplatten mancher Ankylosauriden weisen Knochengewebe von geringer Kompaktheit auf und haben möglicherweise ähnlich wie die Stegosaurier-Rückenplatten vor allem der innerartlichen Zurschaustellung gedient.[35] Das gleiche trifft möglicherweise auf manche Schwanzkeulen der Ankylosauriden zu, die nach biomechanischen Gesichtspunkten nicht alle gleichermaßen als Verteidigungswaffe geeignet waren.[47][35]
Für die nah verwandten Aetosaurier Longosuchus meadei und Lucasuchus hunti, die sich in ihrer räumlichen und zeitlichen Verbreitung gleichen, wurde die Hypothese aufgestellt, dass es sich um Tiere unterschiedlichen Geschlechts derselben Art handle, deren Unterschiede in der Form des Osteoderm-Rückenpanzers als artspezifische Merkmale fehlinterpretiert worden seien. Solche Geschlechtsunterschiede würden wiederum auf den Einfluss der sexuellen Selektion bei der Evolution des Panzers und Osteoderme als Mittel der Zurschaustellung hinweisen. Nach derzeitigem Wissensstand sind die Belege für diese Hypothese jedoch nicht ausreichend.[50]
Für die horn- und stachelbewehrten Schädel der ceratopsiden Dinosaurier wird gleichfalls eine Funktion bei der Zurschaustellung[51][52] oder alternativ bei innerartlichen Rivalenkämpfen[53] erwogen und es lassen sich für Triceratops Schädelverletzungen nachweisen, die auf Kämpfe mit Rivalen oder Fressfeinden zurückzuführen sind.[53] Es ist allerdings nicht abschließend geklärt, inwiefern es sich bei den Hörnern, Stacheln und plattenförmigen Aufsätzen der Ceratopsiden-Schädel um Bildungen der Haut handelt, die mit Osteodermen zu vergleichen sind, oder um davon zu unterscheidende Skelettelemente.[51][52]
Bestandteil des Rumpf-Tragesystems

Die Fortbewegung an Land erfordert einen anderen Körperbau als das Schwimmen im Wasser, da an Land der statische Auftrieb des Wassers als Gegenkraft zur Gewichtskraft fehlt und sich die Angriffspunkte der stattdessen wirkenden Stützkräfte und Schubkräfte der Gliedmaßen von denen der Gewichtskraft (siehe Lage des Körperschwerpunktes) unterscheiden. Bei vierbeinigen Läufern tragen besonders die Wirbelsäule und die Rückenmuskulatur zur Tragkonstruktion des Rumpfes, der den Bereich zwischen Vorder- und Hintergliedmaßen überwölbt, bei.
Eine Besonderheit des Rumpf-Tragesystems der Krokodile ist die überkreuzende Verspannung der Rückenmuskulatur zwischen den mittig gelegenen Rückenosteodermen, die mit jeweils einem Wirbel durch Knorpel und Bänder (Gürtelligamente) fest verbundenen sind, und den Querfortsätzen eines anderen entfernt liegenden Wirbels.[33][34] Dabei werden in einem Winkel von weniger als 10° zur Körperlängsachse circa fünf Segmente der Wirbelsäule überspannt. Diese Konstruktionsweise ermöglichte im Verlauf der Stammesgeschichte der Krokodile auch großen Vertretern den Gang an Land ohne Bodenkontakt des Bauches und spielt besonders bei Landbewohnern und amphibisch lebenden Vertretern der Gruppe eine wichtige Rolle.[33] Neben der Verankerung der Muskulatur schützt das Osteodermsystem die Wirbelsäule durch die Überlappung und Verkeilung benachbarter Osteoderme vor schädigenden Rumpfbiegungen und den dabei wirkenden Scherbelastungen und Torsionsbelastungen, was besonders für die anfälligeren Wirbelgelenke urtümlicher Krokodile von Bedeutung war.[34]
Auch für die Rücken-Osteodermserien der Chroniosuchier und der Dissorophiden, einer Gruppe temnospondyler Amphibien, werden Funktionen im Zusammenhang mit der Fortbewegung an Land ähnlich denen der Krokodil-Osteoderme diskutiert.[41][54]
Erhöhung der Dichte des Körpers bei Wasserbewohnern
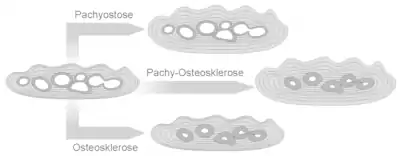
Ebenso wie sich die Knochen des Innenskeletts in ihrer Kompaktheit unterscheiden, kann die Kompaktheit der Osteoderme, das heißt der Anteil des Knochenvolumens an ihrem Gesamtvolumen, in Abhängigkeit von der Lebensweise des Osteodermträgers variieren.[38][23][6] Im Vergleich zu verwandten Landbewohnern zeigen Landwirbeltiere, die in höherem Maße an das Leben im Wasser angepasst sind, eine Reduzierung der Hohlräume im Inneren der Knochen (Kompaktheitszunahme durch Osteosklerose) oder eine Verdickung des Rindengewebes durch verstärkte äußere Anlagerung von Knochengewebe (Pachyostose) oder eine Kombination von beidem (Pachy-Osteosklerose).[55] Hintergrund der höheren Kompaktheit und vermehrten Knochensubstanz bei Wasserbewohnern ist die Funktion des Skeletts als Hilfsmittel zur Erhöhung der Dichte des Gesamtkörpers, das heißt, es trägt dazu bei, das Tier unter Wasser zu halten.
Eine hohe Kompaktheit der Osteoderme, die mit der aquatischen Lebensweise in Verbindung steht, ist unter anderem bei manchen temnospondylen Amphibien,[6] Placodontiern[9] und ausgestorbenen Meereskrokodilen[23] vorzufinden.
Schutz vor Flüssigkeitsverlust

Da Osteoderme den Flüssigkeitstransport durch die Haut verringern können, wurde für die Hautverknöcherungen der Froschlurche in Erwägung gezogen, dass sie dem Schutz vor Austrocknung gedient haben könnten.[7][56] Diese Effekte spielen jedoch allenfalls eine untergeordnete Rolle, da bei osteodermtragenden Froschlurchen im Widerspruch zum Schutz vor Flüssigkeitsverlust das Gewebe zwischen Osteodermen und Epidermis oftmals stark durchblutet ist und andere Schutzmechanismen wie die Absonderung von Hautwachs bestehen.[7]
Calcium-Reservoir
Die Ausbildung von Osteodermen aus Hydroxylapatit bietet die Möglichkeit, zeitweiligen Calcium-Mangel durch den Abbau der Osteoderm-Knochensubstanz auszugleichen, ohne auf die Substanz anderer Skelettteile zurückgreifen zu müssen. Für den wasserlebenden Temnospondylen Gerrothorax sind trogartige Einsenkungen an der Oberfläche der Osteoderme zu verschiedenen Zeitpunkten des Osteoderm-Wachstums belegt, die auf wiederkehrende Phasen der Resorption von Knochensubstanz hindeuten. Dieser histologische Befund lässt sich mit dem Lebensraum von Gerrothorax in Verbindung bringen: Der Temnospondyle bewohnte brackische Küstengebiete, die regelmäßigen Schwankungen des Salzgehaltes unterworfen waren, was sich auf den Calcium-Bedarf der Tiere auswirkte.[6]
Studien zur Knochenhistologie von Gliedmaßenknochen und Osteodermen des heutigen Mississippi-Alligators belegen, dass der Knochenumbau in den Osteodermen der Weibchen besonders ausgeprägt ist, was mit dem erhöhten Calcium-Bedarf für die Bildung der Eierschale in der Zeit vor der Eiablage in Zusammenhang steht. Zudem weicht die Stickstoff- und Kohlenstoffisotopenzusammensetzung der Osteoderm-Knochensubstanz deutlich von derjenigen der Gliedmaßenknochen und der Kohlenstoff- und Stickstoffquellen im Lebensraum der Alligatoren ab, was ebenfalls auf den häufigen Wechsel von Knochensubstanzeinlagerung und -auflösung hindeutet.[57]
Auch für ausgewachsene Titanosaurier, deren Osteoderme keine wirksame Schutzpanzerung gebildet haben, wird eine Funktion der Osteoderme als Calcium-Reservoir erwogen.[58]
Osteoderme als Forschungsgegenstand
Geschichte der Erforschung
Der russische Paläontologe Alexei Petrowitsch Bystrow nahm Mitte des 20. Jahrhunderts eine Vorreiterrolle in der histologischen Untersuchung fossiler Skelette ein und befasste sich unter anderem mit Hautknochen früher Landwirbeltiere.[59] Während vormals Osteoderme meist nur bei der Beschreibung einzelner Arten und kleinerer Gruppen Berücksichtigung fanden, folgten in den 1960er bis 1980er Jahren mehrere Forschungsarbeiten, die sich zusammenfassend den Osteodermen verschiedener heute lebender Großgruppen widmeten.[60][7][33]
Studien zur Mikrostruktur von fossilen Knochen, unter anderem die Untersuchung von Knochen-Dünnschliffen mit dem Polarisationsmikroskop, wurden in den 1980er und 1990er Jahren besonders durch die Forschungstätigkeit der Arbeitsgruppe um Armand de Ricqlès wiederbelebt[2][61] und gehörten in der Folgezeit zu den Standardmethoden der Paläobiologie, die vielfach auch auf Osteoderme angewandt wurden. Viele Studien der 2000er Jahre widmeten sich den Osteodermen einzelner fossiler und heute lebender Gruppen und versuchten ihre Entstehung und Veränderung im Verlauf der Individualentwicklung, ihren stammesgeschichtlichen Wandel und ihre Funktion(en) aufzuklären. Sie führten besonders in den letzten zehn Jahren zu einem vielfältigeren Gesamtbild über die Biologie der Osteoderme.[3]
Systematik und Phylogenetik
In manchen Gruppen ausgestorbener Osteodermträger wie den Chroniosuchiern, Aetosauriern und schildtragenden Dinosauriern gehören Osteoderm-Reihen und -Panzer zu den Skelett-Elementen, die sich im Verlauf der Evolution besonders schnell verändern und in denen sich Teilgruppen und Arten am deutlichsten voneinander unterscheiden. Daher können neue Fossilfunde dieser Gruppen aufgrund von Merkmalen der äußeren Form, der Knochengewebestruktur und der Anordnung der Osteoderme systematisch eingeordnet werden. Zudem werden Osteoderm-Merkmale dieser Gruppen für die Stammesgeschichtsforschung (Phylogenetik), welche die Klärung der Verwandtschaftsverhältnisse und des Ablaufs der Stammesgeschichte zum Ziel hat, herangezogen.[30][19][32][62][63][64] Besonders die stammesgeschichtlichen Analysen der Aetosaurier beruhen meist in der Mehrzahl auf Merkmalen des besonders vielgestaltigen Osteodermpanzers.[62][32]
In anderen Gruppen sind Osteoderm-Merkmale nur nachrangig von Bedeutung für die Erkennung von Verwandtschaftsverhältnissen, jedoch deshalb stammesgeschichtlich bedeutsam, da ihr Gestaltwandel mit einem Wandel in der Funktion einhergeht – so bei Krokodilen, deren Osteodermsystem eng mit der Funktionsweise des Bewegungsapparates in Zusammenhang steht[33][34] – und sich daher Faktoren, welche die Evolution dieser Gruppen steuern, erkennen lassen.
Entwicklungsbiologie
Neuere Studien zur Osteoderm-Histologie sowie zur Haut heute lebender Osteodermträger versuchen meist Aussagen zur Anlage, Entstehung und Veränderung der Osteoderme im Verlauf der Individualentwicklung zu treffen.[11][12][3][15] Dies ist deshalb geboten, da sich einerseits ein evolutionärer Wandel im Erscheinungsbild und in der Funktion der Osteoderme oftmals in Form von Änderungen der Bildungs- und Wachstumsvorgänge manifestiert und sich andererseits ein gemeinsamer Ursprung verschiedener Hautverknöcherungstypen anhand von Gemeinsamkeiten und Unterschieden in den Entwicklungsvorgängen belegen beziehungsweise widerlegen lässt. So konnten zum Beispiel anhand entwicklungsbiologischer Befunde die Osteoderme bestimmter ausgestorbener Reptiliengruppen als Vorläuferstrukturen des Schildkrötenpanzers ausgeschlossen werden.[9][23] Im Hinblick auf das Anliegen der Aufklärung von Evolutionsprozessen unter Zuhilfenahme entwicklungsbiologischer Methoden und Daten sind Osteoderme ein typischer Forschungsgegenstand der Evolutionären Entwicklungsbiologie.
Literaturhinweise
- H. Francillon-Vieillot, V. de Buffrénil, J. Castanet, J. Géraudie, F. J. Meunier, J.-Y. Sire, L. Zylberberg, A. de Ricqlès: Microstructure and mineralization of vertebrate skeletal tissues. In: J. G. Carter (Hrsg.): Skeletal Biomineralization: Patterns, Process and Evolutionary Trends. Van Nostrand Reinhold, New York 1990, S. 471–548.
- W. G. Joyce, S. G. Lucas, T. M. Scheyer, A. B. Heckert, A. P. Hunt: A thin-shelled reptile from the Late Triassic of North America and the origin of the turtle shell. In: Proceedings of the Royal Society. Series B 276, 2009, S. 507–513
- N. Klein, T. M. Scheyer, T. Tütken: Skeletochronology and isotopic analysis of a captive individual of Alligator mississippiensis Daudin, 1802. In: Fossil Record 12, 2009, S. 121–131.
- R. P. Main, A. de Ricqlès, J. R. Horner, K. Padian: The evolution and function of thyreophoran dinosaur scutes: implications for plate function in stegosaurs. In: Paleobiology. 31, 2005, S. 291–314.
- R. Ruibal, V. Shoemaker: Osteoderms in anurans. In: Journal of Herpetology. 18, 1984, S. 313–328.
- T. M. Scheyer, P. M. Sander: Histology of ankylosaur osteoderms: implications for systematics and function. In: Journal of Vertebrate Paleontology. 24, 2004, S. 874–893.
- M. K. Vickaryous, J.-Y. Sire: The integumentary skeleton of tetrapods: origin, evolution, and development. In: Journal of Anatomy. 214, 2009, S. 441–464.
- F. Witzmann, R. Soler-Gijón: The bone histology of osteoderms in temnospondyl amphibians and in the chroniosuchian Bystrowiella. In: Acta Zoologica. 91, 2010, S. 96–114.
Einzelnachweise
- Wilhelm Gemoll: Griechisch-Deutsches Schul- und Handwörterbuch. G. Freytag Verlag/Hölder-Pichler-Tempsky, München/Wien 1965.
- H. Francillon-Vieillot, V. de Buffrénil, J. Castanet, J. Géraudie, F. J. Meunier, J.-Y. Sire, L. Zylberberg, A. de Ricqlès: Microstructure and mineralization of vertebrate skeletal tissues. In: J. G. Carter (Hrsg.): Skeletal Biomineralization: Patterns, Process and Evolutionary Trends. Van Nostrand Reinhold, New York 1990, S. 471–548.
- M. K. Vickaryous, J.-Y. Sire: The integumentary skeleton of tetrapods: origin, evolution, and development. In: Journal of Anatomy. 214, 2009, S. 441–464.
- F. Witzmann: The evolution of scalation patterns in temnospondyl amphibians. In: Zoological Journal of the Linnean Society. 150, 2007. S. 815–134.
- J. Castanet, H. Francillon-Vieillot, A. de Ricqles, L. Zylberberg: The skeletal histology of the Amphibia. In: H. Heatwole, M. Davies: Amphibian Biology. Vol. 5: Osteology. Surrey Beatty & Sons, Chipping Norton, 2003, S. 1598–1683.
- F. Witzmann, R. Soler-Gijón: The bone histology of osteoderms in temnospondyl amphibians and in the chroniosuchian Bystrowiella. In: Acta Zoologica. 91, 2010, S. 96–114.
- R. Ruibal, V. Shoemaker: Osteoderms in anurans. In: Journal of Herpetology. 18, 1984, S. 313–328.
- K. V. Kardong: Vertebrates – comparative anatomy, function, evolution. 2. Auflage, WCB McGraw-Hill, Boston, 1998, 747 S; siehe Kapitel 5.
- T. M. Scheyer: Skeletal histology of the dermal armor of Placodontia: the occurrence of ‘postcranial fibro-cartilaginous bone’ and its developmental implications. In: Journal of Anatomy. 211, 2007, S. 737–753.
- R. W. Haines, A. Mohuiddin: Metaplastic bone. In: Journal of Anatomy. 103, 1968, S. 527–538.
- R. P. Main, A. de Ricqlès, J. R. Horner, K. Padian: The evolution and function of thyreophoran dinosaur scutes: implications for plate function in stegosaurs. In: Paleobiology. 31, 2005, S. 291–314.
- M. K. Vickaryous, B. K. Hall: Development of the Dermal Skeleton in Alligator mississippiensis (Archosauria, Crocodylia) With Comments on the Homology of Osteoderms. In: Journal of Morphology 269, 2008, S. 398–422.
- L. Zylberberg, J. Castanet: New data on the structure and the growth of the osteoderms in the reptile Anguis fragilis L. (Anguidae, Squamata). In: Journal of Morphology 186, 1985, S. 327–342.
- M. K. Vickaryous, B. K. Hall: Osteoderm Morphology and Development in the Nine-Banded Armadillo, Dasypus novemcinctus (Mammalia, Xenarthra, Cingulata). In: Journal of Morphology 267, 2006, S. 1273–1283.
- S. Hayashi, K. Carpenter, D. Suzuki: Different growth patterns between the skeleton and osteoderms of Stegosaurus stenops: implications for plate and spike growth. In: Journal of Vertebrate Paleontology. 29, 2009, S. 123–131.
- R. L. Carroll, Dong Z.-M.: Hupehsuchus, an enigmatic aquatic reptile from the Triassic of China, and the problem of establishing relationships. In: Philosophical Transactions of the Royal Society of London Series B 331, 1991, S. 131–153.
- M. Ruta, M. I. Coates, D. L. J. Quicke: Early tetrapod relationships revisited. In: Biological Reviews. 78, 2003, S. 251–345.
- R. V. Hill: Integration of morphological data sets for phylogenetic analysis of Amniota: the importance of integumentary characters and increased taxonomic sampling. In: Systematic Biology. 54, 2005, S. 1–18.
- I. V. Novikov, M. A. Shishkin, V. K. Golubev: Permian and Triassic anthracosaurs from Eastern Europe. In: M. A. Shishkin, M. J. Benton, D. M. Unwin, E. N. Kurochkin (eds.): The Age of Dinosaurs in Russia and Mongolia. Cambridge University Press, Cambridge 2000, S. 60–70.
- R. L. Carroll, P. Gaskill: The Order Microsauria. The American Philosophical Society, Philadelphia 1978.
- J. Botha-Brink, S. P. Modesto: A mixed-age classed ‘pelycosaur’ aggregation from South Africa: earliest evidence of parental care in amniotes? In: Proceeding of the Royal Society London. Series B, 274, 2007, S. 2829–2834.
- R. V. Hill: Comparative anatomy and histology of xenarthran osteoderms. In: Journal of Morphology 267, 2006, S. 1441–1460.
- T. M. Scheyer, P. M. Sander: Bone microstructures and mode of skeletogenesis in osteoderms of three pareiasaur taxa from the Permian of South Africa. In: Journal of Evolutionary Biology. 22, 2009, S. 1153–1162.
- J. M. Parrish: Phylogeny of the Crocodylotarsi, with reference to archosaurian and crurotarsan monophyly. In: Journal of Vertebrate Paleontology. 13, 1993, S. 287–308.
- T. M. Scheyer, P. M. Sander: Histology of ankylosaur osteoderms: implications for systematics and function. In: Journal of Vertebrate Paleontology. 24, 2004, S. 874–893.
- M. D. d’Emic, J. A. Wilson, S. Chatterjee: The titanosaur (Dinosauria: Sauropoda) osteoderm record: review and first definitive specimen from India. In: Journal of Vertebrate Paleontology. 29, 2009, S. 165–177.
- N. Shubin, C. Tabin, S. Carroll: Fossils, genes and the evolution of animal limbs. In: Nature. 388, 1997, S. 639–648.
- N. Shubin, C. Tabin, S. Carroll: Deep homology and the origins of evolutionary novelty. In: Nature. 457, 2009, S. 818–823.
- J.-Y. Sire, A. Huysseune: Formation of dermal skeletal and dental tissues in fish: a comparative and evolutionary approach. In: Biological Reviews of the Cambridge Philosophical Society. 78, 2003, S. 219–249.
- V. K. Golubev: Revision of the Late Permian chroniosuchians (Amphibia, Anthracosauromorpha) from Eastern Europe. In: Paleontological Journal. 32, 1998, S. 390–401.
- R. A. Long, P. A. Murry: Late Triassic (Carnian and Norian) tetrapods from the southwestern United States. In: New Mexico Museum of Natural History and Science Bulletin. 4, 1995, S. 1–254.
- W. G. Parker: Reassessment of the aetosaur ‘Desmatosuchus’ chamaensis with a reanalysis of the phylogeny of the Aetosauria (Archosauria: Pseudosuchia). In: Journal of Systematic Palaeontology. 5, 2007, S. 41–68.
- E. Frey: Das Tragsystem der Krokodile – eine biomechanische und phylogenetische Analyse. Stuttgarter Beiträge zur Naturkunde Serie A 426, 1988, S. 1–60.
- S. W. Salisbury, E. Frey: A biomechanical transformation model for the evolution of semi-spheroidal articulations between adjoining vertebral bodies in crocodilians. In: G. C. Grigg, F. Seebacher, C. E. Franklin (eds.): Crocodilian biology and evolution. Surrey Beatty and Sons, Chipping Norton 2000, S. 85–134.
- S. Hayashi, K. Carpenter, T. M. Scheyer, M. Watabe, D. Suzuki: Function and evolution of ankylosaur dermal armor. In: Acta Palaeontologica Polonica. 55, 2010, S. 213–228.
- S. F. Gilbert, G. A. Loredo, A. Brukman, A. C. Burke: Morphogenesis of the turtle shell: the development of a novel structure in tetrapod evolution. In: Evolution & Development. 3, 2001, S. 47–58.
- W. G. Joyce, S. G. Lucas, T. M. Scheyer, A. B. Heckert, A. P. Hunt: A thin-shelled reptile from the Late Triassic of North America and the origin of the turtle shell. In: Proceedings of the Royal Society. Series B 276, 2009, S. 507–513.
- T. M Scheyer, P. M. Sander: Terrestrial paleoecology for basal turtles indicated by shell bone histology. In: Proceedings of the Royal Society. Series B 274, 2008, S. 1885–1893.
- C. Li, X.-C. Wu, O. Rieppel, L.-T. Wang, L.-J. Zhao: An ancestral turtle from the Late Triassic of southwestern China. In: Nature. 456, 2008. S. 497–501.
- R. R. Reisz, J. J. Head: Turtle origins out to sea. In: Nature. 456, 2008, S. 450–451.
- J. A. Clack, J. Klembara: An articulated specimen of Chroniosaurus dongusensis, and the morphology and relationships of the chroniosuchids. In: Special Papers in Palaeontology. 81, 2009, S. 15–42.
- R. Steel: Die fossilen Krokodile. (= Die Neue Brehm-Bücherei. Band 488). A. Ziemsen Verlag, Wittenberg, 1975, 76 S.
- M. K. Vickaryous, B. K. Hall BK: Osteoderm morphology and development in the Nine-Banded Armadillo, Dasyceps novemcinctus (Mammalia, Xenarthra, Cingulata). In: Journal of Morphology. 267, 2006, S. 1273–1283.
- Y. Zhang: The Middle Jurassic dinosaur fauna from Dashanpu, Zigong, Sichuan. Volume I: Sauropod dinosaur (I). Shunosaurus. Sichuan Publishing House of Science and Technology, Chengdu 1988.
- K. Remes, F. Ortega, I. Fierro, U. Joger, R. Kosma, J. M. M. Ferrer, O. A. Ide, A. Maga: A new basal sauropod dinosaur from the Middle Jurassic of Niger and the early evolution of Sauropoda. In: PLoS ONE. 4(9), 2009, e6924. PMC 2737122 (freier Volltext)
- R. E. Blanco, W. W. Jones, A. Rinderknecht: The sweet spot of a biological hammer: the centre of percussion of glyptodont (Mammalia: Xenarthra) tail clubs. In: Proceedings of the Royal Society. series B 276, 2009, S. 3971–3978.
- V. M. Arbour: Estimating impact forces of tail club strikes by ankylosaurid dinosaurs. In: PLoS ONE. 4(8), 2009, e6738. PMC 2726940 (freier Volltext)
- V. de. Buffrénil, J. O. Farlow, A. de Ricqlès: Growth and function of Stegosaurus plates: evidence from bone histology. In: Paleobiology. 12, 1986, S. 459–473.
- M. R. Seidel: The osteoderms of the American alligator and their functional significance. In: Herpetologica. 35, 1979, S. 375–380.
- W. G. Parker, J. W. Martz: Using positional homology in aetosaur (Archosauria: Pseudosuchia) osteoderms to evaluate the taxonomic status of Lucasuchus hunti. In: Journal of Vertebrate Paleontology. 30, 2010, S. 1100–1108.
- J. H. Horner, M. B. Goodwin: Ontogeny of cranial epi-ossifications in Triceratops. In: Journal of Vertebrate Paleontology. 28, 2008, S. 134–144.
- T. L. Hieronymus, L. M. Witmer, D. H. Tanke, P. J. Currie: The facial integument of centrosaurine ceratopsids: morphological and histological correlates of novel skin structures. In: The anatomical record. 292, 2009, S. 1370–1396.
- A. A. Farke, E. D. S. Wolff, D. H. Tanke: Evidence of Combat in Triceratops. In: PLoS ONE. 4(1), 2009, e4252.
- D. Dilkes: Comparison and biomechanical interpretations of the vertebrae and osteoderms of Cacops aspidephorus and Dissorophus multicinctus (Temnospondyli, Dissorophidae). In: Journal of Vertebrate Paleontology. 29, 2009, S. 1013–1021.
- A. de Ricqlès, V. de Buffrénil: Bone histology, heterochronies, and the return of tetrapods to life in water: Where are we? In: J.-M. Mazin, V. de Buffrénil: Secondary adaptations of tetrapods to life in water. Verlag Pfeil, München 2001, S. 289–310.
- H. B. Lillywhite: Water relations of tetrapod integument. In: Journal of Experimental Biology. 209, 2006, S. 202–226.
- N. Klein, T. M. Scheyer, T. Tütken: Skeletochronology and isotopic analysis of a captive individual of Alligator mississippiensis Daudin, 1802. In: Fossil Record 12, 2009, S. 121–131.
- T. da Silva Marinho: Functional aspects of titanosaur osteoderms. Nature Precedings, 2007.
- siehe Auflistung der Werke im Artikel Alexei Petrowitsch Bystrow
- M. L. Moss: Comparative histology of dermal sclerifications in reptiles. In: Acta Anatomica 73, 1969, S. 510–533.
- A. de Ricqlès, F. J. Meunier, J. Castanet, H. Francillon-Vieillot: Comparative microstructure of bone. In: B. K. Hall (Hrsg.): Bone. vol. 3. Bone matrix and bone specific products. CRC Press, Boca Raton, 1991, S. 1–78.
- A. B. Heckert, S. G. Lucas: A new aetosaur from the Upper Triassic of Texas and phylogeny of aetosaurs. In: Journal of Vertebrate Paleontology 19, 1999, S. 50–68.
- K. Carpenter: Phylogenetic analysis of the Ankylosauria. In: K. Carpenter (Hrsg.): The Armored Dinosaurs. Indiana University Press, Bloomington & Indianapolis, 2001, S. 455–483.
- M. E. Burns: Taxonomic utility of ankylosaur (Dinosauria, Ornithischia) osteoderms: Glyptodontopelta mimus FORD, 2000: a test case. In: Journal of Vertebrate Paleontology 28, 2008, S. 1102–1109.