Zweifinger-Faultiere
Die Zweifinger-Faultiere (Choloepus) sind eine Säugetiergattung aus der Familie der Choloepodidae und der Unterordnung der Faultiere. Die Bezeichnung Zweizehen-Faultiere, die manchmal für die Gruppe verwendet wird, ist insofern irreführend, als sie nur an den Vorderfüßen zwei, an den Hinterfüßen jedoch drei Zehen aufweisen. Die Gattung umfasst zwei rezente Arten, das Eigentliche Zweifingerfaultier (Choloepus didactylus), auch Unau genannt, und das Hoffmann-Zweifingerfaultier (Choloepus hoffmanni). Beide Arten bewohnen den zentralen und nördlichen Teil Südamerikas; ersteres ist zudem auch in Teilen Mittelamerikas zu finden. Hauptsächlich kommen die Zweifinger-Faultiere in tropischen Regenwäldern des Flach- und Berglands vor. Sie ernähren sich meist von pflanzlicher, gelegentlich auch von tierischer Nahrung. Die Tiere leben einzelgängerisch und sind nachtaktiv. Besonderheiten stellen vor allem die mit dem Rücken nach unten, in den Ästen hängende Lebensweise und Fortbewegung, ebenso wie die, aufgrund der energiearmen Ernährung, niedrige Stoffwechselrate, einhergehend mit sehr langsamen Bewegungen, dar.
| Zweifinger-Faultiere | ||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|

Hoffmann-Zweifingerfaultier (Choloepus hoffmanni) | ||||||||||||
| Systematik | ||||||||||||
| ||||||||||||
| Wissenschaftlicher Name der Familie | ||||||||||||
| Choloepodidae | ||||||||||||
| J. E. Gray, 1871 | ||||||||||||
| Wissenschaftlicher Name der Gattung | ||||||||||||
| Choloepus | ||||||||||||
| Illiger, 1811 |
Beschreibung
Habitus

Die Zweifinger-Faultiere erreichen eine Kopf-Rumpf-Länge von 54 bis 72 cm und ein Körpergewicht von 3,3 bis 9 kg. Der Körper ist perfekt an eine an den Ästen hängende Lebensweise angepasst. Das Fell der Tiere ist im Gegensatz zu den meisten anderen Säugetieren vom Bauch zum Rücken hin gescheitelt, um einen besseren Abfluss des Regenwassers zu ermöglichen. Seine Farbe variiert von gelblich bis graubraun, wobei der Kopf eine hellere Färbung als der übrige Körper aufweist, die Gliedmaßen teilweise eine dunklere. Es kann jedoch durch Algen einen grünen Farbton annehmen. Der Kopf ist gerundet und besitzt zwei kleine, nach vorn gerichtete Augen mit kleinen Pupillen. Die ebenfalls kleinen Ohren bleiben im Fell verborgen, ebenso wie der kurze Schwanz. Die Gliedmaßen sind im Gegensatz zu den Dreifinger-Faultieren annähernd gleich lang, an den Vorderfüßen befinden sich zwei und an den Hinterfüßen drei Zehen, die allesamt lange Krallen tragen. Allerdings sind die seitlich außen und innen anliegenden Zehenstrahlen noch rudimentär erhalten.[1][2][3][4]
Schädel- und Gebissmerkmale
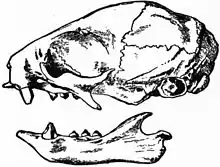
Der Schädel der Zweifinger-Faultiere ist mit durchschnittlich 10,9 cm kurz gestaltet, jedoch länger als bei den Dreifinger-Faultieren. Er besitzt im Profil eine deutlich gerundete Form. Charakteristische Merkmale für Faultiere allgemein stellen der verlängerte Oberkiefer und der stark gekürzte Mittelkieferknochen dar, der zudem nicht mit dem Nasenbein in Kontakt steht. Weiterhin ist der Jochbogen nicht vollständig ausgebildet. Am Jochbein setzten zwei Knochenauswüchse an. Der des Jochbogens reicht bei den Zweifinger-Faultieren nicht so deutlich nach oben wie bei den Dreifinger-Faultieren, sondern ist eher nach hinten orientiert. Er berührt zudem fast das vordere Ende des Bogenansatzes des Schläfenbeins. Der zweite Knochenauswuchs weist schräg nach hinten und unten und ist relativ und absolut kürzer als bei den Dreifinger-Faultieren. Ein weiterer Unterschied findet sich in der Ohrregion: hier haben die Zweifinger-Faultiere wie fast alle ausgestorbenen bodenbewohnenden Faultiere einen tympanischen Ring ausgebildet, im Gegensatz zu ihren rezenten Verwandten mit einer Paukenblase.[5]
Typisch für den Unterkiefer der Zweifinger-Faultiere ist die spatelförmig nach vorn gezogene, kräftig verknöcherte Symphyse. Die Gelenkäste sind im Vergleich zu den Dreifinger-Faultieren relativ niedrig, die Gelenkverbindung zum Schädel liegt dadurch nur wenig über der Kaufläche, was an die Raubtiere erinnert. Das Gebiss zeichnet sich gegenüber den anderen Höheren Säugetieren durch das Fehlen des Zahnschmelzes aus, zudem ist es abweichend strukturiert. Generell fehlen die Schneide- und Eckzähne. Je Kieferhälfte sind im Oberkiefer fünf und im Unterkiefer vier Zähne ausgebildet, insgesamt also 18. Die hinteren besitzen eine molarenartige Gestalt, der jeweils vorderste ist eckzahnartig (caniniform) gestaltet und deutlich vergrößert, so dass er die anderen Zähne überragt. Er wird durch eine Lücke (Diastema) von den restlichen Zähnen getrennt. Höchstwahrscheinlich entspricht der caniniforme vordere Zahn nicht dem eigentlichen Eckzahn der Säugetiere, da beim geschlossenen Gebiss der untere hinter dem oberen liegt und nicht – wie sonst – umgekehrt. Die Gebissgestaltung gilt als ursprünglich für die Faultiere und tritt auch bei zahlreichen fossilen Formen auf, etwa bei den Mylodontidae. Die gegenüberliegenden Backenzähne besitzen, abweichend zu den Dreifinger-Faultieren, bei Kieferschluss eine alternierende Stellung zueinander.[5][6]
Skelettmerkmale

Mit 5 bis 7 Halswirbeln ist der Nacken deutlich kürzer als der der Dreifinger-Faultiere (8 oder 10). Teilweise wird vermutet, dass die ersten beiden rippentragenden Brustwirbel zurückverlagerte Halswirbel darstellen.[7][8] Die Brustwirbelsäule besteht aus 24 Wirbeln, davon dienen 21 als Ansatzstelle für Rippen. Dreifinger-Faultiere weisen dagegen nur 16 Brustwirbel auf, 14 davon mit Rippen versehen. Der Schwanz ist äußerst kurz und besteht aus nur 4 bis 5 Wirbeln. Die in den Ästen hängende Lebensweise führte auch zu Veränderungen im Bewegungsapparat, der von dem der bodenlebenden Säugetiere etwas abweicht. Dabei sind vor allem der Brust- und Schulterbereich betroffen, zudem schließt dies auch Veränderungen in der Anordnung der Muskulatur ein, etwa im Bereich der Brust- und oberen Rückenmuskulatur. Diese Veränderungen waren erforderlich, um einerseits der Gravitation bei der hängenden Lebensweise entgegenzuwirken, andererseits, um den Bewegungsantrieb zu gewährleisten, da hier die Vorderbeine im Gegensatz zu bodenbewohnenden Säugetieren als Antrieb dienen.[1][9]
Fell
Das Fell der Zweifinger-Faultiere besteht nur aus einer Lage, dem Deckhaar, das zottelig lang ist, wobei die Haare im Schulterbereich bis zu 17 cm Länge erreichen. Der Aufbau des Felles ist abweichend von den Dreifinger-Faultieren mit ihrem zweilagigen Haarkleid. Auch unterscheidet sich die Haarform deutlich von der ihrer dreifingrigen Verwandten. Der Durchmesser liegt bei nur 0,16 mm, weiterhin laufen über die gesamte Länge der Außenfläche 3 bis 9 Längsrippeln und -rillen, was einmalig unter Säugetieren ist. Die Cuticula ist nicht durchgehend ausgebildet, sondern wird von kleinen Grübchen unterbrochen. In den Grübchen nisten Algen, die das Fell teilweise grünlich schimmern lassen, was vor allem in der Regenzeit häufig zum Vorschein tritt und den Tarneffekt im Geäst erhöht. Zu den häufigsten Algenformen gehören Rotalgen der Gattung Rufusia und Grünalgen wie Dictyococcus und Chlorococcum. Wie allen Faultieren gemein, fehlt den Haaren der Markkanal (Medulla).[10][1]
Lautäußerungen und Sinnesleistungen
Lautäußerungen der Zweifinger-Faultiere sind nur wenige bekannt; häufig handelt es sich um Rufe von Jungtieren, die vom Muttertier getrennt wurden. Aufgrund des Baus der Ohren können die Tiere nur Töne in einem niedrigen Frequenzbereich wahrnehmen, der zwischen 0,3 und 30 kHz liegt, optimal zwischen 0,5 und 3 kHz. Erwachsene Tiere werden dadurch überwiegend durch Laute von 2 bis 8 kHz aktiviert, was sich auch die Jungtiere auf der Suche nach dem Muttertier zunutze machen. Der Sehsinn ist unterentwickelt, da der Musculus ciliaris fehlt. Dadurch sind die Tiere kurzsichtig. Die stark gekrümmte Hornhaut der Augenlinse bewirkt eine Sehschärfe von 3 bis 4 Dioptrien. Die Sehfähigkeit der Jungtiere ist allerdings in der Regel besser als die der Adulten.[11][1][4]
Verbreitung
Die Zweifinger-Faultiere leben in Mittel- und Südamerika, ihr Verbreitungsgebiet reicht von Nicaragua bis Peru und Brasilien. Sie bewohnen tropische Regenwälder des Tief- und Berglands, aber teilweise auch laubabwerfende Wälder und Sekundärwälder. Gelegentlich werden Tiere auch in offeneren Landschaften beobachtet. Aufgrund des nur einlagigen Fells tolerieren die Zweifinger-Faultiere keine kühleren Temperaturen. Die Thermoneutralität liegt bei etwa 24 °C und damit höher als bei den Dreifinger-Faultieren mit ihrem dichten Unterfell. Aus diesem Grund sind die Zweifinger-Faultiere selten in Hochgebirgslagen anzutreffen. Allerdings wurde ein Tier in einer Höhenlage von fast 3.300 m gesichtet. Vertreter von Populationen in höherlagigen Verbreitungsgebieten haben häufig ein dichter ausgebildetes Fell.[12][10][4]
Lebensweise
Sozialverhalten und Aktivitäten

Die Lebensweise wildlebender Zweifinger-Faultiere ist nur unzureichend erforscht. Sie verbringen nahezu ihr gesamtes Leben in den Ästen hängend, ihre Lebensweise ist aufgrund des geringen Nährwerts ihrer Nahrung auf Energiesparen ausgerichtet. Allerdings sind sie im Vergleich zu den Dreifinger-Faultieren weniger wählerisch in Bezug auf ihre Nahrung, weswegen sie als „agiler“ als ihre Verwandten gelten. Auch Schlaf, Nahrungsaufnahme, Paarung und Gebärvorgang erfolgen in der hängenden Lebensweise; die Zweifinger-Faultiere verlassen das Geäst lediglich, um zu einem anderen Baum zu kommen oder zum Defäkieren. In den Bäumen können sie täglich bis zu 40 m zurücklegen, in Ausnahmefällen bis zu 300 m und mehr. Die erreichten Geschwindigkeiten liegen bei 0,1 bis 0,16 m je Sekunde (360 bis 580 m je Stunde), maximale Geschwindigkeiten wurden mit 0,47 m je Sekunde (1690 m je Stunde) registriert.[13] Am Boden sind sie eher hilflos und vermögen ihren Körper nur für kurze Zeit vom Boden zu heben.[13] Allerdings können sie sehr gut schwimmen. Die Tiere verbringen rund 13 Stunden pro Tag schlafend, ihre Aktivitätsperioden konzentrieren sich auf die Nachtstunden. Sie sind vorwiegend Einzelgänger, einzelne Tiere nutzen Aktionsräume von 0,4 bis 3,9 ha Größe. In mehr offenen Landschaften können diese auch deutlich größer sein. Territoriales Verhalten konnte dabei nur selten beobachtet werden.[14] Die Populationsdichte schwankt abhängig von der Region, zwischen 0,04 und 2,7 Individuen je Hektar.[11][15][1][4]
Ernährung und Stoffwechsel
Die Zweifinger-Faultiere sind weniger wählerisch als Dreifinger-Faultiere, sie nehmen neben Blättern auch Früchte, Blüten und Knospen zu sich. Gelegentlich verzehren sie auch Insekten, Vogeleier und Nestlinge. Die generell energiearme Pflanzenkost führt zu einer geringen Stoffwechselrate, die nur bei 40 bis 45 % eines vergleichbar großen Säugetiers liegt und eine sehr energiesparende Lebensweise zur Folge hat. So ist unter anderem die Muskelkontraktion etwa 4- bis 6-mal langsamer als bei einer Hauskatze, die Muskelrelaxation sogar 9- bis 11-mal langsamer. Die Defäkation erfolgt in der Regel nur einmal wöchentlich. Die Körpertemperatur ist variabel und schwankt zwischen 32,7 und 35,5 °C, vor allem während des Schlafes oder während kühlerer Tageszeiten beziehungsweise bei feuchtem Wetter sinkt sie teilweise stark ab.[11] Wildlebende Zweifinger-Faultiere schlafen und ruhen etwa 13 Stunden täglich, zwischen den einzelnen Ruhephasen liegen Zeiten erhöhter, zumeist nächtlicher Aktivität, die auch bis zu 7,5 Stunden anhalten kann. Um aber wichtige Ergänzungsstoffe zu erhalten, die durch die eher energiearme Nahrung nicht verfügbar sind, hat sich bei den Zweifinger-Faultieren wie bei den Dreifinger-Faultieren eine besondere Symbiose entwickelt. Im Fell leben Motten der Gattung Cryptoses, welche ihre Eier in den Dung der Faultiere legen. Sie geben zudem Stickstoffverbindungen an die ebenfalls im Fell lebenden Algen ab. Durch Ablecken des Fells nehmen die Zweifinger-Faultiere die Algen auf und erhalten dadurch die Ergänzungsstoffe. Der Effekt ist aber bei den Dreifinger-Faultieren deutlicher entwickelt.[1][10][16][4]
Fortpflanzung
Die Paarung ist ganzjährig, kann bei einigen Populationen unter Umständen aber auch abhängig von den Jahreszeiten sein und findet dann zu Beginn der Trockenzeit statt. Die Tragzeit dauert zehn bis elf Monate, in der Regel wird ein einzelnes Jungtier geboren. Dieses ist rund 21 bis 25 cm lang und wiegt rund 360 bis 450 g. Die ersten Lebenswochen verbringt es an den Bauch der Mutter geklammert, mit spätestens fünf Wochen nimmt es erstmals feste Nahrung zu sich. Die Stillzeit liegt bei rund fünf Monaten. Endgültig selbstständig wird es mit sechs bis neun Monaten, der Prozess kann aber auch bis zu zwei Jahre dauern. Weibchen werden mit rund drei Jahren geschlechtsreif, Männchen mit vier bis fünf Jahren. Der Abstand zwischen zwei Geburten beträgt etwa anderthalb Jahre. Die Lebenserwartung der Zweifinger-Faultiere in freier Wildbahn ist unbekannt, in menschlicher Obhut können sie 40 Jahre und älter werden.[17][1][4] Das höchste dokumentierte Lebensalter hatte ein mindestens 50 Jahre altes, in menschlicher Obhut gehaltenes Zweifingerfaultier.[18]
Fressfeinde und Überlebensstrategien
Bedeutendste Fressfeinde sind Greifvögel wie die Harpyie, größere und kleinere Katzen, so der Jaguar und der Ozelot und Riesenschlangen, etwa Anakondas. Mit ihren Vorderkrallen und Zähnen können sich die Zweifinger-Faultiere gegenüber Fressfeinden verteidigen, meist sind sie aber durch ihr Fell und ihre sehr langsamen Bewegungen getarnt.[11][1]
Systematik
Innere Systematik der Faultiere nach Presslee et al. 2019 (basierend auf Proteinanalysen)[19]
Die Unterteilung der Megalocnoidea erfolgt nach Delsuc et al. 2019[20] |
Innere Systematik der Faultiere nach Varela et al. 2019 (basierend auf skelettanatomischen Merkmalen)[21]
|
Die Zweifinger-Faultiere (Cholöoepus) sind eine Gattung innerhalb der monotypischen Familie der Choloepodidae aus der Unterordnung der Faultiere (Folivora). Die Faultiere bilden gemeinsam mit den Ameisenbären (Vermilingua) eine engere Verwandtschaftsgruppe, die Zahnarmen (Pilosa). Diese stellen eine Ordnung innerhalb der Überordnung der Nebengelenktiere (Xenarthra) dar, welche wiederum zu einer der vier Hauptlinien der Höheren Säugetiere gehört. Mit Hilfe molekulargenetische Untersuchungen konnte eine Abspaltung der Faultiere von der gemeinsamen Linie mit den Ameisenbären im ausgehenden Paläozän vor etwa 58 Millionen Jahren ermittelt werden. Die heute nächstverwandte Gruppe innerhalb der Faultiere sind die Dreifinger-Faultiere (Bradypus) aus der ebenfalls monotypischen Familie der Bradypodidae.[22][23]
Ursprünglich hielt man die Zwei- und Dreifinger-Faultiere für eng miteinander verwandt und verwies beide in die Familie der Bradypodidae, wobei diese den ausgestorbenen bodenbewohnenden Faultieren gegenüberstand.[24][5] Allerdings beruhen die äußerlichen Ähnlichkeiten weitgehend auf konvergenter Evolution wie spätere skelettanatomische Untersuchungen zeigten. In der Folgezeit favorisierten viele Wissenschaftler eine nähere Verwandtschaft der Zweifinger-Faultiere mit den bodenbewohnenden Faultieren aus der Familie der Megalonychidae, wofür unter anderm der vergrößerte und eckzahnartig gestaltete vorderste Zahn, die Struktur des Jochbeins und das Fehlen einer verknöcherten Paukenblase am Mittelohr sprachen. Für die Dreifinger-Faultiere wurde dagegen ein Schwestergruppenverhältnis zu allen anderen Faultieren angenommen.[25][3][21] Mit dem Aufkommen molekulargenetischer Analysemethoden zeigte sich die zeitliche Kluft, die die Zwei- und Dreifinger-Faultiere aus stammesgeschichtlicher Sicht deutlich trennt, da beide Gattungen bereits seit dem Oligozän vor rund 29 Millionen Jahren eigene Entwicklungslinien formten.[22][23]

In der klassischen Sichtweise wurden die Megalonychidae als sehr formenreiche Gruppe erachtet, die sich sowohl aus großen Bodenfaultieren Süd- und Nordamerikas als auch den Vertretern der Westindischen Inseln zusammensetzten. Die Zweifinger-Faultiere sollten dabei vor allem mit letzteren näher verwandt sein, unter anderem kamen Neocnus und Acratocnus in Frage.[25] Die Verwandtschaftsverhältnisse der Zweifinger-Faultieren zu den Megalonychidae blieben jedoch weitgehend ungeklärt, da die stark modifizierte Anatomie der heutigen Baumfaultiere, die sich aus der speziellen Lebensweise entwickelte, Vergleiche erschwerte. Zudem liegen von den Zweifinger-Faultieren keine Fossilnachweise vor, womit Übergangsformen unbekannt sind.[26] Umfangreiche molekulargenetische Untersuchungen und Proteinanalysen an den rezenten und fossilen Faultieren aus dem Jahr 2019 widersprachen der gängigen Meinung der Verwandtschaftsverhältnisse einerseits der rezenten Baumfaultiere, andererseits auch der Megalonychidae allgemein. Letztere erwiesen sich als polyphyletisch bestehend aus drei Linien: die Zweifinger-Faultieren, die großen Bodenfaultiere des kontinentalen amerikanischen Festlandes und die kleineren Faultiere der Westindischen Inseln. Für die Zweifinger-Faultiere ergibt sich eine engere Beziehung zu den ausgestorbenen Mylodontidae und Scelidotheriidae, die gemeinsam die Überfamilie der Mylodontoidea formen. Die Bodenfaultiere Nord- und Südamerikas gruppieren sich mit den Megatheriidae und den Nothrotheriidae, ein Verwandtschaftsverhältnis, das schon vorher angenommen wurde und in der Überfamilie der Megatherioidea vereint wird. Hierin stehen auch die Dreifinger-Faultiere. Die karibischen Faultiere wiederum bilden eine eigenständige Überfamilie, die Megalocnoidea.[20][19]
Die Zweifinger-Faultiere werden in zwei rezente Arten unterteilt:[3]
- Eigentliches Zweifingerfaultier oder Unau (Choloepus didactylus (Linnaeus, 1758))
- Hoffmann-Zweifingerfaultier (Choloepus hoffmanni Peters, 1858)
Laut den vorliegenden genetischen Untersuchungen bildeten sich die beiden Linien im Oberen Miozän vor etwa 9 Millionen Jahren heraus.[23][27] Eine Untersuchung aus dem Jahr 2018 zeigte auf, dass diese im Bereich des nordwestlichen Amazonasbeckens nicht vollständig getrennt sind. Ob dies auf Hybridisierung, auf einen nicht differenzierbaren Phänotyp innerhalb der Zweifinger-Faultiere oder auf ungenügende Informationen zur Verbreitung der zwei Arten zurückzuführen ist, kann momentan aufgrund der zu geringen Datenlage nicht gesagt werden.[27] In menschlicher Gefangenschaft treten gelegentlich Hybridformen auf.[28]
Die Erstbeschreibung der Gattung Choloepus erfolgte im Jahr 1811 durch Johann Karl Wilhelm Illiger, wobei er die Typusart, das Eigentliche Zweifingerfaultier, als Bradypus didactylus ansprach, ein Name, den Linnaeus bereits 1758 benutzt hatte. Dies wurde erst 1827 von John Edward Gray geändert, der aber fälschlicherweise die Bezeichnung Chaelopus verwendete.[3] Nach Linnaeus lag die Typuslokalität des Eigentlichen Zweifingerfaultiers in Zeylona (das heutige Sri Lanka), erst 1911 wurde von Oldfield Thomas Suriname als eigentliche Typuslokalität festgelegt.[29] Der Gattungsname Choloepus stammt aus der griechischen Sprache und leitet sich von χωλός (cholos „lahm“) und πούς (poús „Fuß“) her, er bezieht sich somit auf die langsamen Bewegungen der Tiere.[1][2] Die Bezeichnung Choloepus als Basis für die Benennung einer höheren taxonomischen Einheit nutzte erstmals John Edward Gray im Jahr 1871. Er definierte die Tribus der Choloepodini (als „Choloepina“) und trennte damit auch formal die Zwei- und Dreifinger-Faultiere auf Tribus-Ebene.[30] Eine heute korrekte Schreibweise geht auf Theodore Gill zurück, der 1872 die Choloepodinae als Unterfamilie führte.[31]
Bedrohung
Als Bewohner der Regenwälder leiden Zweifinger-Faultiere an deren Abholzung und dem damit verbundenen Verlust ihres Lebensraumes. Einen weiteren Anteil der Bedrohung macht zusätzlich die Jagd aus, zum Teil für Nahrungszwecke, allerdings auch für den Verkauf als Heimtiere. Aufgrund des weiten Verbreitungsgebietes gelten beide Arten laut IUCN als „nicht gefährdet“ („least concern“). Im Gegensatz zu Dreifinger-Faultieren werden Zweifinger-Faultiere häufiger in zoologischen Einrichtungen gehalten.[12]
Literatur
- Nadia Moraes-Barros: Megalonychidae (Two-toed sloths). In: Don E. Wilson, Russell A. Mittermeier (Hrsg.): Handbook of the Mammals of the World. Volume 8: Insectivores, Sloths and Colugos. Lynx Edicions, Barcelona 2018, S. 104–117 ISBN 978-84-16728-08-4.
- Ronald Nowak: Walker’s Mammals of the World. Johns Hopkins University Press, Baltimore 1999, ISBN 0-8018-5789-9.
Einzelnachweise
- Virginia Hayssen: Choloepus hoffmanni (Pilosa: Megalonychidae). In: Mammalian Species. 43 (1), 2011, S. 37–55.
- Peter J. Adam: Choloepus didactyla. In: Mammalian Species. 621, 1999, S. 1–8.
- Alfred L. Gardner, Virginia L. Naples: Family Megalonychidae P. Gervais, 1855. In: Alfred L. Gardner (Hrsg.): Mammals of South America. Volume 1: Marsupials, Xenarthrans, Shrews, and Bats. University of Chicago Press, 2008, ISBN 978-0-226-28240-4, S. 165–168.
- Nadia Moraes-Barros: Megalonychidae (Two-toed sloths). In: Don E. Wilson, Russell A. Mittermeier (Hrsg.): Handbook of the Mammals of the World. Volume 8: Insectivores, Sloths and Colugos. Lynx Edicions, Barcelona 2018, S. 104–117 ISBN 978-84-16728-08-4.
- Virginia L. Naples: Cranial osteology and function in the tree sloths. Bradypus and Choloepus. In: American Museum Novitates. 2739, 1982, S. 1–21.
- Sergio F. Vizcaíno: The teeth of the “toothless”: novelties and key innovations in the evolution of xenarthrans (Mammalia, Xenarthra). In: Paleobiology. 35 (3), 2009, S. 343–366.
- Lionel Hautier, Vera Weisbecker, Marcelo R. Sánchez-Villagra, Anjali Goswami, Robert J. Asher: Skeletal development in sloths and the evolution of mammalian vertebral patterning. In: PNAS. 107 (44), 2010, S. 18903–18908 (pnas.org).
- Hideki Endo, Osamu Hashimoto, Hajime Taru, Keisuke Sugimura, Shin-ichi Fujiwara, Takuya Itou, Hiroshi Koie, Masato Kitagawa, Takeo Sakai: Comparative Morphological Examinations of the Cervical and Thoracic Vertebrae and Related Spinal Nerves in the Two-Toed Sloth. In: Mammal Study. 38 (3), 2013, S. 217–224.
- John A. Nyakatura, Martin S. Fischer: Functional morphology of the muscular sling at the pectoral girdle in tree sloths: convergent morphological solutions to new functional demands? In: Journal of Anatomy. 219, 2011, S. 360–374.
- D. P. Gilmore, C. P. Da Costa, D. P. F. Duarte: Sloth biology: an update on their physiological ecology, behavior and role as vectors of arthropods and arboviruses. In: Brazilian Journal of Medical and Biological Research. 34 (1), 2001, S. 9–25 (scielo.br).
- Desmond Gilmore, Denia Fittipaldi Duarte, Carlos Peres da Costa: The physiology of two- and three-toed sloth. In: Sergio F. Vizcaíno, W. J. Loughry (Hrsg.): The Biology of the Xenarthra. University Press of Florida, 2008, S. 130–142.
- Mariella Superina, Tinka Plese, Nadia Moraes-Barros, Agustín Manuel Abba: The 2010 Sloth Red List Assessment. In: Edentata. 11 (2), 2010, S. 115–134.
- John A. Nyakatura, Alexander Petrovitch, Martin S. Fischer: Limb kinematics during locomotion in the two-toed sloth (Choloepus didactylus, Xenarthra) and its implications for the evolution of the sloth locomotor apparatus. In: Zoology. 113, 2010, S. 221–234.
- M. Zachariah Peery, Jonathan N. Pauli: The mating system of a ‘lazy’ mammal, Hoffmann’s two-toed sloth. In: Animal Behaviour. 84, 2012, S. 555–562.
- Adriano Garcia Chiarello: Sloth ecology. An overview of field studies. In: Sergio F. Vizcaíno, W. J. Loughry (Hrsg.): The Biology of the Xenarthra. University Press of Florida, 2008, S. 269–280.
- Jonathan N. Pauli, Jorge E. Mendoza, Shawn A. Steffan, Cayelan C. Carey, Paul J. Weimer, M. Zachariah Peery: A syndrome of mutualism reinforces the lifestyle of a sloth. In: Proceedings of the Royal Society. B 281, 2014, S. 20133006, doi:10.1098/rspb.2013.3006.
- Erica Taube, Joël Keravec, Jean-Christophe Vié, Jean-Marc Duplantier: Reproductive biology and postnatal development in sloths, Bradypus and Choloepus: review with original data from the field (French Guiana) and from captivity. In: Mammal Review. 31 (3), 2001, S. 173–188.
- DER SPIEGEL: Trauer um weltweit ältestes Faultier Paula: Das Ende der Gemütlichkeit. (online), abgerufen am 10. August 2020.
- Samantha Presslee, Graham J. Slater, François Pujos, Analía M. Forasiepi, Roman Fischer, Kelly Molloy, Meaghan Mackie, Jesper V. Olsen, Alejandro Kramarz, Matías Taglioretti, Fernando Scaglia, Maximiliano Lezcano, José Luis Lanata, John Southon, Robert Feranec, Jonathan Bloch, Adam Hajduk, Fabiana M. Martin, Rodolfo Salas Gismondi, Marcelo Reguero, Christian de Muizon, Alex Greenwood, Brian T. Chait, Kirsty Penkman, Matthew Collins, Ross D. E. MacPhee: Palaeoproteomics resolves sloth relationships. In: Nature Ecology & Evolution. 3, 2019, S. 1121–1130, doi:10.1038/s41559-019-0909-z.
- Frédéric Delsuc, Melanie Kuch, Gillian C. Gibb, Emil Karpinski, Dirk Hackenberger, Paul Szpak, Jorge G. Martínez, Jim I. Mead, H. Gregory McDonald, Ross D.E. MacPhee, Guillaume Billet, Lionel Hautier, Hendrik N. Poinar: Ancient mitogenomes reveal the evolutionary history and biogeography of sloths. In: Current Biology. 29 (12), 2019, S. 2031–2042, doi:10.1016/j.cub.2019.05.043.
- Luciano Varela, P. Sebastián Tambusso, H. Gregory McDonald und Richard A. Fariña: Phylogeny, Macroevolutionary Trends and Historical Biogeography of Sloths: Insights From a Bayesian Morphological Clock Analysis. In: Systematic Biology. 68 (2), 2019, S. 204–218.
- Frédéric Delsuc, Sergio F Vizcaíno, Emmanuel J. P. Douzery: Influence of Tertiary paleoenvironmental changes on the diversification of South American mammals: a relaxed molecular clock study within xenarthrans. In: BMC Evolutionary Biology. 4 (11), 2004, S. 1–13.
- Gillian C. Gibb, Fabien L. Condamine, Melanie Kuch, Jacob Enk, Nadia Moraes-Barros, Mariella Superina, Hendrik N. Poinar, Frédéric Delsuc: Shotgun Mitogenomics Provides a Reference Phylogenetic Framework and Timescale for Living Xenarthrans. In: Molecular Biology and Evolution. 33 (3), 2015, S. 621–642.
- George Gaylord Simpson: The Principles of Classification and a Classification of Mammals. In: Bulletin of the American Museum of Natural History. 85, 1945, S. 1–350 (S. 72).
- Timothy J. Gaudin: Phylogenetic relationships among sloths (Mammalia, Xenarthra, Tardigrada): the craniodental evidence. In: Zoological Journal of the Linnean Society. 140, 2004, S. 255–305.
- Timothy J. Gaudin: On the Osteology of the Auditory Region and Orbital Wall in the Extinct West Indian Sloth Genus Neocnus Arredondo, 1961 (Placentalia, Xenarthra, Megalonychidae). In: Annals of Carnegie Museum. 80 (1), 2011, S. 5–28.
- Manuel Ruiz-García, Diego Chacón, Tinka Plese, Ingrid Schuler, Joseph Mark Shostell: Mitogenomics phylogenetic relationships of the current sloth’s genera and species (Bradypodidae and Megalonychidae). In: Mitochondrial DNA Part A. 29 (2), 2018, S. 281–299, doi:10.1080/24701394.2016.1275602.
- Cynthia C. Steiner, Marlys L. Houck, Oliver A. Ryder: Species identification and chromosome variation of captive two-toed sloths. In: Zoo Biology. 30 (6), 2011, S. 623–635, doi:10.1002/zoo.20360.
- Oldfield Thomas: The mammals of the tenth edition of Linnaeus; an attempt to fix the types of the genera and the exact bases and localities of the species. In: Proceedings of the Zoological Society of London. 1911, S. 120–158.
- John Edward Gray: Notes on the species of Bradypodidae in the British Museum. In: Proceedings of the Zoological Society of London., 1871, S. 428–449 (online).
- Theodore Gill: Arrangement of the Families of Mammals. Washington 1872, S. 1–98 (S. 24) (online).
Weblinks
- Gefährdungsgrad der einzelnen Arten in der Roten Liste gefährdeter Arten der IUCN.