Säure-Base-Titration
Säure-Base-Titrationen sind maßanalytische Verfahren zur Bestimmung der Stoffmengenkonzentration von Säuren oder Basen in einer Reinstoff-Lösung. Bei Stoffgemischen wird damit die Säurekapazität oder die Basekapazität bestimmt (siehe dazu auch Pufferkapazität).
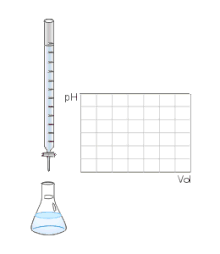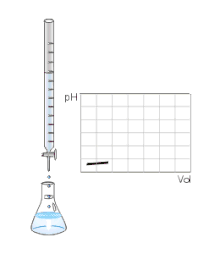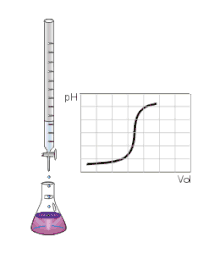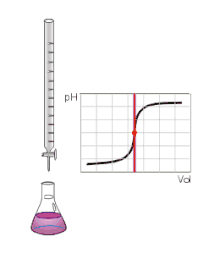
An Stelle des Oberbegriffs Säure-Base-Titration wird die Bestimmung der Stoffmengenkonzentration einer Säure mit Hilfe einer Base auch Alkalimetrie genannt. Analog dazu wird die Bestimmung der Stoffmengenkonzentration einer Base mit Hilfe einer Säure auch als Acidimetrie bezeichnet.[Anmerkung 1]
Die Bestimmung erfolgt durch die dosierte Zugabe (Titration) einer geeigneten Maßlösung aus einer Bürette. Für die Alkalimetrie wird als Maßlösung die basische (alkalische) Lösung einer starken Base (oft 0,1 mol/l Natronlauge) verwendet, für die Acidimetrie die saure Lösung einer starken Säure (oft 0,1 mol/l Salzsäure). Im Verlauf der Titration ändert sich der pH-Wert der Probenlösung durch die ablaufende Neutralisationsreaktion in Richtung des Neutralpunktes, da H3O+ bzw. OH− zu H2O umgesetzt werden. Der Endpunkt der Titration, der je nach Art der zu bestimmenden Säure oder Base durch eine mehr oder weniger starke Änderung des pH-Wertes gekennzeichnet ist, wird als Äquivalenzpunkt bezeichnet. Der Äquivalenzpunkt kann durch den Farbumschlag eines geeigneten Indikators angezeigt werden, wenn sich bei der Titration der pH-Wert am Äquivalenzpunkt stark oder sogar sprunghaft ändert. Wenn das nicht der Fall ist, kann der Äquivalenzpunkt auch durch die Verwendung einer pH-Elektrode und graphische Auswertung der erhaltenen Titrationskurve ermittelt werden. Der am Äquivalenzpunkt herrschende pH-Wert ist abhängig von den bei der Titration gebildeten Anionen (und Kationen). Wenn starke Säuren (z. B. HCl, HNO3, H2SO4) oder Basen (z. B. NaOH, KOH) titriert wurden, dann liegen am Äquivalenzpunkt nur die Anionen von starken Säuren vor und der Äquivalenzpunkt liegt bei pH = 7. Wenn schwache Säuren titriert wurden, sind am Äquivalenzpunkt andere Anionen vorhanden (z. B. Phosphat, Carbonat, Acetat) und die Äquivalenzpunkte liegen in höheren pH-Bereichen. Wenn bei solchen Titrationen ein Farbindikator verwendet wird, muss zur Anzeige des Äquivalenzpunktes der passende Indikator gewählt werden, der erst bei höheren pH-Werten seinen Farbumschlag zeigt. Wenn mehrprotonige schwache Säuren (z. B. H3PO4) titriert werden, sind auch mehrere Äquivalenzpunkte bei jeweils unterschiedlichen pH-Werten zu erwarten.[1]
Verlauf von Titrationskurven
| Alkalimetrie |
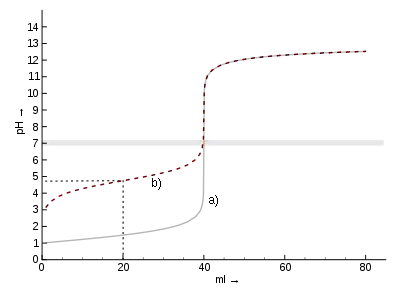 |
| Titrationskurven von a) Salzsäure b) Essigsäure gegen Natronlauge. Halbäquivalenzpunkt von Essigsäure (gestrichelt, bei 20 ml): pH = pKs = 4,75.[Anmerkung 2] |
| Acidimetrie |
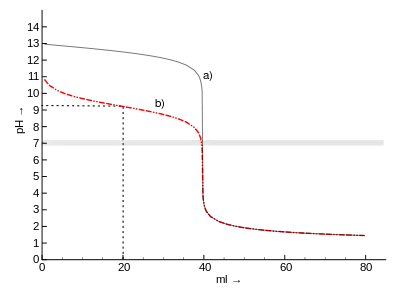 |
| Titrationskurven von a) Natronlauge b) Ammoniak gegen Salzsäure. Halbäquivalenzpunkt von Ammoniak (gestrichelt, bei 20 ml): pH = pKs = 9,25 |
Titrationskurven von wässrigen Lösungen sehr starker Säuren und sehr starker Basen haben alle einen ähnlichen Verlauf. Bei der Reaktion werden Oxonium und Hydroxid quantitativ zu Wasser umgesetzt:
Sie sind die einzigen Protonendonatoren bzw. Protonenakzeptoren in solchen wässrigen Lösungen. Ursache ist die Nivellierung von sehr starken Säuren und Basen. Im Fall von Salzsäure ist Chlorwasserstoff die sehr starke Säure, die (formal oder real) hydrolysiert worden ist:
Im Fall von Natronlauge ist die sehr starke Base Natriumhydroxid, die bei Umsetzung mit Wasser vollständig hydrolysiert wurde:
Messgrößen sind das Volumen der Probelösung, das jeweils zugefügte Volumen an Maßlösung und der jeweilige pH-Wert der Lösung. Im sauren Bereich wird der pH-Wert der Probelösung durch
- bestimmt.
Im basischen Bereich wird der pH-Wert über
- und mit durch
- bestimmt.
Die Autoprotolyse des Wassers
ist in fast allen Bereichen vernachlässigbar gering, bestimmt jedoch den pH-Wert beim Äquivalenzpunkt mit pH = 7 bei 25 °C.
Titrationskurven von wässrigen Lösungen mittelstarker Säuren und mittelstarker Basen zeigen bis zum Äquivalenzpunkt einen anderen Verlauf, da die gelösten Säuren bzw. Basen nicht vollständig hydrolysiert sind. Neben der Umsetzung
erfolgt bei der Alkalimetrie
bzw. bei der Acidimetrie
Die in den beiden letzten Reaktionen als Säure und Base bezeichneten Teilchen sind die jeweiligen konjugierten Säure-Base-Paare, in der oberen Kurve sind es Essigsäure und die Acetat-Ionen, in der unteren Kurve die Ammonium-Ionen und Ammoniak. Die Verläufe der Titrationen lassen sich bei bekannten Konzentration und Volumen der Probelösung und des Titranden rechnerisch abschätzen. Bei der Titration von mittelstarken Säuren bzw. Basen kann (abgesehen von Startpunkt) die Protolyse der Essigsäure bzw. des Ammoniaks mit Wasser vernachlässigt werden und eine quantitative Umsetzung der zu bestimmenden Säure bzw. Base mit OH− bzw. H3O+ angenommen werden. Der pH-Wert der jeweiligen Lösung wird durch die vorliegenden Konzentrationen der Säure-Base-Paare bestimmt und wird durch die Henderson-Hasselbalch-Gleichung
beschrieben. Protonendonator ist im Fall der Bestimmung von Essigsäure die Essigsäure selbst, mit einem pKs-Wert von 4,75 und im Fall der Bestimmung des Ammoniaks das Ammonium-Ion, mit einem pKs-Wert von 9,25. Bei einem 50%igen Umsatz liegen die jeweiligen Protonendonatoren und Akzeptoren in gleicher Konzentration vor und der pH-Wert ist gleich dem jeweiligen pKs-Wert:
Dieser Punkt wird gelegentlich Halbäquivalenzpunkt genannt. Um diesen Punkt herum verläuft die Änderung des pH-Werts im Verlauf der Titration besonders flach, da Pufferlösungen vorliegen. Ab dem Äquivalenzpunkt wird der pH-Verlauf nur noch durch den weiteren Zusatz der Maßlösung bestimmt.
Wahl des Indikators

Der Farbumschlag eines geeigneten Indikators sollte im Bereich des Äquivalenzpunktes (fast senkrechter Verlauf einer Titrationskurve) liegen.
Der Umschlagsbereich von pH-Indikatoren hat im Allgemeinen die Breite von zwei pH-Einheiten. Auch bei den Indikatoren liegt eine Säure-Base-Reaktion vor:
- (siehe z. B. Methylrot)
Die Indikatoren folgen der Henderson-Hasselbalch-Gleichung und auch ein Indikator hat einen pKs-Wert. Wegen ihrer niedrigen Konzentration bleibt jedoch der Verlauf von Titrationskurven durch Indikatoren weitgehend unbeeinflusst.
Da zur Herstellung einer sehr genauen Urtiter-Lösung für Säuremaßlösungen häufig Natriumcarbonat (Wasserfreiheit durch Trocknung im Ofen bei 200 °C) eingesetzt wird, ist Methylorange ein sehr wichtiger Farbindikator zur genauen Einstellung von Säuren.
Für die Titration einer starken Säure mit einer starken Base, wie Salzsäure und Natronlauge, eignet sich der Indikator Bromthymolblau, da seine Farbe etwa bei einem pH-Wert von 6,0 bis 7,6 umschlägt, was im Bereich des Äquivalenzpunkts liegt. Soll dagegen die Konzentration einer mittelstarken Säure wie Essigsäure mit Hilfe von Natronlauge bestimmt werden, so verwendet man zum Beispiel den Indikator Phenolphthalein, dessen Umschlagsbereich von farblos nach rot-lila im pH-Bereich von 8,2 bis 10 liegt. Methylrot, mit einem Umschlagsbereich von pH 4,4 bis 6,2, ist für eine Bestimmung von mittelstarken Basen wie Ammoniak geeignet.
Titration mit einem pH-Meter

Man kann den Endpunkt der Titration auch mit Hilfe eines pH-Meters, also mit einem elektrischen Messgerät bestimmen. Diese Messmethode liefert ein eindeutiges Ergebnis, das nicht von der Erfahrung des Ausführenden abhängt. Der pH-Wert der Probelösung in Abhängigkeit vom Volumen der schrittweise zugegebenen Maßlösung kann in einer Titrationskurve dargestellt und ausgewertet werden.
Da insbesondere die mehrwertigen Säuren sog. Pufferkapazitäten haben, bei denen der pH-Wert relativ lange während der Titration konstant bleibt und der Neutralpunkt ziemlich plötzlich erreicht werden kann, lässt sich dieses Verhalten mit einem pH-Meter besser beobachten. Es entfällt dann natürlich der Einsatz eines Indikators.
Automatische Titration
Eine Weiterentwicklung der Titration mit dem pH-Meter führt dazu, dass nicht nur der pH-Wert elektronisch durch einen Computer erfasst wird, sondern auch die Zugabe der Titrationsflüssigkeit automatisch geregelt werden kann. Ferner kann der an die Titrationsapparatur angeschlossene Computer die Ergebnisse gleich weiterverarbeiten und z. B. in einen Konzentrationswert umrechnen. Damit ist die Titration vollständig automatisierbar.
Anmerkungen
- Die Begriffe Alkalimetrie und Acidimetrie werden in der Literatur uneinheitlich verwendet. Gelegentlich wird unter Alkalimetrie die Bestimmung des Gehalts einer Base und unter Acidimetrie die Bestimmung des Gehalts einer Säure verstanden. Bei anderen Methoden der Titrimetrie sind jedoch die verwendeten Titriermittel namengebend, wie z. B. bei der Iodometrie oder der Manganometrie. Somit ist die oben genannte Definition der beiden Begriffe einheitlich und damit vorteilhaft.
- Berechnete Umsetzungen von 40 ml 0,1-mol/l Lösungen mit 0,1 mol/l Maßlösungen.
Literatur
- G. Jander, K. F. Jahr, G. Schulze: Maßanalyse. 16. Auflage, de Gruyter, Berlin 2003, ISBN 3-11-017098-1.
Weblinks
- T. L. Brown, H. E. Le May: Chemie Ein Lehrbuch für alle Naturwissenschaftler, VCH Verlagsgesellschaft, Weinheim 1988, ISBN 3-527-26241-5, S. 522–525.