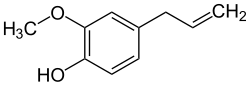
Eugenol
Eugenol ist ein Phenylpropanoid mit einem intensiven Geruch nach Gewürznelken (von der früher Eugenia aromatica genannten Pflanze).
| Strukturformel | ||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
 | ||||||||||||||||||||||
| Allgemeines | ||||||||||||||||||||||
| Name | Eugenol | |||||||||||||||||||||
| Andere Namen | ||||||||||||||||||||||
| Summenformel | C10H12O2 | |||||||||||||||||||||
| Kurzbeschreibung |
gelbe,[2] ölige, intensiv nach Nelken riechende Flüssigkeit[3] | |||||||||||||||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||||||||||||||
| ||||||||||||||||||||||
| Arzneistoffangaben | ||||||||||||||||||||||
| ATC-Code | ||||||||||||||||||||||
| Eigenschaften | ||||||||||||||||||||||
| Molare Masse | 164,20 g·mol−1 | |||||||||||||||||||||
| Aggregatzustand |
flüssig | |||||||||||||||||||||
| Dichte |
1,07 g·cm−3 (20 °C)[2] | |||||||||||||||||||||
| Schmelzpunkt | ||||||||||||||||||||||
| Siedepunkt |
253 °C[3] | |||||||||||||||||||||
| Dampfdruck | ||||||||||||||||||||||
| Löslichkeit |
schlecht in Wasser (2,46 g·l−1 bei 25 °C)[2] | |||||||||||||||||||||
| Brechungsindex |
1,5410[6] | |||||||||||||||||||||
| Sicherheitshinweise | ||||||||||||||||||||||
| ||||||||||||||||||||||
| Toxikologische Daten | ||||||||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. Brechungsindex: Na-D-Linie, 20 °C | ||||||||||||||||||||||
Vorkommen

Eugenol kommt natürlich in Gewürznelkenöl (70–95 %),[8] in Piment- und Pimentblätteröl (60–90 %),[8] in Bayöl[9] (50–60 %) und Zimtölen[8] (Zimtrindenöl: 5–10 %, Zimtblattöl über 90 %) vor. Außerdem findet es sich in Bay,[8] Betelpfeffer,[8] Lorbeer,[8] Majoran,[8] verschiedenen Basilikumarten,[8] Kurkuma,[8] Möhren,[8] Myrrhe,[8] Polei-Minze,[8] Rooibos,[8] Thai-Ingwer,[8] Bananen,[10] Kirsche und Muskat.[8]
Gewinnung und Darstellung
Eugenol wird durch Ausschütteln von Nelkenöl mit 5%iger Kaliumhydroxidlösung gewonnen.
Eigenschaften
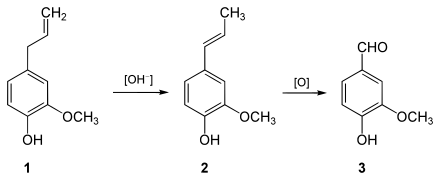
Durch Kaliumpermanganat oder Ozon wird Eugenol (1) (über Isoeugenol, 2) zu Vanillin (3) oxidiert. An der Luft wird es allmählich braun und verharzt.
Analytik
Der zuverlässige qualitative und quantitative Nachweis von Eugenol kann nach hinreichender Probenvorbereitung durch Kopplung der Gaschromatographie oder HPLC mit der Massenspektrometrie erfolgen.[11][12] Auch im Rauch von Wasserpfeifen kann so Eugenol nachgewiesen werden.[13]
Verwendung
Eugenol wird in großen Mengen in der Parfumindustrie für würzige Noten verwendet, insbesondere für Nelkentypen und orientalische Geruchsrichtungen. Eugenol ist neben dem bei der Papierherstellung anfallenden Ligninsulfonat ein Hauptausgangsstoff (Edukt) für die Herstellung von synthetischem Vanillin.
In der Zahnheilkunde dient Eugenol als schmerzstillendes (nur oberflächlich), antibakterielles und entzündungshemmendes Mittel. Es wird zur Prophylaxe von Pulpitis, zur Behandlung der akuten Pulpitis oder der akuten Parodontitis verwendet. Auch in provisorischen Zementen und Füllmaterialien (Zinkoxid-Eugenol-Zement) zusammen mit Eugenolether, Eugenolbenzoat, Eugenolcinnamat, Eugenolacetat kommt Eugenol zur Anwendung.
In der Fischzucht, -forschung und -industrie wird Eugenol unter dem Namen Aqui-S® als Betäubungs- und Beruhigungsmittel verwendet.
In der Landwirtschaft ist Eugenol als Antioxidans und als Keimhemmer zugelassen.[14]
Biologische Bedeutung und Aktivität
Eine phytochemische Datenbank listet 67 Bereiche der biologischen Aktivität von Eugenol auf: Im zoologischen/mikrobiologischen Bereich wirkt es antibakteriell (u. a. gegen Salmonellen und Staphylokokken); antifungal (gegen Candida); gegen Nematoden und Trichomonaden; akarizid (d. h. gegen Milben und Zecken), insektizid und insektifugal, auch larvizid; apifugal (Bienen vertreibend); sowie gegen Termiten.[8] Einige Insektenarten werden von Eugenol angezogen (Euglossa, Maladera).[15]
Beim Menschen wirkt es schmerzstillend und entzündungshemmend. Im Labor hemmt es den Tumornekrosefaktor sowie die Enzyme Thromboxan, COX-1, COX-2 und Cytochrom P450. Es wurden viele weitere Einzelwirkungen festgestellt.[8] Klinische Studien darüber sind unbekannt. Beim Metabolismus des Eugenols entstehen hauptsächlich Phase-II-Konjugate mit Glucuronsäure, Sulfat und Glutathion.[16] Bei der radikalischen Umwandlung kann das schädliche Chinonmethid entstehen.
Ferner kann Eugenol als Anästhetikum für Fische eingesetzt werden.[17] In den 1960er-Jahren fanden acetylierte Eugenolderivate wie Propanidid als Narkosemittel Verwendung.[18]
Toxizität
Eugenol wirkt zytotoxisch[19] und gentoxisch; die gentoxischen Effekte sind abhängig von Aktivierung durch das Enzym Cytochrom P450.[20] Es ist sowohl ein Antioxidans als auch ein Prooxidans; auf Letzterem beruht wahrscheinlich seine (schleim)hautreizende, allergiefördernde Wirkung.[21]
Siehe auch
Einzelnachweise
- Eintrag zu EUGENOL in der CosIng-Datenbank der EU-Kommission, abgerufen am 17. Mai 2020.
- Eintrag zu Eugenol in der GESTIS-Stoffdatenbank des IFA, abgerufen am 10. Januar 2017. (JavaScript erforderlich)
- Eintrag zu Eugenol. In: Römpp Online. Georg Thieme Verlag, abgerufen am 10. November 2014.
- ATC-Klassifikation Deutschland (PDF) DIMDI
- Datenblatt Eugenol (PDF) bei Merck, abgerufen am 19. Februar 2010.
- Patent WO2005074965: Applications of natural and synthetic eugenol and essential oils from cloves, pimentos and cinnamon leaves for the prevention and treatment of animal deseases caused by bacteria, fungi and parasites. Veröffentlicht am 18. August 2005, Erfinder: Vojin Gligovic.
- Eintrag zu Eugenol in der ChemIDplus-Datenbank der United States National Library of Medicine (NLM)
- EUGENOL (engl., PDF) In: Dr. Duke's Phytochemical and Ethnobotanical Database, Hrsg. U.S. Department of Agriculture, abgerufen am 28. Juni 2021.
- J. Abaul, P. Bourgeois, J. M. Bessiere: Chemical composition of the essential oils of chemotypes ofPimenta racemosa var.racemosa (P. Miller) J. W. Moore (Bois d’Inde) of Guadeloupe (F.W.I.). In: Flavour and Fragrance Journal. Band 10, Nr. 5, September 1995, S. 319–321, doi:10.1002/ffj.2730100506.
- R. Tressl, F. Drawert, W. Heimann, R. Emberger: Notizen: Gasehromatographische Bestandsaufnahme von Bananen-Aromastoffen. In: Zeitschrift für Naturforschung B. 24, 1969, S. 781–783 (online).
- M. Iwasa, S. Nakaya, Y. Maki, S. Marumoto, A. Usami, M. Miyazawa: Identification of Aroma-active Compounds in Essential Oil from Uncaria Hook by Gas Chromatography, Mass Spectrometry and Gas Chromatography-Olfactometry. In: J Oleo Sci. 64(8), 2015, S. 825–833. PMID 26179003
- C. Ke, Q. Liu, L. Li, J. Chen, X. Wang, K. Huang: Simultaneous determination of eugenol, isoeugenol and methyleugenol in fish fillet using gas chromatography coupled to tandem mass spectrometry. In: J Chromatogr B Analyt Technol Biomed Life Sci. 1031, 15. Sep 2016, S. 189–194. PMID 27497157
- J. Schubert, A. Luch, T. G. Schulz: Waterpipe smoking: analysis of the aroma profile of flavored waterpipe tobaccos. In: Talanta. 115, 15. Okt 2013, S. 665–674. PMID 24054646
- xeda international: BIOX-C (PDF)
- El-Sayed AM 2005: The Pherobase: Database of Insect Pheromones and Semiochemicals.
- Joint FAO/WHO Expert Committee on Food Additives (JECFA), Monograph für Eugenol and related Hydroxyallylbenzene Derivatives, abgerufen am 15. September 2015.
- Federico Baici: Faire Fische – Betäubungsverfahren im Vergleich. Möglichkeiten zum Nachweis einer erfolgten Kopfschlagbetäubung und Alternativen bei der Narkose von Speisefischen. (Memento vom 5. März 2016 im Internet Archive; PDF; 1,8 MB) 2004, S. 5.
- H. Orth, I. Kis: Schmerzbekämpfung und Narkose. In: Franz Xaver Sailer, Friedrich Wilhelm Gierhake (Hrsg.): Chirurgie historisch gesehen. Anfang – Entwicklung – Differenzierung. Dustri-Verlag, Deisenhofen bei München 1973, ISBN 3-87185-021-7, S. 1–32, hier: S. 17.
- A. Prashar, I. C. Locke, C. S. Evans: Cytotoxicity of clove (Syzygium aromaticum) oil and its major components to human skin cells. In: Cell Prolif. 39 (4), 2006, S. 241–248. PMID 16872360.
- M. C. Munerato, M. Sinigaglia, M. L. Reguly, H. H. de Andrade: Genotoxic effects of eugenol, isoeugenol and safrole in the wing spot test of Drosophila melanogaster. In: Mutation Research, 582 (1-2), 2005, S. 87–94. PMID 15781214.
- T. Atsumi, S. Fujisawa, K. Tonosaki: A comparative study of the antioxidant/prooxidant activities of eugenol and isoeugenol with various concentrations and oxidation conditions. In: Toxicol Vitro., 19 (8), 2005, S. 1025–1033. PMID 15964168.