Ozon-Sauerstoff-Zyklus
Der Ozon-Sauerstoff-Zyklus, auch Chapman-Zyklus, ist der Vorgang, durch welchen Ozon fortwährend in der Ozonschicht erneuert wird, wobei Ultraviolette Strahlung in Wärmeenergie umgewandelt wird. Im Jahr 1930 wurden die beteiligten chemischen Zusammenhänge von Sydney Chapman aufgeklärt.
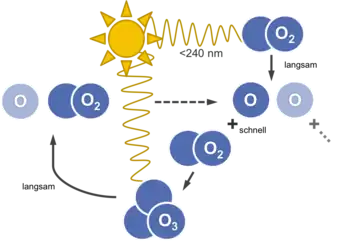
Entstehung von Ozon
Voraussetzung der Entstehung von Ozon ist atomarer Sauerstoff. Dieser kann entstehen, wenn ultraviolettes Sonnenlicht (Wellenlänge kleiner als 240 nm) ein Sauerstoffmolekül (O2) aufspaltet. Diese Atome reagieren häufig mit anderen Sauerstoffmolekülen und bilden Ozon.
Dabei ist M ein sogenannter „dritter Stoßpartner“, ein Molekül (üblicherweise Stickstoff oder Sauerstoff), welches die überschüssige Energie der Reaktion abtransportiert. Ozon entsteht langsam, da das Sonnenlicht keine große Intensität bei Wellenlängen unterhalb 240 nm besitzt.
Welche Funktion Ozon erfüllt
Wenn Ozon in der oberen Atmosphäre mit ultraviolettem Licht in Kontakt kommt, erfolgt rasch eine chemische Reaktion. Das dreiatomige Ozonmolekül wird zu zweiatomigem molekularen Sauerstoff zuzüglich eines freien Sauerstoffatoms:
Freier atomarer Sauerstoff reagiert schnell mit anderen Sauerstoffmolekülen und bildet wiederum Ozon:
Die chemische Energie, die frei wird, wenn O und O2 kombinieren, wird dabei in kinetische Energie der Molekülbewegung umgewandelt. Die gesamtheitliche Wirkung besteht darin, eindringendes ultraviolettes Licht in harmlose Wärme umzuwandeln. Dieser Kreislauf erhält die Ozonschicht in einem stabilen Gleichgewicht, während er gleichzeitig die untere Atmosphäre vor UV-Strahlung schützt, welche für die meisten Lebewesen schädlich ist. Auch ist er eine der zwei bedeutendsten Wärmequellen in der Stratosphäre (die andere beruht auf der kinetischen Energie, die frei wird, wenn O2 zu O-Atomen photolysiert wird).
Wie Ozon zerfällt
Wenn ein Sauerstoffatom und ein Ozonmolekül aufeinandertreffen, rekombinieren sie zu zwei Sauerstoffmolekülen:
Die Gesamtmenge an Ozon in der Stratosphäre wird bestimmt durch ein Gleichgewicht zwischen Produktion durch Sonneneinstrahlung und Zerfall durch Rekombination.
Freie Radikale, deren wichtigste Hydroxyl (OH), Nitroxyl (NO) und Atome des Chlor (Cl) und Brom (Br) sind, katalysieren die Rekombination. Dies reduziert die Ozonmenge in der Stratosphäre.
Die meisten der Hydroxyl- und Nitroxylradikale sind natürlicherweise in der Stratosphäre vorhanden, aber menschliche Einflüsse, insbesondere die Zerfallsprodukte der Fluorchlorkohlenwasserstoffe (FCKW und Halone), haben die Konzentrationen an Chlor- und Bromatomen außerordentlich erhöht, was zur Entstehung des Ozonlochs beiträgt. Jedes Cl oder Br-Atom kann zehntausende von Zerfallsereignissen katalysieren, bevor es aus der Stratosphäre entfernt wird.
Rechnerische Betrachtung
Der Ozon-Sauerstoff-Zyklus lässt sich durch folgende Differentialgleichung beschreiben:
Dabei ist c1 die Konzentration von Ozon und c2 die Konzentration von Sauerstoff. Die Gleichung spiegelt dabei wider, dass die Produktionsrate von Ozon proportional zur Konzentration des Sauerstoffs ist, und die Zerfallsrate (-) proportional zur Konzentration des Ozons selbst. Die Proportionalitätskonstanten haben dabei die Dimension einer Zeit. Sie hängen von den bekannten Einflussfaktoren der beteiligten Reaktionen ab und können sich daher ändern, wenn diese Randbedingungen variieren.
Die Lebensdauer von Ozon hängt insbesondere von der Energiestromdichte der Ozon zerstörenden UV-Strahlung, von der Wahrscheinlichkeit, dass Ozon bei Stoßprozessen zerstört wird (somit von Temperatur und Druck), sowie von der Konzentration zerstörender Radikale ab. Unter Normalbedingungen, d. h. in Abwesenheit konkurrierender Zerfallsprozesse durch Licht oder Radikale, wird die Lebensdauer mit etwa 20 min angegeben, also . Mit den besagten Einflüssen wird die Lebensdauer entsprechend geringer sein.
Ebenso hängt die Zeit von der Energiestromdichte der Ozon erzeugenden UV-Strahlung ab.
Die Lösung obiger Differentialgleichung wird stark vereinfacht dadurch, dass die Konzentration des zweiatomigen Sauerstoffs als konstant angesehen werden kann. Dadurch muss keine entsprechende Differentialgleichung für den Sauerstoff gelöst werden. Ebenso werden die Zeitkonstanten und die entsprechenden Randbedingungen zunächst als konstant angesehen. Die allgemeine Lösung der Differentialgleichung lautet, wie man durch Einsetzen leicht nachprüft:
Die zusätzliche Konstante A legt dabei lediglich die anfängliche Konzentration von Ozon fest. Aus dem Ergebnis kann man nun folgende Schlussfolgerung ableiten. Zunächst ist festzustellen, dass für Zeiten, die viel größer als die Zerfallszeit des Ozons sind, der Exponentialfaktor gegen Null strebt. Der fiktive Endzustand repräsentiert dabei die Gleichgewichtskonzentration des Ozons. Die Zeit für die Einstellung des Gleichgewichts ist also gleich der chemischen Lebensdauer des Ozons, somit also weniger als 20 min. Für den Gleichgewichtszustand gilt ferner nach obiger Gleichung eine einfache Form des Massenwirkungsgesetzes
Daraus lässt sich grundsätzlich erkennen, dass die Gleichgewichtskonzentration von Ozon umso geringer ist, je kürzer seine Lebensdauer ist. Die Gleichgewichtskonzentration des Ozons in der Stratosphäre wird größenordnungsmäßig mit 10 ppm angegeben. Es ist also und damit
Diese Zeitdauer, welche in der Größenordnung von Jahren liegt, ist jedoch nicht zu verwechseln mit der Zeit bis zur Einstellung des Gleichgewichts. Sie repräsentiert umgekehrt vielmehr in etwa die Zeit, die in fiktiver Abwesenheit von Zerfallsprozessen nötig wäre, um den gesamten Sauerstoff in Ozon umzuwandeln.
Bei gleichen Konzentrationen von Ozon und Sauerstoff würde sich die Produktion von Ozon also viel langsamer vollziehen, als die Zerstörung von Ozon, was die unmittelbare Erklärung der geringen Ozonkonzentrationen in der Stratosphäre ist.
Das Gleichgewicht reagiert nach dem Maßstab der natürlichen Zerfallszeit von Ozon (in Dunkelheit) empfindlich auf zusätzliche Zerfallsprozesse durch freie Radikale und UV-Strahlung. In erster Näherung gehen die zusätzlichen Zerfallsprozesse linear in das Zerfallsgesetz und damit die inverse Lebensdauer ein:
Dabei hängt wiederum von der Konzentration der freien Radikale ab und entsprechend von der Intensität der zerstörenden Strahlung. Je mehr freie Radikale bzw. je mehr UV-Strahlung vorhanden ist, desto kürzer ist die entsprechende Lebensdauer.
Auch wenn z. B. die Zerstörung von Ozon durch Radikale 25 mal so lang dauern würde, wie ihr natürlicher Zerfall durch Stöße und Strahlung, käme es dadurch trotzdem schon zu einer 4%igen Verschiebung des Gleichgewichts, also einer 4%igen Verringerung des Ozonanteils. Je mehr freie Radikale in der Stratosphäre vorhanden sind, desto geringer ist daher der Ozongehalt, der sich im Gleichgewicht einstellt.