Kontinuierlich messender Glucosesensor
Kontinuierlich messende Glukosesensoren messen die Gewebeglukosekonzentration im Körper. Die Kontinuierliche Glukosemessung (engl.: Continuous Glucose Monitoring, CGM) wird in der Regel bei Menschen mit Diabetes mellitus eingesetzt, um die Therapie besser steuern zu können. Sie können einerseits die Glukose zusammen mit dem zeitlichen Gradienten (Trend) auf einem Display anzeigen und alle Werte speichern, was derzeit in kommerziellen System mit Nadelsensoren angewandt wird. Sie sind ferner integraler Bestandteil einer möglichen, zukünftig entstehenden, dauerhaft funktionierenden künstlichen Bauchspeicheldrüse, nämlich einer vom Blutzucker über einen Algorithmus geregelten Insulinpumpe. Ein solcher Regelkreis besteht dann grundsätzlich aus einem kontinuierlich messenden Glukosesensor und einem Regler, der eine Insulinpumpe steuert.
Geschichte und Entwicklung
Geschichtlich wurde bereits in den 1960er Jahren ein solcher Enzymsensor[1][2] konzipiert und mittels großer externer Apparate, u. a. Biostator oder Glucostator genannt, in den siebziger Jahren die prinzipielle Machbarkeit eines Regelkreises für die Blutzuckerregulation mittels kontinuierlicher Insulin-Infusion bewiesen. Dennoch dauerte es weitere zwanzig Jahre, bis der erste kommerzielle Sensor am Markt war.
Invasiv applizierte Glukosesensoren
Invasive Sensoren müssen durch die intakte Haut eingeführt werden, die Anwendung ist somit nicht ganz schmerzfrei.
Nadelsensoren
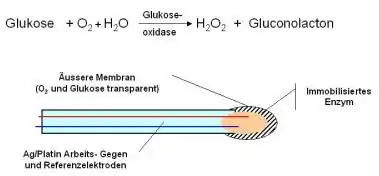
Der am längsten bestehende Typ ist der traditionelle amperometrische Enzymsensor mit immobilisierter Glucose-Oxidase (Abbildung), er ist in mehreren der heute verfügbaren Typen am Markt realisiert. Glukose wird selektiv gemessen durch die enzymatische Umwandlung von Glukose durch das Enzym Glucose-Oxidase (GOD), welches in der Sensorspitze in einem Polymer (z. B. Polyacrylamid) immobilisiert wird oder mit Glutaraldehyd vernetzt wird. In einer elektrochemischen Reaktion wird entweder die Abnahme von Sauerstoff (O2) oder die Bildung von Wasserstoffperoxid H2O2 gemessen. Es wird also eine Oxidation (Elektronen produzierend) an der Arbeitselektrode oder eine Reduktion (Elektronen konsumierend) an der Gegenelektrode stattfinden. Der Vorteil der Peroxid-Elektrode ist die einfache Struktur in der Massenfertigung, der allerdings der Nachteil gegenübersteht, dass H2O2 eine toxische Wirkung auf die GOD wie auch auf die Elektrodenoberfläche hat. Dies führt zu stärkeren Driften und verkürzten Lebensdauern dieser Sensoren. Einen der ersten Nadelsensoren verbanden Shichiri und Kollegen 1983 in Japan mit einem tragbaren künstlichen Pankreas.[3]
Technische Spezifikationen in vitro: Der Messbereich für Glukose beträgt typischerweise 20–400 mg/dl, die Genauigkeit ist bei niedrigen Glukosewerten geringer als bei hohen Werten. Die Sensitivität bei winzigen Nadelsensoren beträgt typischerweise 2 nA/mM (Glukosekonzentration), immer besteht ein Hintergrundstrom. Die Ansprechzeit (Zeit bis zum Erreichen von 63 % des Gleichgewichtsstromes bei Stufenfunktion) beträgt in vitro 1 bis 3 Minuten. Das Signal-Rausch-Verhältnis liegt etwa zwischen 3 und 10. Wegen dieses Rauschens sind Filter notwendig, welche eine weitere Zeitkonstante in die Signalkette einfügen. Eine Drift beruht auf der oxidativen Wirkung von H2O2, welches nicht nur die Glucose-Oxidase zerstört, sondern auch die Elektrodenoberfläche und die Membranen (Biofouling). Daher sind die Drift und die Lebensdauer eines Sensors in vitro stark von der initialen Enzymbeladung abhängig und weiterhin von der Methodik, wie empfindliche Oberflächen vor Peroxid geschützt werden.
Spezifikationen nach Implantation (in vivo): Da zwei Substrate, nämlich O2 und Glukose, vorliegen, sollte Glukose das limitierende Substrat sein. Im Körper liegen aber mit ca. 0,2 mM O2 und 5,5 mM Glucose umgekehrte Konzentrationsverhältnisse vor. Hochentwickelte Polymere als Diffusionsbarrieren kommen diesem Problem näher, wie auch Elektronen-Mediatoren wie Ferrocen. In vivo sind besonders Ansprechzeit, Lebensdauer und Drift von amperometrischen Nadelsensoren von In-vitro-Bedingungen verschieden. Diffusionsvorgänge zwischen Blut und Gewebe induzieren eine Verzögerungszeit für die Glukosekonzentration, die je nach Messmethode zwischen 3 und 10 Minuten angegeben wird. In der Regel führt die Implantation des Nadelsensors zu einer Gewebsreaktion. Zu der In-vitro Drift und zur Lebensdauer des Sensors kommt dadurch eine zusätzliche In-vivo-Komponente hinzu. Durch die Traumatisierung entsteht eine Entzündungsreaktion, gefolgt von einer Wundheilungsreaktion mit der Anreicherung von Proteinen mit anschließender Bildung von Bindegewebe mit wechselnder Durchlässigkeit für Glukose und Sauerstoff. Maßnahmen, dies zu beherrschen, sind biokompatible Oberflächen, eine Begrenzung der Anwendungsdauer und eine Unterbrechung des Messvorgangs während der ersten Stunden der „Wundheilung“ nach Implantation.
Mikrodialyse
Externe Sensoren befinden sich u. a. in Mikrodialyse-Systemen. Hier wird kontinuierlich Flüssigkeit durch eine im subkutanen Unterhautfettgewebe liegende Schleife aus semipermeablen Membranen mit Flussraten von 2,5–10,0 µL/min gepumpt. Diese Flüssigkeit reichert sich mit der dortigen Glukose konzentrationsabhängig an. Ein solches System befand sich in dem von E. F. Pfeiffer († 23. Januar 1997) in Ulm 1994 vorgestellten „Ulmer Zuckeruhr“.[4] Es bestand aus einem tragbaren Mikrodialysesystem mit einem externen Glukosesensor und einer Telemetrieeinrichtung.[5] Es sendete einmal pro Minute ein Signal an den Empfänger in Form einer Armbanduhr. Optische und akustische Alarme konnten bei hohen und tiefen Blutzuckerwerten ausgesendet werden. Es kam jedoch nie zu richtiger Marktreife, da das Gewicht und die Ausmaße, die einem alten Walkman entsprachen, nicht für den Alltagseinsatz geeignet waren. Auch das heute kommerziell verfügbare System Glucoday der Firma Menarini arbeitet nach diesem Prinzip.
Vor- und Nachteile bei Mikrodialysesystemen: Mikrodialysesysteme arbeiten bei Atmosphärendruck, haben also kein Sauerstoff-Defizit-Problem wie Nadelsensoren, bei denen der Sensor im Körper liegt. Daher sind ihr Messbereich größer und ihre Genauigkeit höher als bei Nadelsensoren. Nachteilig ist eine Totzeit, die durch den Transport des Dialysats zwangsläufig entsteht und im Minutenbereich liegt. Ein technischer Nachteil kann in Größe und Störanfälligkeit des Pumpsystems liegen, da sich bewegende Komponenten vorliegen.
Fluoreszenz
Die Glukosemessung kann auch optisch mit Hilfe der Fluoreszenz erfolgen. Hierbei wird ein Molekül durch ein eingestrahltes Photon angeregt und sofort wird ein Photon niedrigerer Energie wieder abgestrahlt. Durch Separierung des eingestrahlten und des (ins Rötliche verschobenen) emittierten Lichtes mittels optischer Filter lassen sich sehr selektive Messungen durchführen.
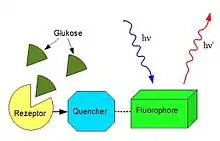
Es existieren allerdings keine bekannten Moleküle im Körper, welche in Verbindung mit Glukose fluoreszieren, sodass fremdes Material von außen in Verbindung mit der glukosehaltigen Körperflüssigkeit gebracht werden muss, ähnlich einem elektrochemischen Sensor (invasive Messung). Über einen Borsäure- oder Concanavalin-A-basierten Glukoserezeptor und einen Quencher lassen sich glukoseabhängige Aussendungen von Licht erzeugen (Abbildung). Die Methodik ist auch im niedrigen (hypoglykämischen) Bereich ausreichend sensitiv. In einer Anwendung (Fa. Glumetrics, USA) wird von einer LED sichtbares Licht über ein Glasfaserbündel von der Dicke eines Drahtes in einen intravenösen Katheter geführt und über den gleichen Weg wird das rotverschobene glukoseabhängige Licht an einen Sensor zurückgeführt. Ein solches System kann in der Intensivmedizin bei der intravenösen Überwachung eine Verwendung finden. Eine andere Anwendung (Fa. Senseonics, USA) benutzt eine 3 mm × 16 mm großes Kapsel, welche unter der Haut in Kontakt mit der Interzellularflüssigkeit gebracht wird. Diese Kapsel enthält die Fluorophore und sendet drahtlos Signale an einen Transmitter. Eine Studie an zwölf Diabetikern über 90 Tage zeigte eine MARD von 11,7 % sowie eine Verzögerungszeit von 7 min.[6] Dieses System wurde zum 52. Kongress der Deutschen Diabetes Gesellschaft auf dem Markt eingeführt.[7]
Nicht-invasive Glucosesensoren
Optische und dielektrische Sensoren
Nicht invasive Sensoren lassen Haut und Schleimhäute bei der Messung intakt und nutzen elektromagnetische Wellen zur Messung. Als möglicherweise geeignet erwiesen sich bisher Licht im nahen Infrarotbereich (Messung durch Absorption), aber auch in anderen Frequenzbereichen (Messung durch Polarimetrie oder Streuung). Mit der Impedanzspektroskopie bei 20–60 MHz wurde von der Schweizer Firma Biovotion AG (ehem. Solianis) ein völlig neues Messverfahren zum Glucosemonitoring eingeführt. Bei Nutzung von mehreren Frequenzen mit diesem Verfahren, eines selbstkalibrierenden Sensors und einem mehrfach Netzwerk künstlicher Intelligenz zum Einlernen der nichtlinearen Korrelationsfunktion „Blutzucker zu Impedanz“, wurde von der Firma TROUT in Kassel ein nicht invasives Blutzuckermesssystem entwickelt. Dieses System ist patentiert; die Funktionen wurden über einen klinischen Test (Anwenderbeobachtung) verifiziert. Bisher hat kein Sensor dieser Art die Marktreife erreicht, auch nicht für Einzelmessungen. Probleme bieten die Genauigkeit, die Selektivität für Glucose und die Störanfälligkeit. Wissenschaftliche Studien hierzu fehlen gänzlich. Bei sogenannten minimal-invasiven Methoden wird die Haut beispielsweise durch winzige Löcher (Laser) nahezu schmerzfrei perforiert, um Gewebswasser zu gewinnen. Von den optischen Methoden zeigte die Ramanspektroskopie über einige Jahre hinweg Erfolgsaussichten, da die Glukose im mittleren Infrarotbereich zwischen 500 und 900 nm einen eindeutigen spektralen „Fingerabdruck“ hinterlässt, welcher sich konzentrationsabhängig zeigt.[8] Auch die photoakustische Spektroskopie im mittleren Infrarotbereich mittels Quantenkaskadenlasers zeigt hier ermutigende Ergebnisse auf dem Labortisch, aber noch kein kommerzielles System.[9] Moderne Laser und selektive Spektrographen sowie die Möglichkeit, komplexe Rechenoperationen des mathematischen Normalisierungs- und Kalibrierungsprozesses zu miniaturisieren, lassen eine vollständig nicht-invasive Form eines Glukosesensors in Zukunft möglich erscheinen.
GlucoWatch Biographer
GlucoWatch Biographer (Animas Corporation, West Chester, PA, USA vormals Cygnus) war ein Echtzeit-Sensor, der im Juli 2007 vom Markt genommen wurde. Er hatte die Größe einer Armbanduhr und beruhte auf dem Messprinzip der „reversen Iontophorese“. Hierbei wurde periodisch ein Gleichstrom unter dem Gerät durch die Haut geleitet, der Gewebsflüssigkeit aus dem Gewebe extrahiert und Gewebsglucose osmotisch mitnimmt. Während des enzymatischen Messvorgangs an den „Wegwerfelektroden“ (über 13 Stunden benutzbar, alle 10 Minuten ein Messwert) erfolgte kein elektrisch induzierter Flüssigkeitsaustausch. Als Nebenwirkung ereigneten sich mäßige Hautreizungen und Rötungen, welche die Tragzeit in der Praxis und während wissenschaftlicher Studien limitierten und für die Compliance bei den Patienten bedeutsam waren. Zwei Studien zeigten keine Verbesserung in der Stoffwechselführung und somit wurde eine Kostenübernahme durch Versicherungen wenig wahrscheinlich (Mitre-Studie,[10] DirecNet Study[11]). Dies führte vermutlich zur Rücknahme vom Markt.
Anwendung bei Menschen mit Diabetes und Effektivität
Verfügbarkeit der Werte
- Dauernde Verfügbarkeit (Push-Prinzip) rtCGM (Real time CGM): des Wertes in der Anzeige. Die permanente Auswertung (engl. signal-processing) erlaubt damit, (1) Alarme für die Unter- bzw. Überschreitung einer vorgegebenen Schwelle auszugeben und (2) Vorhersagen des Glucoseverlaufs zu machen.
- Nachfrage-orientierte Anzeige (Pull-Prinzip) FGM (Flash Glucose Monitoring) oder iscCGM (Intermittent Scanning Continuous Glucose Monitoring), welche entweder durch Download der Werte auf einen Computer erfolgt oder durch Überstreichen (Scannen) und Ablesen des Glucosewertes und des Trends auf einem separaten Gerät mit Display. Hierbei sind keine Alarme realisierbar. Letzteres ist in einem System (siehe Tabelle) realisiert, welches gleichzeitig ohne eine Kalibrierung durch Anwender auskommt.
- Die retrospektive Auswertung des Glucoseverlaufs (bei beiden Prinzipien möglich) nach dem Herunterladen in einen PC (idealerweise mit den Injektionen und Kohlenhydrat-Mengen) z. B. bei der Besprechung mit einem Facharzt nennt man „professionelles kontinuierliches Glucosemonitoring“ (PCGM). Es wird z. T. von Krankenkassen vergütet.
Kommerzielle Systeme
| Firma | Name | Verweil dauer |
Kalibrierung | Mess frequenz |
MARD % | Prinzip | Anmerkung | |
|---|---|---|---|---|---|---|---|---|
| + | Abbott | FreeStyle Libre 2 | 14 Tage | keine | 1 min | 9,5 % | Wired enzyme technology, Nadelsensor | Glucosewerte auslesen durch scannen mit Empfänger oder Smartphone (Flash-Glucose-Monitoring:FGM), Alarme für Hypo- und Hyperglykämie getrennt aktivierbar mit jeweils einstellbarer Schwelle |
| + | Dexcom | G6 Mobile | 10 Tage | keine | 5 min | 9 % | Enzymsensor | Smartphone kompatibel (drahtlos über Bluetooth Low Energy), erlaubt Gebrauch ohne Parallelmessung |
| + | Senseonics | Eversense XL CGM System | 180 Tage | 2 × täglich | 5 min | 9,4 %[12] | Fluoreszenz | Anzeige der Daten über Smartphone-App, verschiedene Alarmfunktionen auch taktil direkt über den Transmitter HWZ Lebensdauer 149 Tage, in Europa durch die Firma Ascensia Diabetes Care vertrieben, Insertion in dafür ausgebildeten Diabeteszentren |
| + | Medtronic | Guardian Sensor 3 | 7 Tage | alle 12 Std. | 5 min | 10,6 % Abdomen
9,1 % (Arm) |
Nadelsensor Elektrochem. GOD | mehrere Alarmfunktion
in Pumpe integrierbar |
| + | Menarini | GlucoMen Day | 14 Tage | 1 × pro Tag | 1 min | n.a. | Nadelsensor, elektochem. | wiederverwendbare Teile |
| − | Animas | GlucoWatch Biographer | 13 Std. | 2× in 48 Std. | 10 min | n.a. | Enzymsensor, inverse Iontophorese | nicht mehr hergestellt |
Anmerkungen:
+ derzeit verfügbar, ggf. auch neuere Modelle
− derzeit nicht verfügbar
MARD (mittlere absolute relative Differenz) = umgekehrtes Maß für Genauigkeit (je kleiner der Wert, desto besser das System, Angabe in %), beruht auf head-to-head Vergleichen[13][14]
Bewertung und Zulassung kommerzieller Systeme
In den Vereinigten Staaten erfolgt die Zulassung zur Markteinführung durch die Food and Drug Administration (FDA). In der Europäischen Union werden Medizinprodukte in der Regel nicht zugelassen, sondern in Verkehr gebracht. 2018 hat die Europäische Agentur für Health Technology Assessment (HTA) EUnetHTA unter Federführung des Ludwig-Boltzmann-Instituts (Österreich) eine auf aktuellen Studien beruhende Bewertung von CGM und FGM herausgegeben, welcher aber keine expliziten Empfehlungen enthält.[15] Sonderzulassungen, z. B. durch das Bundesinstitut für Arzneimittel und Medizinprodukte, sind in Einzelfällen möglich.[16] Erforderlich für das Inverkehrbringen in der Europäischen Union ist eine CE-Kennzeichnung, die angebracht werden darf, wenn die Produkte die grundlegenden Anforderungen erfüllen.[17] In den meisten Fällen wird dies von einer Benannten Stelle geprüft. Deutschland: Die Bewertung, welche zur Kostenübernahme nach § 35 SGB V durch gesetzliche Krankenkassen führt, wird durch den Gemeinsamen Bundesausschuss (G-BA) ausgeübt. Dieser bedient sich einer Nutzenbewertung durch das Institut für Qualität und Wirtschaftlichkeit im Gesundheitswesen (IQWIG), welches durch Analyse von randomisierten Studien über kommerzielle Real-Time CGM-Systeme 2015 einen Bericht abgegeben hat.[18] Die Kostenübernahmen durch die Krankenkassen basierten bis zur unten stehenden Entscheidung des G-BA auf Einzelfall-Entscheidungen, welche sich auf Gutachten des Medizinischen Dienstes der Krankenkassen (MDK) stützen. Der G-BA hat am 16. Juni 2016 in Deutschland dem rtCGM (kontinuierliche interstitielle Glukosemessung mit Real-Time-Messgeräten) zuerkannt, als vertragsärztliche Leistung bei Kindern und Erwachsenen zu Lasten der Krankenkassen erbracht werden zu dürfen.[19] Voraussetzungen dieser am 7. September 2016[20] als Leistung der gesetzlichen Krankenkassen festgesetzten Blutzuckermessung sind u. a.:
- insulinpflichtiger Diabetes mit intensivierter Insulintherapie bzw. Insulinpumpentherapie und einer absolvierten CGM-Schulung
- Verordnung durch Facharzt für Endokrinologie/Diabetologie
- ein individuelles Therapieziel muss mit dem Patienten vereinbart und (im Verlauf) dokumentiert sein
- das verwendete Gerät muss als Medizinprodukt zertifiziert sein
- die Daten müssen auf Wunsch des Nutzers ohne Zugriff Dritter (insbesondere der Hersteller) den behandelnden Ärzten zur Verfügung stehen (Datenschutz)
- Flash Glucose Monitoring (FGM) ist von dieser Entscheidung ausgenommen, da es keine kontinuierliche Gewebezuckermessung ermöglicht und somit auch nicht über Alarmfunktionen verfügt[21]
Schweiz: In der Schweiz sind die kontinuierliche Glukosemessung (CGM) seit 2016 und das FGM (Freestyle Libre, Abbott) seit Juli 2017 auf der Mittel- und Gegenständeliste (MiGeL) des Bundesamtes für Gesundheit enthalten.[22] Gemäß Position 21.05 der MiGeL werden das CGM und das FGM unter folgenden Bedingungen durch die Krankenkasse finanziert:
- HbA1c-Wert gleich oder höher als 8 % und/oder bei schweren Hypoglykämien Grad II oder III oder bei schweren Formen von Brittle-Diabetes mit bereits erfolgter Notfallkonsultation und/oder Hospitalisation
- Verschreibung nur durch Fachärzte für Endokrinologie/Diabetologie, die in der Anwendung der CGM-Technologie ausgebildet sind.
- Bei einer Anwendungsdauer von mehr als sechs Monaten ist auf eine ärztliche Begründung hin eine vorgängige Kostengutsprache des Versicherers erforderlich.
Österreich: In Österreich wird die Kostenübernahme auf Antrag von Endokrinologen/Diabeteszentren für Patienten mit Basis-Bolus-Therapie (> 6 Selbstkontrollen/Tag) gewährt. Darüber entscheidet ein Leitender Arzt der Krankenkasse. Indikationen nach den Leitlinien der Österreichischen Diabetesgesellschaft werden meist anerkannt.[23]
Näheres regeln auch Leitlinien einzelner Länder.
Erprobung am Menschen ohne künstliches Pankreas
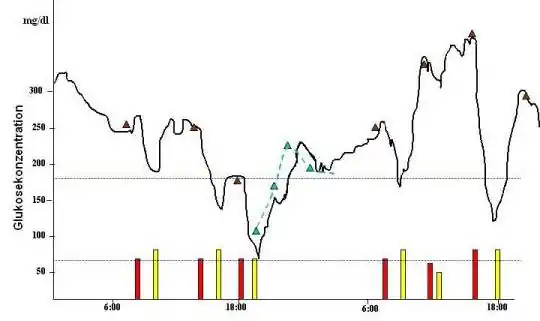
In diesem Fall konnte die Sensormessung retrospektiv aufzeigen, dass der Patient nach den Injektionen, vor allem bei höheren Blutzuckern, zu lange wartet und dadurch gefährliche „Abstürze“ z. T. bis in den hypoglykämischen Bereich induziert. Dies war den Einzelmessung entgangen. Die blau gestrichelten Linien entsprechen den Alarmgrenzen (70 mg/dl und 180 mg/dl).
Zunächst erschienen Anfang dieses Jahrhunderts Glucosesensoren, welche die Gewebsglucose über 72 Stunden aufzeichneten, jedoch dem Benutzer diese nicht in Echtzeit anzeigten. Somit konnten Nutzer und ihre professionellen Berater retrospektiv den Verlauf betrachten und daraus Schlüsse für die zukünftige Therapie ableiten (Abbildung). Es existieren mehrere wissenschaftliche Studien, bei denen einer Gruppe von Sensor-Nutzern eine ähnliche Vergleichsgruppe nach einem zufälligen Auswahlverfahren (randomisierte kontrollierte Studie, RCT) gegenübergestellt wurde. Zielgrößen von solchen Studien sind in der Regel die Qualität der Stoffwechseleinstellung (HbA1c-Wert) als Surrogat-Parameter für Folgekomplikationen und die Anzahl schwerer Hypoglykämien als Gefahr für Leib und Leben und als Kostenfaktor. Eine große, unabhängige Studie aus den USA zeigte bei Jugendlichen und Kindern keine Vorteile dieser Parameter; bei Erwachsenen eine absolute Verbesserung des HbA1c um 0,5 Prozentpunkte.[24] Aus den Daten lässt sich die Vermutung ableiten, dass sich das negative Ergebnis bei jungen Menschen auf eine geringe Tragzeit (= Benutzungszeit) zurückführen lässt, was wiederum Spekulationen über einen hohen Nutzungsaufwand mit dadurch bedingter Einschränkung der Lebensqualität zulässt. Bei motivierten Erwachsenen lassen sich der Sensor in das alltägliche Leben integrieren und das HbA1c senken.[25] Welche Untergruppe besonders profitiert und somit die derzeit noch hohen Kosten rechtfertigt, werden weitere Studien zeigen (siehe auch Glucowatch Biographer oben).
Vermeidung von Unterzuckerungen (Hypoglykämien) mit Echtzeit-Sensoren
Aus der kontinuierlichen Messkurve lässt sich mathematisch bzw. statistisch eine Vorhersage ableiten, ob eine Hypoglykämie eintritt. Eine Alarmfunktion kann in einem solchen Fall den Benutzer warnen und zu einer Kohlenhydrataufnahme („Traubenzucker essen“) auffordern oder zum Beispiel im Schlaf die Insulin-Pumpe abschalten (Basalraten-Unterbrechung). In einer kontrollierten Studie mit 26 Menschen mit Typ-1-Diabetes in zwei Krankenhäusern in USA, die den Freestyle-Navigator von Abbott trugen, ließen sich 84 % der drohenden Hypoglykämien durch Unterbrechung der basalen Insulinzufuhr vermeiden. Hier lag der Vorhersage-Horizont bei etwa 35 min. Allgemein wird ein solches Prädiktions-Werkzeug als Sicherheitskomponente in einem zukünftigen künstlichen Pankreas gesehen. Eine höhere Sicherheit lässt sich durch Verkürzung der Vorwarnzeit erreichen unter Inkaufnahme von mehr falsch positiven Alarmen.[26]
Allgemein gilt: Je länger die Vorwarnzeit gewählt wird, desto mehr Zeit besteht für Korrekturmaßnahmen. Solche Vorwarnzeiten liegen beim Diabetes mellitus meist jenseits von 20 Minuten. Nachteile eines langen Vorhersagehorizontes sind die geringere Sensitivität (eine Hypoglykämie wird richtig vorhergesagt) und die geringere Spezifität (falsch positive Alarme, eine Hypoglykämie wird prognostiziert, obwohl sie gar nicht auftritt). Somit sind Einstellparameter am Sensor vom Patienten vorzugeben, welche seine Präferenzen (Vertrauen in die Vorhersage) abbilden.[27]
siehe auch Prädiktion und Prävention der Hypoglykämie
Erprobung am Menschen mit künstlichem Pankreas
Historisch gesehen entstand die Nachfrage nach einem funktionierenden kontinuierlich messenden Glucosesensor aus der Konzeption eines geschlossenen Regelkreises zur bedarfsgerechten Insulininfusion (künstliches Pankreas).
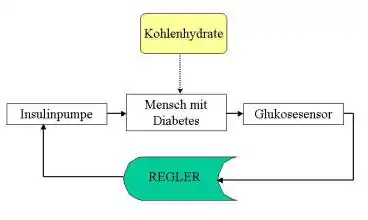
Der Aufbau eines geschlossenen Regelkreises zeigt nebenstehende Abbildung. Eine Insulinpumpe wird über einen Regler gesteuert, welcher in Abhängigkeit von der Abweichung des momentanen Blutzuckerwertes vom Sollwert die Infusionrate für Insulin berechnet.
Regelungstechnisch gesehen sind dabei Zeitverzögerungen im Messsignal (Glucosesensor und Signalfilter) wie auch in der Regelgröße (Insulinabsorption und Wirkverzögerung) problematisch, und zwar je länger diese sind und je niedriger das Signal-Rausch-Verhältnis ist. Optimal wäre daher sowohl eine intravenöse Messung wie auch eine Infusion intravasal (iv-iv-System) oder zumindest in die Bauchhöhle (intraperitoneal).
Wegen hiermit verbundener Probleme ist die Entscheidung zu Gunsten der sicheren aber langsamen subkutan-subkutane Lösung gefallen. Hierbei muss die Verstärkung, insbesondere im differentiellen Anteil des Regelalgorithmus, zurückgenommen werden. Dies hat dazu geführt, dass die allein durch das vom Regler ermittelte Insulin die postprandialen (= nach der Mahlzeit) Blutzucker nicht ausreichend kontrollieren konnte, so dass man derzeit mit halbgeschlossenen Regelkreisen experimentiert, welche 15 Minuten vor der jeweiligen Mahlzeit etwa die Hälfte des Mahlzeiteninsulins als Bolus (Einmalgabe) vorziehen, um dann den Regler „für den Rest sorgen zu lassen“. Als vorläufiges Zwischenziel wird dabei angestrebt, nachts einen Menschen mit einem solchen künstlichen Pankreas hypoglykämie-frei einzustellen und mit einem akzeptablen Blutglucosewert aus der Nacht geleiten zu können.[28]
Verbreitung kommerzieller Systeme
Aus zwei nationalen Registern von Kindern und Jugendlichen unter 18 Jahren aus Deutschland/Österreich (DPV) und USA (T1DX) lässt sich ein Anstieg der Nutzung von rtCGM bzw. FGM zwischen 2011 und 2016 von 3 % auf ca. 16 % ablesen. Einer Schätzung zufolge benutzen 2020 in Deutschland die Flash-Glukosemessung (iscCGM) ca. 370.000 und Kontinuierliche Glukosemessung (rtCGM) ca. 96.000 Menschen.[29] Die mittleren HbA1c-Werte als Qualitäts-Parameter der Stoffwechseleinstellung haben sich in Europa in diesem Zeitraum nur unwesentlich verändert (7,9 % → 7,8 %) und in USA sogar leicht verschlechtert (8,5 % → 8,8 %). Es findet sich in beiden Registern ein Hinweise darauf, dass CGM-/FGM-Nutzer einen besseren mittleren HbA1c-Wert aufweisen (Europa 7,85 % vs. 7,55 %). Es handelt sich bei solchen Registerdaten um Assoziationen ohne kausale Beweiskraft für die Wirkung.[30]
Zukunftsentwicklungen
Letztlich soll eine künstliche Bauchspeicheldrüse kontinuierlich messende Sensoren aufnehmen. Voll implantierbare Sensoren zur subkutanen Messung stehen vor der Markteinführung in Europa.[31] Sensoren, die mit elektromagnetischer Strahlung, insbesondere Licht, die Glucose nicht-invasiv messen konnten, haben es bisher nur kurz vor die Marktreife gebracht. Letztlich fehlte es an der Genauigkeit und Reproduzierbarkeit der Ergebnisse.[32] Auch bei der Messung der Glucose in anderen Kompartimenten des Körpers, z. B. intravenös im Operationssaal oder auf einer Intensivstation, hat es bisher nicht zu einem kommerziellen System gebracht.
Praktische Aspekte
- Die Zulassung bei den meisten CGM-Systemen erlaubt nur die Parallelmessung, therapeutische Entscheidungen müssen dann nach wie vor auf Einzelmessungen mit einem herkömmlichen Blutzuckermessgerät beruhen. Sicherheitsstudien mit neueren Geräten höherer Genauigkeit lassen eine formale Aufhebung der Parallelmessung zu Therapiezwecken zunehmend zu (siehe Tabelle)
- Messungen mit konventionellen Glucosemessgeräten sind bei fast allen kommerziellen Sensortypen auch zu Kalibrierungszwecken mindestens einmal täglich erforderlich. Sie sind die größte Fehlerquelle für falsche kontinuierliche Messergebnisse des Sensors und sollten mit größter Sorgfalt getätigt werden. (Siehe Tabelle)
- Die richtige Anwendung von Sensoren setzt Kenntnisse voraus, die in Schulungen erworben werden können, die Diabeteskliniken und Schwerpunktpraxen anbieten. Teilweise unterstützen auch Dosisempfehlungsprogramme, die auf Echtzeit-Sensormessungen (ggf. auch den Trendpfeilen) beruhen.
- Durch die Latenzzeit zwischen Gewebe und Blut misst der Sensor beim Anstieg des Blutzuckers zwangsläufig einen zu niedrigen Wert und beim Abfall einen zu hohen. Bei annähernd stabilen Werten, ist der Unterschied minimal, die Durchführung einer Kalibrierung ist dann sinnvoll.
Anwendung in der Tiermedizin
Erste Studien zur kontinuierlichen Erfassung des Zuckerspiegels bei Tieren liegen bei Hunden mit Diabetes vor. Die Werte dieser Systeme weichen von den mit klassischen Blutzuckergeräten erhobenen Messdaten ab, eine Einstellung der Insulindosis anhand solcher kontinuierlicher Messungen ist dennoch möglich. Inwieweit damit aber temporäre Unterzuckerungen oder ein Somogyi-Effekt zuverlässig erkannt werden können, muss durch weitere Studien validiert werden.[33]
Einzelnachweise
- S.J. Updike, G.P. Hicks: The enzyme electrode, a miniature chemical tranducer using immobilized enzyme activity. In: Nature 214 (1967), S. 986–988.
- L.C. Clark Jr, C. Lyons: Electrode systems for continuous monitoring in cardiovascular surgery. In: Ann N Y Acad Sci, 1962, 102, S. 29–45, doi:10.1111/j.1749-6632.1962.tb13623.x.
- M. Shichiri et al.: Long-Term Glycemic Control with a portable Artificial Endocrine Pancreas in Pancreatomized Dogs. In: Brunetti et al. (Hrsg.): Artificial Systems for Insulin delivery. 1983, S. 445–455.
- uni-ulm.de, abgerufen am 25. Mai 2017.
- E.F. Pfeiffer: The “Ulm Zucker Uhr System” and its consequences. Horm Metab Res, 1994, 26 (11), S. 510–514.
- X. Wang et al.: Long-Term Home Study on Nocturnal Hypoglycemic Alarms Using a New Fully Implantable Continuous Glucose Monitoring System in Type 1 Diabetes. In: Diabetes Technology Therapeutics, 17, 2015
- Auf dem Weg zu einer neuen Diabetesversorgung. roche.de; abgerufen am 25. Mai 2017
- J. Lipson et al.: Requirements for Calibration in Noninvasive Glucose Monitoring by Raman Spectroscopy. J Diabetes Sci Technol 2009, 3(2), S. 233–241.
- Pleitez et al.: In Vivo Noninvasive Monitoring of Glucose Concentration in Human Epidermis by Mid-Infrared Pulsed Photoacoustic Spectroscopy. Anal. Chem., 2013, 85, S. 1013–1020.
- D. Cook et al.: Randomized controlled trial to assess the impact of continuous glucose monitoring on HbA1c in insulintreated diabetes (MITRE Study). Diabetic Medicine, 26, S. 540–547.
- DirecNet Study Group: A Randomized Multicenter Trial Comparing the GlucoWatch Biographer With Standard Glucose Monitoring in Children With Type 1. In: Diabetes Diabetes Care, Band 28, Heft 5, Mai 2005.
- Senseonics Reports Topline Accuracy Results from U.S. Pivotal Study of Eversense CGM System. Abgerufen am 12. Juli 2018 (englisch).
- E.R. Damiano et al: A Comparative Effectiveness Analysis of Three Continuous Glucose Monitors. The Navigator, G4 Platinum, and Enlite; J. Diab Sci.Tech, 2014.
- M. Christiansen et al.: Accuracy of a Fourth-Generation Subcutaneous Continuous Glucose Sensor. Diabetes Technol. Ther. 2017, S. 446.
- Agency for Quality and Accreditation in Health Care and Social Welfare (AAZ), Main Association of Austrian Social Security Institutions (HVB), The Norwegian Institute of Public Health (NIPHNO). Continuous glucose monitoring (CGM real-time) and flash glucose monitoring (FGM) as personal, standalone systems in patients with diabetes mellitus treated with insulin. Joint Assessment. EUnetHTA, Zagreb 2018. Report No. OTJA08. eunethta.eu, abgerufen am 18. Januar 2019.
- bfarm.de (Memento vom 21. Mai 2017 im Internet Archive), abgerufen am 28. Mai 2017.
- tuev-sued.de, abgerufen am 28. Mai 2017.
- IQWiG-Abschlussbericht D12-01 Kontinuierliche interstitielle Glukosemessung (CGM) mit Real-Time-Messgeräten bei insulinpflichtigem Diabetes mellitus (Memento vom 6. Juli 2015 im Internet Archive)
- Beschluss des Gemeinsamen Bundesausschusses über eine Änderung der Richtlinie Methoden vertragsärztliche Versorgung: Kontinuierliche interstitielle Glukosemessung mit Real-Time-Messgeräten (rtCGM) zur Therapiesteuerung bei Patientinnen und Patienten mit insulinpflichtigem Diabetes mellitus. (PDF; 481 kB) In: g-ba.de. Gemeinsamer Bundesausschuss, 16. Juni 2016, abgerufen am 31. Mai 2017.
- Kontinuierliche interstitielle Glukosemessung. In: KVB Forum, Nr. 12, 2016, S. 192.
- DDG.de Stellungnahme der Deutschen Diabetes Gesellschaft (DDG) und ihrer Arbeitsgemeinschaft für Diabetologische Technologie (AGDT) zu Flash Glucose Monitoring. (PDF) deutsche-diabetes-gesellschaft.de; abgerufen am 25. Mai 2017.
- Mittel und Gegenständeliste (MiGeL) (Memento vom 27. November 2017 im Internet Archive) BAG; abgerufen am 24. November 2017
- Diabetes, Stoffwechsel und Herz 30/5 (2021) S. 340
- JDRF Study Group: Continuous Glucose Monitoring. In: NEJM, 2008
- U. Thurm, B. Gehr: CGM- und Insulinpumpenfibel. 1. Auflage. Kirchheim-Verlag, Mainz 2011, ISBN 978-3-87409-509-9.
- Bruce Buckingham: Prevention of nocturnal hypoglycemia using predictive alarm algorithms and insulin pump suspension. Diabetes Care, 2010, S. 2013.
- Cameron et al.: Statistical hypo prediction. Journal of Diabetes Science and Technology, Volume 2(4), 2008.
- S. A. Weinzimmer et al.: Fully Automated Closed-Loop Insulin Delivery Versus Semiautomated Hybrid Control in Pediatric Patients With Type 1 Diabetes Using an Artificial Pancreas. Diabetes Care, 31, 2008, S. 934–939.
- Jens Kröger, B. Kulzer: Neue Formen des Glukosemonitorings und die Auswirkungen auf Therapie und Schulung in Deutschland; Deutscher Gesundheitsbericht Diabetes 2021. Kirchheim Verlag, 2020, S. 173 ff.
- DeSalvo et al. In: Pediatric Diabetes, 19, 2018, S. 1271–1275. doi:10.1111/pedi.12711.
- D.A. Gough, L.S. Kumosa, T.L. Routh, J.T. Lin, J.Y. Lucisano: Function of an implanted tissue glucose sensor for more than 1 year in animals. Sci Transl Med., 2, 42, 2010.
- A. Ciudin, C. Hernandez, R. Simo: Non-invasive methods of glucose measurement: current status and future perspectives. Curr Diabetes Rev. 8, 2012, S. 48–54.
- Lisa Voigt: Flash Glukosemonitorsystem – eine Alternative zur kapillären Blutzuckermessung. In: Kleintierpraxis, Band 64, Heft 6, 2019, S. 348–358.