Elektrogravimetrie
Elektrogravimetrie ist ein physikalisches Verfahren zur quantitativen Analyse einer Probe und stellt eine spezielle Anwendung der Elektrolyse dar. Die erste Anwendung dieser Analysentechnik geht auf Wolcott Gibbs zurück.[1]
Prinzipien
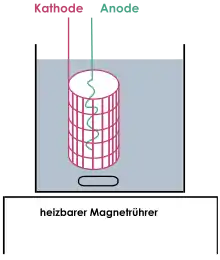
Bei der Elektrogravimetrie wird, wie bei der Gravimetrie, die Konzentration einer Substanz mit Hilfe des Gewichtes gemessen. Dazu muss die gesuchte Substanz zunächst aus der Lösung gefällt werden. Als Fällungsmittel werden bei der Elektrogravimetrie anstelle eines chemischen Hilfsstoffes, wie bei der Gravimetrie, Elektronen eingesetzt. Das zu bestimmende Metall wird auf der Kathode abgeschieden. Zur Mengenermittlung wird die gut mit dest. Wasser gewaschene und später getrocknete Kathode jeweils vor und nach der Elektrolyse genau ausgewogen. Man wählt als Kathode meist ein Platinnetz und als Anode eine Platinspirale.
Chlorid- und besonders Nitrationen können das Analyseergebnis nachteilig beeinflussen. Oxidationen an der Anode sind leicht möglich. Meist werden Elektrolysen daher in schwefelsaurer Lösung durchgeführt.
Sehr wichtig bei der Elektrogravimetrie ist die Kenntnis der Sauerstoffüberspannung an der Anode (siehe Elektrolyse). Je nach Beschaffenheit des Anodenmetalls (Platin oder platiniertes Graphit) und Stromdichte unterscheidet sich auch die Überspannung.
An der Anode wird das Wasser in Sauerstoff und Hydroniumionen zerlegt. Falls die Lösung vorher nicht kräftig sauer (oder basisch) war, kann der pH-Wert im Laufe der Elektrolyse sinken. Dies hat einen wichtigen Einfluss auf die Zersetzungsspannung von Wasser (im Extremfall führt dies zu einer Spannungszunahme von etwa 0,8 V). Die Änderung der Metallionen-Konzentration während der Elektrolyse hat ebenfalls einen kleinen Einfluss auf die gewählte Spannung (bis 0,2 V).
Bei Temperaturen von 50 bis 60 °C kann die Leitfähigkeit (1 °C Temperaturerhöhung steigert die Leitfähigkeit um etwa ein bis zwei Prozent) deutlich verbessert werden, dadurch kann man höhere Stromstärken und eine schnellere Abscheidung realisieren. Auch empfiehlt sich kontinuierliches Rühren, damit die Diffusionsschicht verringert wird. Mitunter empfiehlt sich auch der Einsatz von Depolarisatoren (Reduktions- bzw. Oxidationsmittel wie Hydrazin bzw. Nitrat). Durch Depolarisatoren kann die Wasserstoff- oder Sauerstoffabscheidung unterdrückt werden.
Die anzulegende Spannung kann aus Kenntnis des Normalpotentials berechnet werden. Ob Elemente getrennt werden können, hängt vom Normalpotential der elektrochemischen Spannungsreihe ab. Die Zersetzungsspannungen sollten sich um mindestens 200 mV unterscheiden, damit ein Element vollständig getrennt werden kann. Silber, Kupfer, Nickel, Zink, Blei, Zinn lassen sich beispielsweise voneinander trennen.
Da Silber und Kupfer jedoch häufig bei Anwesenheit von Nitrationen elektrogravimetrisch bestimmt werden, muss in diesem Falle beispielsweise Ethanol (welches an der Anode oxidiert wird) zugesetzt werden. Silber lässt sich (soweit nicht Cyanidionen anwesend sind) mitunter nur in Form eines körnigen Niederschlages, der manchmal von der Elektrode abfällt, gewinnen. Gerade die gravimetrische Bestimmung von Silber und Kupfer sind jedoch sehr beliebt, da bei diesem Potentialbereich keine Abscheidungen anderer Metalle auftreten können.
Bei der Bestimmung von Zink, Nickel und anderen Metallen sollte die Anwesenheit von Nitrat-, Chloridionen vermieden werden (Abrauchen, Trennung durch Anionenaustauscher). Blei wird fast ausschließlich an der Anode als Bleidioxid abgeschieden.
Bei der Abscheidung unedler Metalle sollte die Platin-Elektrode verkupfert werden. Elektrogravimetrische Trennungen können bei konstanter Stromstärke oder bei konstanter Spannung durchgeführt werden. Die Stromdichte sollte zwischen 5 und 50 mA/cm2 liegen. Höhere Stromdichten führen zu unsauberen Schichten mit Fremdeinschlüssen. Hält man die Spannung mittels eines Potentiostaten konstant, so fällt am Ende der Stofftrennung die Stromstärke auf nahezu null.
Beispiel: Nickel(II)-Bestimmung
Die Nickel(II)-haltige Probelösung wird mit einem Ammoniak/Ammoniumnitrat-Puffer auf ca. pH 10 gebracht. Dabei entsteht der Hexaamminnickel(II)-Komplex. Bei Einstellung einer Zersetzungsspannung von ca. 3 V wird an der Platinkathode Nickel(II) elektrochemisch reduziert und festes feinverteiltes Nickel abgeschieden. An der Platinanode bildet sich im Gegenzug Sauerstoff. Da Chlorid an der Anode ebenfalls oxidiert wird (zu Chlor), dürfen allenfalls Spuren vorhanden sein. Ansonsten rauche man vorher mit konz. Salpetersäure ab.
Um die Anzahl der eingesetzten Elektronen, die Ladungsmenge Q, in Beziehung zur gefällten Stoffmenge zu setzen, wird das Faraday-Gesetz verwendet.
wobei:
- die Masse des gefällten Stoffes
- die Molmasse des gefällten Stoffes
- die Ladungsmenge (Stromstärke mal Zeit)
- die Anzahl der pro Formelumsatz übertragenen Elektronen
- die Faraday-Konstante = 96.485 As/mol
Literatur
- Georg Schwedt: Analytische Chemie. Wiley-VCH Verlagsgesellschaft, 2. Auflage, Weinheim 2008, ISBN 978-3-527-31206-1, S. 170 ff.
- A. Schleicher: Elektroanalytische Schnellmethoden. Ferdinand Enke Verlag, Stuttgart 1947
Einzelnachweise
- Georg Schwedt: Analytische Chemie, Wiley-VCH, 2. Auflage 2008, S. 170 ff.