Clark-Elektrode
Die Clark-Elektrode ist ein elektrochemischer Sensor zur Bestimmung des Sauerstoff-Partialdrucks in einer Lösung (oder auch in Gasen). Entwickelt wurde sie 1962 von Leland Clark in Yellow Springs, Ohio.
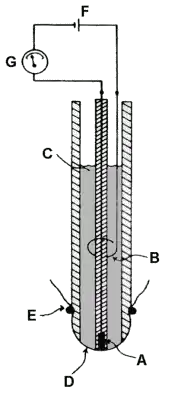
(A) Pt-Kathode (B) Ag/AgCl-Anode (C) KCl-Elektrolyt (D) Teflon-Membran (E) Gummiring
(F) Batterie (G) Galvanometer
Aufbau
Die Clark-Elektrode[1][2] besteht meist aus einer Platin-Kathode und einer Silber-Anode, die über eine Elektrolytlösung in Verbindung stehen. Aber auch andere Kombinationen, wie Gold gegen Silber oder Gold gegen Blei, bilden funktionstüchtige Anordnungen. Vom Messgut sind diese Metallelektroden in der Regel durch eine sauerstoffdurchlässige Membran, meist aus Teflon, getrennt. Es gibt aber auch membranfreie Anordnungen, bei denen das Messgut zugleich als Elektrolyt dient.
Im Fall der Pt/Ag-Kombination liegt an der Platin-Kathode eine Polarisationsspannung von −0,8 V gegen die Silber-Anode an. (Da es ab ca. 1,6 V zur Elektrolyse der verwendeten Elektrolytlösung käme, darf die Polarisationsspannung nicht in dieser Größenordnung liegen). Andere Kombinationen, zum Beispiel diejenigen mit Blei, bedürfen keiner Polarisation.
Taucht man nun die Membran der Messkammer in das Messgut (zum Beispiel in Wasser oder eine arterielle Blutprobe) zur Bestimmung des Sauerstoffgehalts, so diffundiert O2 entsprechend seinem Partialdruck durch die Membran in die Messkammer und wird dort an der Kathode reduziert. Die Kathode gibt Elektronen an den Sauerstoff ab, wobei Hydroxid-Ionen (OH−) entstehen. An der Anode wird zum Beispiel Silber zu Silberionen oxidiert und bei Anwesenheit von Chlorid als unlösliche AgCl-Kruste an die Elektrode angelagert. Die Anlagerungen des oxidierten Anodenmetalls müssen regelmäßig entfernt werden, um die ungehinderte Stromgängigkeit der Messanordnung zu erhalten.
- Kathode: O2 + 2 e− + 2 H2O → H2O2 + 2 OH− und H2O2 + 2 e− → 2 OH−
- Anode: 4 Ag → 4 Ag+ + 4e− und 4 Ag+ + 4Cl− → 4 AgCl
Es ergibt sich somit ein Strom I, der dem Partialdruck p(O2) des Sauerstoffs O2 direkt proportional ist.
- p(O2) ~ I
Bei der weiteren Auswertung dieses resultierenden Messstromes ist zu berücksichtigen, dass sowohl die Diffusionsrate des Sauerstoffs durch die Membran als auch die Sauerstofflöslichkeit im Wasser temperaturabhängig sind.
Anwendungen
Verbreitet ist die Anwendung zu meist in Blutgasanalysatoren auf Intensivstationen für beatmete Patienten oder als Klebeelektroden bei der transcutanen (durch die Haut) Messung von Blutgasen, vor allem bei Neugeborenen.
Kommerziell werden membranbedeckte Clark-Elektroden als Sauerstoffmessgeräte vertrieben. Sie finden Anwendung in der Gewässerüberwachung, in der Aquaristik und in Bioreaktoren. Aber es gibt auch weitere Anwendungen zum Beispiel zur Bestimmung des biochemischen Sauerstoffbedarfs von Abwässern sowie in der Lebensmitteltechnologie.
Literatur
- Peter Schuler: Oxi-Fibel. Einführung in die Gelöstsauerstoff-Meßtechnik. WTW, Wissenschaftlich-technische Werkstätten Weilheim 1987.
Quellen
- Leland C. Clark, Richard Wolf, Donald Granger, Zena Taylor: Continuous recording of blood oxygen tensions by polarography. In: Journal of Applied Physiology. Bd. 10. Nr. 6, ISSN 8750-7587, S. 189–193, PMID 13096460.
- John W. Severinghaus, Poul B. Astrup: History of blood gas analysis. IV. Leland Clark's oxygen electrode. In: Journal of Clinical Monitoring. Bd. 2, Nr. 2, ISSN 0748-1977, S. 125–139, PMID 3519875, doi:10.1007/BF01637680.