Fluoridselektive Elektrode
Die fluoridselektive Elektrode, auch fluoridsensitive Elektrode, Fluoridionenelektrode oder kurz Fluoridelektrode genannt, ist eine Messelektrode, deren Potential von der Konzentration an Fluoridionen (F−) in der Lösung abhängt, in die sie eintaucht. Sie dient als Sensor zur Bestimmung der Konzentration an Fluoridionen. Sie ist eine ionenselektive Elektrode, die zusammen mit einer separaten oder eingebauten Bezugselektrode in die Lösung tauchen muss, damit die Spannung zwischen den Elektroden mit einem geeigneten Messinstrument gemessen werden kann – manche Geräte rechnen die Spannung auch in eine Konzentration um. Eine Fluoridelektrode kann in einem ziemlich weiten Konzentrationsbereich verwendet werden – typischerweise von 1 · 10−6 bis 0,1-molar,[1] mit Anpassungen auch im Bereich bis zu 1 · 10−7 mol/l[2] oder gar 1 · 10−9 mol/l[3] oder bis zur Sättigungsgrenze. Daher ist die Bestimmungsmethode mit der Fluoridelektrode die wichtigste und am häufigsten verwendete für Fluorid.[3][4][5] Sie wird beispielsweise zur direkten Bestimmung von Fluorid im Trinkwasser verwendet, oder zur Bestimmung in Flüssigkeiten wie Plasma, Serum, Speichel oder Milch.
Aufbau
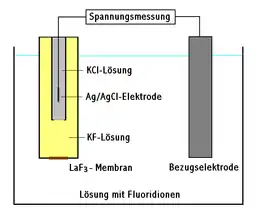
Der wichtigste Teil der fluoridselektiven Elektrode ist eine Membran aus einem festen Fluoridionenleiter, zumeist einem Einkristall aus Lanthanfluorid LaF3, der mit Europiumionen Eu2+ dotiert wurde.
Der gesamte Messaufbau lässt sich durch
- Cu' | Ag,AgCl | KCl || zu messende Lösung | LaF3 | KF,KCl | AgCl,Ag | Cu
beschreiben, wenn eine Silber-Silberchlorid-Bezugselektrode verwendet wird, d. h.
- Cu' | Ag, AgCl | KCl ist die Silber-Silberchlorid-Elektrode.
- KF,KCl | AgCl,Ag | Cu beschreibt die Lösung (1 M KF, ges. KCl, ges. AgCl[6], alternativ z. B. auch 0,1 M NaF und 0,1 M KCl[7]) und die Elektrode innerhalb des Fluoridelektrodengehäuses.
Messung und Konzentrationsabhängigkeit
Genaugenommen misst die Elektrode nicht die Konzentration, sondern die Aktivität der Fluoridionen. Um auch für Proben mit schwankender Ionenstärke verlässliche Messwerte zu erhalten, kann daher vor der Messung eine relativ hohe Ionenstärke eingestellt werden, indem eine spezielle Pufferlösung zugegeben wird (TISAB, total ionic strength adjustment buffer).[3][8] Diese stellt auch sicher, dass der pH-Wert nicht zu hoch ist, da Hydroxidionen die Messung verfälschen können. Außerdem enthält sie Reagenzien, die die dreiwertigen Ionen von Aluminium (Al3+) und Eisen (Fe3+) komplexieren und somit verhindern, dass diese Fluorid binden und so eine kleinere Fluoridkonzentration vortäuschen.
Gemessen wird die Spannung der fluoridselektiven Elektrode gegen eine Referenzelektrode. Sie ist nach der Nernst-Gleichung unter Berücksichtigung der einfach negativen Ladung des Fluoridions gegeben durch
- .
mit
Elektrodenpotential der Fluoridelektrode bzw. Spannung gemessen gegen eine bestimmte Referenzelektrode ° Potential der Fluoridelektrode bzw. Spannung gegen dieselbe Referenzelektrode bei einer Fluoridaktivität von Eins () Universelle oder molare Gaskonstante, R = 8,31447 J mol−1 K−1 = 8,31447 C V mol−1 K−1 absolute Temperatur (=Temperatur in Kelvin) Faraday-Konstante, F = 96485,34 C mol−1 = 96485,34 J V−1mol−1 Aktivität des Fluoridanions, Konzentration des Fluoridanions
Wenn durch Zugabe von TISAB dafür gesorgt wird, dass die Ionenstärke annähernd gleich bleibt, sind die Aktivitätskoeffizienten für verschiedene Proben gleich, und es gilt näherungsweise
mit
- ,
d. h. die gemessene Spannung hängt bei konstanter Ionenstärke, konstantem pH-Wert und konstanter Temperatur linear vom Logarithmus der Fluoridionenkonzentration ab.
Mit dem Wert der Elektrodensteilheit erhält man z. B. bei 25 °C
- .
Historisches
Die Fluoridelektrode wurde 1966 von einem Mitarbeiter der seit 1996 zu Thermo Fisher Scientific gehörenden Firma Orion Research zum Patent eingereicht[6] und danach der Öffentlichkeit vorgestellt.[7] Ebenfalls 1966 wurden Details zur Ionenleitfähigkeit von Lanthanfluorid veröffentlicht, die durch sehr bewegliche Fluoridionen zustande kommt.[9] Im folgenden Jahr wurde die TISAB-Methode der Anpassung der Ionenstärke entwickelt.[8] Spätestens seit 1975 werden fluoridsensitive Elektroden auch bei der Ausbildung von Chemiestudenten verwendet.[10]
Anwendungsbeispiele
Zur Vielzahl der möglichen Anwendungen von Fluoridelektroden zählen z. B. die Fluoridbestimmung in Pflanzenteilen[11] oder in Meerwasser[12] und die Überwachung der Fluoremissionen einer Aluminiumhütte[13]. In Ländern, in denen das Trinkwasser fluoridiert wird, wird die Elektrode zur Online-Überwachung genutzt. Die relativ zuverlässige, schnelle und preiswerte analytische Methode eignet sich auch zur Anwendung in Studentenpraktika.[10][14]
Einzelnachweise
- Method for determining the concentration of Fluoride (F−) in Aqueous Solutions. NICO2000 Ltd, 5. Februar 2015, abgerufen am 12. März 2015.
- Alberto Enrique Villa: Rapid Method for Determining Very Low Fluoride Concentrations Using an Ion-selective Electrode. In: Analyst. Band 113, Nr. 8, August 1988, S. 1299–1303, doi:10.1039/AN9881301299.
- A. D. Campbell: Determination of fluoride in various matrices. In: Pure and Applied Chemistry. Band 59, Nr. 5, S. 695–702,, doi:10.1351/pac198759050695.
- Carolyn A. Tylenda: Toxicological Profile for Fluorides, Hydrogen Fluoride, and Fluorine (Update). Hrsg.: DIANE Publishing. 2011 (cdc.gov [PDF]).
- Jiao, Y., Duan, X.-H.: Recent research progress in the detection of fluoride ion. In: Chinese Journal of Pharmaceutical Biotechnology. Band 21, Nr. 2, 2014, S. 180–184 (Seite nicht mehr abrufbar, Suche in Webarchiven: englische Zusammenfassung mit der Angabe „Ion selective electrode method is currently used most widely.“).
- Patent US3431182: Fluoride Sensitive Electrode and Method of Using Same. Angemeldet am 4. Februar 1966, veröffentlicht am 4. März 1969, Erfinder: Martin S. Frant.
- Martin S. Frant, James W. Ross Jr.: Electrode for Sensing Fluoride Ion Activity in Solution. In: Science. Band 154, Nr. 3756, 23. Dezember 1966, S. 1553–1555, doi:10.1126/science.154.3756.1553.
- Martin S. Frant, James W. Ross Jr: Use of a total ionic strength adjustment buffer for electrode determination of fluoride in water supplies. In: Analytical Chemistry. Band 40, Nr. 7, Juni 1968, S. 1169–1171, doi:10.1021/ac60263a005.
- A. Sher, R. Solomon, K. Lee, M. W. Muller: Transport Properties of LaF3. In: Physical Review. Band 144, Nr. 2, April 1966, S. 593–604, doi:10.1103/PhysRev.144.593.
- Truman S. Light, Carleton C. Cappuccino: Determination of fluoride in toothpaste using an ion-selective electrode. In: Journal of Chemical Education. Band 52, Nr. 4, 1975, S. 247–250, doi:10.1021/ed052p247.
- Alberto Enrique Villa: Rapid method for determining fluoride in vegetation using an ion-selective electrode. In: Analyst. Band 104, Nr. 1239, Juni 1979, S. 545–551, doi:10.1039/AN9790400545.
- Theodore B. Warner: Fluoride in Seawater: Measurement with Lanthanum Fluoride Electrode. In: Science. Band 165, Nr. 3889, 1969, S. 178–180, doi:10.1126/science.165.3889.178.
- Jorge O. Ares: Fluoride Cycling near A Coastal Emission Source. In: Journal of the Air Pollution Control Association. Band 28, Nr. 4, 1978, S. 545–551, doi:10.1080/00022470.1978.10470608.
- Jianjun Zhao: Anwendung einer ionenselektiven Elektrode auf die potentiometrische Bestimmung von Fluorid. (PDF) (Nicht mehr online verfügbar.) In: Department of Chemistry and Biochemistry, Bern, Praktikum fuer physikalische Chemie I, Thermodynamik, Fluorid. Universität Bern, 2006, archiviert vom Original am 2. April 2015; abgerufen am 11. März 2015. Info: Der Archivlink wurde automatisch eingesetzt und noch nicht geprüft. Bitte prüfe Original- und Archivlink gemäß Anleitung und entferne dann diesen Hinweis.
Carla Vogt: Praktikum Grundlagen der Analytik – Versuch 6 – Ionenselektive Elektroden – Potentiometrische Fluoridbestimmung. (PDF) In: Arbeitskreis Analytik – Institut für Anorganische Chemie. Leibniz Universität Hannover, 2006, abgerufen am 11. März 2015.
Fluoridspezifische Elektrode. (PDF) (Nicht mehr online verfügbar.) In: Institut für Analytische Chemie, Analytisch-Chemisches Praktikum (270101 UE), Fluoridelektrode: Teil1. Universität Wien, 2005, archiviert vom Original am 4. März 2016; abgerufen am 11. März 2015. Info: Der Archivlink wurde automatisch eingesetzt und noch nicht geprüft. Bitte prüfe Original- und Archivlink gemäß Anleitung und entferne dann diesen Hinweis.
Nicolas Bings, Thorsten Hoffmann: Praktikum Analytische Chemie – Grundpraktikum Analytische Chemie – AC II - quantitative chemische Analyse – Scriptum für das Sommersemester 2014. (PDF) Johannes Gutenberg-Universität Mainz, 14. August 2014, abgerufen am 11. März 2015.
Hartmut Heinrichs, Albert Günter Herrmann: Praktikum der Analytischen Geochemie. Springer-Verlag, Berlin Heidelberg 1990, ISBN 978-3-642-61286-2, 14.14 F Fluoridelektrode, S. 488–492, doi:10.1007/978-3-642-61286-2_14.