Elektrochemische Kinetik
Die elektrochemische Kinetik beschreibt, wie schnell elektrochemische Prozesse ablaufen und ist damit ein Teilgebiet der Elektrochemie und der Kinetik. Da die Prozesse an den Elektroden mit einem elektrischen Strom und mit einer Spannung zwischen den Elektroden verknüpft sind, sind typische Fragen der elektrochemischen Kinetik: „Wie groß sind die Ströme durch eine elektrochemische Zelle für gegebene Spannungen?“ oder umgekehrt: „Welche Spannung wird für eine bestimmte Stromstärke benötigt?“ Diese Fragen sind z. B. in der Galvanotechnik oder allgemein bei der Elektrolyse relevant. Für galvanische Zellen behandelt die elektrochemische Kinetik analog dazu die Fragen nach der Stromstärke oder der Spannung während des Betriebes einer Batterie (Entladen) bzw. eines Akkumulators (Laden oder Entladen). Die Ruhespannung einer Zelle wird dagegen nicht in der elektrochemischen Kinetik behandelt, sondern von der elektrochemischen Thermodynamik im Rahmen der Nernstgleichung bestimmt.
Zentrale Begriffe und Gleichungen
Wichtige Begriffe der elektrochemischen Kinetik sind die Überspannung, d. h. die Abweichung vom Gleichgewichtspotential, und die Stromdichte j, d. h. die gemessene Stromstärke I geteilt durch die Elektrodenfläche A: j = I/A. Unter dem Ladungsdurchtritt versteht man den Fluss von elektrischer Ladung über die Phasengrenze Elektrode/Elektrolyt hinweg. Dabei werden Elektronen übertragen – etwa aus der Elektrode in den Elektrolyten (dort erfolgt dann eine Reduktionsreaktion) oder umgekehrt aus dem Elektrolyten (in dem mindestens ein Bestandteil oxidiert wird) in die Elektrode. Es können auch Metallionen reduziert werden und als Metallatom an die Elektrode gebunden werden, oder umgekehrt kann ein Metallatom als Ion bei der Oxidation in Lösung gehen.
Die Reaktionsgeschwindigkeit und damit die Stromdichte hängt sowohl vom Ladungsdurchtritt als auch vom Transport der Ladungen in der Lösung ab.
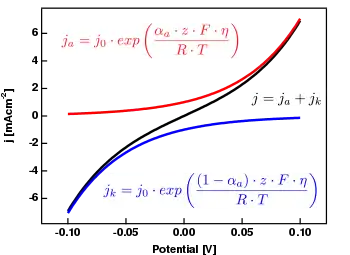
Ein zentrales Ergebnis der elektrochemischen Kinetik ist die Butler-Volmer-Gleichung, die die Abhängigkeit der Stromdichte von der Überspannung beschreibt. Nach ihr hängen die Ströme an einer Elektrode für einen gegebenen Elektrodenprozess exponentiell vom Potential ab, wenn der Ladungsdurchtritt die Stromstärke bestimmt. Für nicht zu kleine Ströme kann statt der Butler-Volmer-Gleichung die näherungsweise gültige Tafel-Gleichung genutzt werden. Zusätzlich zur durch den Ladungsdurchtritt verursachten Überspannung kommen in einer Zelle noch Überspannungen durch die Transportprozesse dazu, die zu einer Konzentrationsüberspannung führen können. Manchmal sind auch chemische Reaktionen, Kristallisations- oder Adsorptionsprozesse geschwindigkeitsbestimmend.
Wie in der chemischen Kinetik können auch viele Reaktionen der elektrochemische Kinetik durch Katalysatoren beeinflusst werden. Man spricht dann von Elektrokatalyse.
Historisches
Julius Tafel veröffentlichte 1905 seine Untersuchung über die Wasserstoffentwicklung.[1] Die Butler-Volmer-Gleichung in der heute bekannten Form wurde zuerst 1930 von Tibor Erdey-Grúz und Max Volmer veröffentlicht. John Alfred Valentine Butler publizierte sie 1932. In diesem Jahr begann auch Alexander Frumkin mit seinen umfangreichen Studien zur elektrochemischen Kinetik.[2] 1952 veröffentlichte er mit „Kinetik von Elektrodenprozessen“ (Кинетика электродных процессов, Kinetika ėlektrodnych processov) das erste Lehrbuch des Fachgebiets. Klaus J. Vetter veröffentlichte 1961 sein Buch „Elektrochemische Kinetik“; es erschien 1967 in übersetzten und erweiterten englischen[3] und russischen Ausgaben. Wolfgang Forker publizierte 1966 (2. bearbeitete Auflage 1989) ein weiteres Buch mit demselben Titel. Mit diesen Monographien erreichte der Ausbau dieses Fachgebiets einen Höhepunkt und einen vorläufigen Abschluss.[4]
Rudolph Marcus veröffentlichte ab 1956[5] seine Theorie der Elektronenübertragung in Lösung und erweiterte diese später auch auf Elektrodenreaktionen. 1965 veröffentlichte er eine vereinheitlichte Theorie beider Fälle.[6] Im Jahr 1992 erhielt er dafür den Nobelpreis für Chemie.[7]
Literatur
- Eine umfassende und immer noch aktuelle Darstellung des Gesamtgebiets ist: Klaus Jürgen Vetter: Elektrochemische Kinetik. 1. Auflage. Springer, Berlin Heidelberg 1961, ISBN 978-3-642-86548-0, doi:10.1007/978-3-642-86547-3 (eingeschränkte Vorschau in der Google-Buchsuche).
- Volkmar M. Schmidt: Elektrochemische Verfahrenstechnik : Grundlagen, Reaktionstechnik, Prozessoptimierung. Wiley-VCH, Weinheim 2003, ISBN 3-527-60214-3, 2.4 Elektrochemische Kinetik, S. 92–134 (eingeschränkte Vorschau in der Google-Buchsuche).
- Wolfgang Forker: Elektrochemische Kinetik. 1. Auflage. Akademie Verlag, Berlin 1966 (176 Seiten. 2. erweiterte Auflage 1989 254 Seiten, ISBN 9783055004865).
- Wolf Vielstich, Wolfgang Schmickler: Elektrochemie II, Kinetik elektrochemischer Systeme (= Rolf Haase [Hrsg.]: Grundzüge der Physikalischen Chemie in Einzeldarstellungen. Band 6). 1. Auflage. Dr. Dietrich Steinkopff, Darmstadt 1976, ISBN 978-3-7985-0447-9, doi:10.1007/978-3-642-95956-1 (eingeschränkte Vorschau in der Google-Buchsuche).
Weblinks
- Elektrochemische Kinetik (Karl-Winnacker-Institut)
- Constanze Donner, Ludwig Pohlmann: Elektrochemische Kinetik (FU Berlin 2010)
Einzelnachweise
- Julius Tafel: Über die Polarisation bei kathodischer Wasserstoffentwicklung. In: Wilhelm Ostwald, J. H. van’t Hoff (Hrsg.): Zeitschrift für Physikalische Chemie, Stöchiometrie und Verwandtschaftslehre. 50U, Nr. 6. Wilhelm Engelmann, 7. Februar 1905, ISSN 2196-7156, S. 641–712, doi:10.1515/zpch-1905-5043 (online im Internet Archive).
- Academician A. N. Frumkin and Modern Advances in Electrochemistry. Abgerufen am 11. September 2018.
- Klaus Jürgen Vetter: Electrochemical Kinetics: Theoretical Aspects. Academic Press, Elsevier Science, Burlington 1967, ISBN 978-1-4832-6639-8 (elsevier.com [abgerufen am 12. September 2018]).
- „Die historische Entwicklung der Elektrochemie“. Abgerufen am 11. September 2018.
- Rudolph Arthur Marcus: On the Theory of Oxidation‐Reduction Reactions Involving Electron Transfer. I. In: American Institute of Physics AIP Publishing (Hrsg.): The Journal of Chemical Physics. Band 24, Nr. 5, Mai 1956, ISSN 0021-9606, S. 966–978, doi:10.1063/1.1742723 (scitation.org).
- Rudolph Arthur Marcus: On the Theory of Electron‐Transfer Reactions. VI. Unified Treatment for Homogeneous and Electrode Reactions. In: American Institute of Physics AIP Publishing (Hrsg.): The Journal of Chemical Physics. Band 43, Nr. 2, 15. Juli 1965, ISSN 0021-9606, S. 679–701, doi:10.1063/1.1696792 (core.ac.uk [PDF]).
- Rudolph A. Marcus: Rudolph A. Marcus - Facts. In: nobelprize.org. Abgerufen am 16. September 2018 (englisch).