Dermatophytose
Die Dermatophytose (Synonym Dermatophytie, von altgriechisch τὸ δέρμα derma, deutsch ‚Haut‘ und altgriechisch φυτόν phyton, deutsch ‚Pflanze‘) oder Tinea (lateinisch für ‚Holzwurm‘, ‚Motte‘) ist eine durch spezielle Pilze (Dermatophyten) hervorgerufene Hautpilzerkrankung. Sie ist beschränkt auf keratinhaltige Gebilde wie die Hornschicht der Haut (Epidermomykose), Haare (Trichophytie oder Trichomykose) oder Nägel bzw. Krallen (Nagelpilz, Onychomykose). Dermatophytosen zählen zu den häufigsten Infektionskrankheiten überhaupt und treten weltweit auf.
| Klassifikation nach ICD-10 | |
|---|---|
| B35 | Dermatophytose (Tinea) |
| B35.0 | Tinea barbae und Tinea capitis |
| B35.1 | Tinea unguium |
| B35.2 | Tinea manuum |
| B35.3 | Tinea pedis |
| B35.4 | Tinea corporis |
| B35.5 | Tinea imbricata |
| B35.6 | Tinea cruris |
| B35.7 | Sonstige Dermatophytosen |
| B35.8 | Dermatophytose, nicht näher bezeichnet |
| ICD-10 online (WHO-Version 2019) | |
Dermatophyten sind an bestimmte Hauptwirte angepasst, bei denen oft keine oder nur geringe Entzündungsreaktionen ausgelöst werden. Erkrankungen bei Hauptwirten verlaufen daher meist milder, aber langwieriger als bei anderen Wirten. Nach der Hauptinfektionsquelle unterscheidet man hauptsächlich vom Menschen (anthropophile) und von Tieren (zoophile) übertragene Erreger. Da auch alle zoophilen Erreger für den Menschen krankheitsauslösend sind, stellen die von ihnen ausgelösten Dermatophytosen von Tieren auf den Menschen übertragbare Erkrankungen (Zoonosen) dar. Pilze, die durch den Kontakt mit Erdboden übertragen werden (geophile), spielen in der Praxis nur eine untergeordnete Rolle.[1][2]
Das klinische Erscheinungsbild ist sehr variabel, meist treten Hautrötung, vermehrte Schuppenbildung und Bläschen auf. Der Erregernachweis ist aufwendig und nur durch Kombination mehrerer Verfahren verlässlich, ohne ihn ist die Diagnose aber nicht sicher zu stellen. Die Behandlung erfolgt meist mit Antimykotika, begleitend sollten hygienische Maßnahmen getroffen werden.
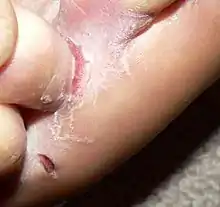
Erreger
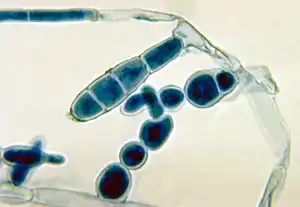
Dermatophyten sind Schlauchpilze (Ascomycota), die verhornte Hautgebilde besiedeln. Man unterscheidet nach der Nebenfruchtform (Anamorphe) etwa 30 Arten, die in die drei Gattungen Epidermophyton, Trichophyton und Microsporum eingeteilt werden. Zur Anzahl krankheitsauslösender Arten gibt es in der Literatur unterschiedliche Angaben, da die Systematik Änderungen unterliegt. Die Hauptfruchtformen (Teleomorphe) dieser Erreger sind Bodenbewohner und werden der Gattung Arthroderma zugeordnet, für einige Dermatophyten sind solche perfekten (geschlechtlichen) Formen aber bislang nicht nachgewiesen. Im Gegensatz zu anderen Pilzen (Hefen, Schimmelpilze) ernähren sich Dermatophyten von Keratin und Kohlenhydraten. Sie können Keratin durch eiweißspaltende Enzyme (Keratinasen) aufschließen.[3]
Dermatophyten sind an bestimmte Hauptwirte angepasst, bei denen nur geringe Entzündungsreaktionen ausgelöst werden, was das Überleben der Pilze sichert. Daher verlaufen solche Infektionen meist milder, aber langwieriger als solche durch nicht-adaptierte Erreger. Die Hauptwirte können sogar symptomlose Träger sein und stellen das Erregerreservoir dar. Sie sind die wichtigste Infektionsquelle für andere Menschen oder Tiere.[2][4]
Nach der Hauptinfektionsquelle unterscheidet man hauptsächlich vom Menschen (anthropophile) und von Tieren (zoophile) übertragene Erreger. Alle zoophilen Pilzarten sind vom Tier auf den Menschen, aber auch von Mensch zu Mensch übertragbar. Sie waren in Deutschland deshalb auch bis 1981 meldepflichtig.[4] Der Anteil der jeweiligen Pilze an Erkrankungen des Menschen variiert. So dominieren beim Fußpilz anthropophile Erreger, bei Dermatophytosen im Bereich des Kopfhaars kommen zoophile Pilze dagegen viermal häufiger vor als anthropophile.[2] Eine Übertragung anthropophiler Erreger auf Tiere ist ebenfalls möglich, wenn auch selten.[5] Obwohl Tiere selten an anthropophilen Dermatophyten erkranken, sind sie ein potentielles Erregerreservoir für einige dieser Erreger.[6] Darüber hinaus gibt es auch Pilze, die durch den Kontakt mit Erdboden übertragen werden (geophile), diese spielen in der Praxis allerdings nur eine untergeordnete Rolle.[1][2]
Die wichtigsten Auslöser für Dermatophytosen sind in Mitteleuropa Trichophyton rubrum (Hauptwirt: Mensch), Trichophyton interdigitale (Hauptwirt: Mensch), Trichophyton verrucosum (Hauptwirt: Rinder) und Microsporum canis (Hauptwirt: Katzen).[2] Hinsichtlich der Erregerhäufigkeit gibt es jedoch historische und geografische Differenzen, die ihre Ursache in den unterschiedlichen Lebensbedingungen haben. So dominierten beim Menschen in Deutschland vor dem Zweiten Weltkrieg noch Microsporum audouinii und Epidermophyton floccosum. In Südeuropa und im Nahen Osten werden die meisten Dermatophytosen beim Menschen von zoophilen Erregern wie Microsporum canis und Trichophyton verrucosum verursacht.[7]
Vorkommen

Dermatophytosen kommen weltweit vor und sind häufige, wenn auch in den allermeisten Fällen nicht lebensbedrohliche Erkrankungen. Sie treten bei Säugetieren, Vögeln und Reptilien auf. Das Risiko, im Verlauf seines Lebens an einer Dermatophytose zu erkranken, beträgt beim Menschen etwa 10–20 %.[8] Damit gehört die Dermatophytose zu den häufigsten Infektionskrankheiten überhaupt.[9] Die Krankheitshäufigkeit (Prävalenz) für den Fußpilz beträgt in Deutschland etwa 30 %,[10] für den Nagelpilz 12,4 %.[11] Die Prävalenz bei Kindern liegt zwischen 5 und 15 %, die Anzahl der jährlichen Neuerkrankungen (Inzidenz) nach einer niederländischen Studie bei etwa 25 pro 1000 Kinder.[12]
Bei Hausrindern sind etwa 40 % der Bestände in Deutschland mit Trichophyton verrucosum infiziert, klinische Erkrankungen (Rindertrichophytie) treten bei 5 bis 60 % der Tiere innerhalb eines Bestandes auf.[13] Während die Rindertrichophytie in Norwegen durch konsequente mehrjährige Impfprogramme nahezu ausgerottet werden konnte (siehe Abschnitt Impfung), sind in Südeuropa nahezu alle Bestände befallen.[14]
Eine Studie an überwiegend hautgesunden Hauskatzen zeigte eine Befallsrate von 21,4 %.[15] Etwa 90 % der Streuner und praktisch alle Tiere in Katzenzuchten sind meist asymptomatische Träger.[16] In einer österreichischen Studie konnten bei 12,4 % der Haushunde Dermatophyten nachgewiesen werden.[17] Zum Vorkommen von Dermatophyten bei Nagetieren und Kaninchen in Heimtierhaltung gibt es kaum epidemiologische Daten. Bei Heimtiermeerschweinchen fand eine Studie aus Belin eine Durchseuchung von 50 bis 90 %.[18] In Laborzuchten wurden Befallshäufigkeiten zwischen 1[19] und 70 %[20] gefunden. Hier dominieren ebenfalls symptomlose Träger, Erkrankungen treten vor allem bei Meerschweinchen auf.[21]
Krankheitsentstehung

Die Ansteckung erfolgt durch direkten oder indirekten Kontakt mit Sporen. Die Pilzsporen sind außerordentlich resistent gegenüber Umwelteinflüssen und bis zu vier Jahre infektiös.[22] Die zoophilen Dermatophyten bilden um das Haar herum (ektotriche) Sporenrasen, so dass pilzbefallene Haare die Hauptansteckungsquelle bilden. Auch eine Übertragung der Sporen durch den Wind und durch Gegenstände (Kämme, Kleidung, Handtücher, Decken, Fußmatten, Teppichböden, …) ist möglich.
Damit es zu einer Pilzerkrankung kommen kann, müssen die Sporen in die Hornschicht, Nägel oder Haare eindringen. Dabei müssen sie die mechanische Barriere, die natürliche Hautflora und das Immunsystem der Haut überwinden. Einige Dermatophyten bilden β-Lactam-Antibiotika und können die den Wirt schützende Hautflora schädigen.[23] Nach Anheftung der Sporen erfolgt ein aktives Eindringen in die Hornsubstanz durch die Bildung Keratin-auflösender Enzyme. Die Fähigkeit zur Bildung verschiedener Enzyme wie Serin-, Aspartat- und Metalloproteasen sowie Hämolysinen ist ein entscheidender Virulenzfaktor von Dermatophyten.[23] Anschließend wachsen aus den Sporen die fadenförmigen Pilzzellen (Hyphen). Entzündungen und mitotisch aktives Gewebe unterbinden die Entwicklung der Hyphen.[2] Haare werden nur in der Wachstumsphase (Anagen) befallen, mit dem Übergang in die Haarerneuerungsphase (Telogen) kommt die Infektion zum Stillstand.[24]
Das Ausmaß einer Dermatophytose ist sowohl von der Anzahl der Sporen und ihrer Virulenz als auch von Wirtsfaktoren wie Abwehrlage und Mikroklima der Haut abhängig. Nach der Virulenz werden obligat pathogene Dermatophyten, die generell krankheitsauslösend wirken, und fakultativ pathogene Dermatophyten, die nur unter begünstigenden Umständen zu einer Erkrankung führen, unterschieden.[23] Alle zoophilen Dermatophyten sind für den Menschen obligat pathogen, die von ihnen verursachten Erkrankungen sind also Zoonosen. Dermatophytosen kommen häufig durch kleinste Hautverletzungen zum Ausbruch. Schwere Dermatophytosen treten nahezu ausschließlich bei Störungen der Abwehr infolge von Immundefekten oder der Verabreichung das Immunsystem unterdrückender Medikamente (Immunsuppressiva) auf. Stress, andere Erkrankungen, Fußfehlstellungen, Durchblutungsstörungen, Hautfalten infolge von Übergewicht, häufiger Chemikalienkontakt und ein feucht-warmes Klima sind begünstigende Faktoren.[23][25]
Keratinozyten bilden bei Kontakt mit Dermatophyten-Antigenen Interleukin-8, was zu einer Einwanderung neutrophiler Granulozyten führt, die einen zellabtötenden (zytotoxischen) Effekt auf Dermatophyten haben.[26] Der Organismus reagiert auf das Eindringen der Sporen mit einer Immunantwort mit Bildung von Antikörpern (IgM und IgG). Die zelluläre Immunantwort vermag die Erkrankung im Regelfall zu stoppen. Diese Immunantwort führt nach Ausheilen der Erkrankung zu einer instabilen Immunität, die den Organismus zwar nicht vor einer erneuten Erkrankung schützt, aber in diesem Fall meist zu einer schnelleren Ausheilung führt. Bei an den Wirt angepassten Hautpilzen ist die Immunreaktion meist schwach, so dass die klinischen Erscheinungen ganz fehlen können oder nur schwach ausgeprägt sind (latente Infektion). Vermutlich sind von den Dermatophyten produzierte Glykoproteine in der Lage, die Immunantwort des Wirts abzuschwächen.[26] Andererseits, vor allem bei nicht-adaptierten Wirten, kann es auch zu einer überschießenden Immunantwort und damit allergischen Reaktionen vom Typ I und IV (→ Einteilung von Allergien) kommen.[2] Allergische Reaktionen auf chronische Dermatophytosen können vermutlich auch zur Entstehung von Asthma bronchiale beitragen.[27] Viele zelluläre und molekulare Details im Ablauf der Abwehrreaktionen auf Dermatophyten sind aber bislang ungeklärt.[26]
Einteilung und klinisches Bild

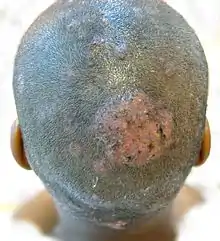
Eine Dermatophytose kann sich auf unterschiedliche Art und Weise manifestieren, was die Diagnosestellung stark erschweren kann. Dermatophyten können die Hornschicht der Oberhaut (Epidermomykose), Haare (Trichophytie oder Trichomykose) und Nägel bzw. Krallen (Nagelpilz, Tinea unguium oder Onychomykose) befallen.
In der Dermatologie werden die Dermatophytosen nach dem Ort ihres Auftretens weiter unterteilt:[28]
- Tinea capitis (von lat. caput ‚Kopf‘), Tinea im Bereich des Kopfhaars, Sonderform: Erbgrind (Favus),
- Tinea faciei (von lat. facies ‚Gesicht‘),
- Tinea barbae (von lat. barba ‚Bart‘),
- Tinea corporis (von lat. corpus ‚Körper‘), Sonderform: Tinea imbricata (von lat. imbricatus ‚dachziegelartig‘),
- Tinea inguinalis (von lat. inguen ‚Leiste‘),
- Tinea manus (von lat. manus ‚Hand‘),
- Tinea cruris (von lat. crus ‚Unterschenkel‘) und
- Tinea pedis (von lat. pes ‚Fuß‘).
Prinzipiell kann weder aus dem Ort des Auftretens noch vom Ausmaß der klinischen Veränderungen ein Rückschluss auf den Erreger gezogen werden, ein Fußpilz kann also durch verschiedene Dermatophyten verursacht werden.[1] In der Tiermedizin ist die Einteilung nach befallener Körperregion nicht üblich. Eine weitere Einteilung der Dermatophytosen ist die nach der Erregergattung (Trichophytie, Microsporie, Epidermophytie), was allerdings nicht aus dem klinischen Bild möglich ist, sondern eine Erregerbestimmung voraussetzt.[29] Auch Kombinationen dieser Einteilungen sind möglich: Die Tinea capitis microsporica ist eine durch Microsporum-Arten verursachte Dermatophytose im Bereich des Kopfhaars.
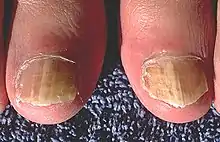
Bei an einen Wirt angepassten Pilzen kommt es meist zu milderen Krankheitserscheinungen wie glanzloses Haar, herdförmiges (fokales) Abbrechen oder Ausfallen der Haare („Ringflechte“, „Ringelflechte“), Rötung, vermehrte Schuppenbildung oder Entzündung des Nagelwalls (Paronychie). Juckreiz ist meist nur gering ausgeprägt. Bei nicht-adaptierten Pilzinfektionen, überschießender Immunantwort, bakteriellen Sekundärinfektionen oder Selbsttraumatisierung (Kratzen, Belecken) können starke Rötung, Bläschen und Plaques, Eiterbläschen, Pseudomycetome oder geschwürige Veränderungen (Kerion) auftreten, die häufig von starkem Juckreiz begleitet sind. Bei einem Nagelpilz tritt meist ein bröckliges, gelb-bräunlich verfärbtes Horn auf.[2] Sehr selten kann durch eine bakterielle Sekundärinfektion eine lebensbedrohliche Wundrose entstehen.[30]
Gelegentlich kann es als Überempfindlichkeitsreaktion auf einen Hautpilz zu einer juckenden Hautreaktion an einer anderen Stelle kommen, in der selbst keine Dermatophyten nachweisbar sind, einem Dermatophytid.[31]
Differentialdiagnostisch kommen andere Hautpilzerkrankungen, aber auch Schuppenflechte, Intertrigo, bakterielle Hauterkrankungen (vor allem Oberflächenpyodermien), Ekzeme, Lupus erythematodes und bei Hunden auch Demodikose in Betracht.[2][28]
Diagnostik
Die Diagnostik von Dermatophytosen war bisher schwierig und zeitaufwendig. Keines der Nachweisverfahren allein lieferte sichere Ergebnisse. Der molekulare Nachweis von erregerspezifischen Genabschnitten eröffnet die Möglichkeit einer sicheren und zuverlässigen Diagnostik bei Verdacht auf Dermatophytose. Die Kombination verschiedener Methoden war zwingend, als „Goldstandard“ gilt immer noch die Kombination aus Direktnachweis und Pilzkultur.[32]
Direktnachweis des Erregers
Eine einfache und preiswerte Untersuchung ist der Direktnachweis der Erreger im Hornmaterial. Dieses wird hierzu mit einem sterilen Holzspatel oder einer Ringkürette abgekratzt. Bei Hautherden sollte dies aus dem Randbereich der Läsion erfolgen, da nur dort vitale Pilze zu erwarten sind. Bei Verdacht auf Nagelpilz sollte das Hornmaterial möglichst unter dem Nagel gewonnen werden, hierzu bedient man sich ebenfalls einer Ringkürette. Bei einem Pilzbefall der behaarten Haut werden die Haare mit einer Pinzette epiliert, es genügt nicht, sie über der Hautoberfläche abzuschneiden, da die Dermatophyten sich nur im Haarbalg vermehren.[33]
Zur weiteren Untersuchung wird das Hornmaterial auf einem Objektträger mit 15–20%iger Kalilauge (KOH) überschichtet, um die Pilze aus dem Horn herauszulösen. Die Einwirkzeit beträgt etwa eine halbe Stunde, durch vorsichtiges Erwärmen kann der Vorgang beschleunigt werden. Um eine Auskristallisation zu vermeiden, sollte die Probe in einer feuchten Kammer gelagert werden. Unter einem Mikroskop lassen sich die Pilzhyphen und/oder Sporen nachweisen. Gegebenenfalls kann zur Dermatophyten-Anfärbung der Kalilauge Methylenblau zugesetzt werden. Etwas einfacher ist der Nativnachweis mit Fluoreszenzfarbstoffen wie z. B. Acridinorange unter einem Fluoreszenzmikroskop.[33]
Die Untersuchung im Nativmaterial ermöglicht keine Differenzierung des Erregers, auch die Abgrenzung von Schimmelpilzen oder Hefen von Dermatophyten ist schwierig. Zudem können Artefakte die mikroskopische Beurteilung erschweren. Für den Nachweis eines Nagelpilzes ist diese Untersuchung jedoch sicherer als die Pilzkultur.[34] Etwa 15 % der Untersuchungen liefern falsch-negative Befunde.
Der direkte Nachweis von Genabschnitten der Dermatophyten mittels PCR aus Proben ist zuverlässiger für den Nachweis einer Dermatophytose,[35][36] wird allerdings noch nicht in der Routinediagnostik verwendet.[23] Durch die Verfügbarkeit eines vollwertigen In-vitro-Diagnostikums (CE-IVD), für den gleichzeitigen Nachweis von 21 Dermatomykoseerregern in einem multiparameter Ansatz, sind aber zwischenzeitlich alle Voraussetzungen für die Routinediagnostik geschaffen.[37]
Pilzkultur

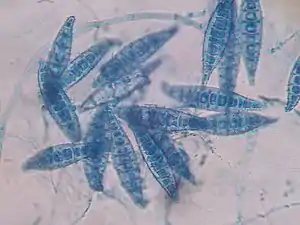
Eine Anzüchtung der Pilze aus Probenmaterial auf einem Nährboden (Pilzkultur) ist bei jedem Dermatophytoseverdacht anzuraten, gleichfalls zur Identifizierung von symptomlosen Trägern wie beispielsweise Tieren im selben Haushalt. Die Probenentnahme erfolgt wie beim Direktnachweis, bei symptomlosen Trägertieren empfiehlt sich die Entnahme von Hautschuppen und Haaren mittels einer weichen Zahnbürste.[2]
Zur Anzüchtung werden hauptsächlich der Kimmig-Agar und der Sabouraud-Dextrose-Agar eingesetzt. Um das Wachstum anderer Krankheitserreger und unspezifischer Mikroorganismen wie Bakterien, Hefen oder Schimmelpilzen zu unterdrücken, werden Hemmstoffe wie Cycloheximid, Gentamicin, Chloramphenicol oder Chlortetracyclin eingesetzt. Das Hornmaterial wird auf den Agar aufgebracht und mindestens zwei bis drei Wochen bebrütet. Erst dann haben sich die Dermatophyten-Kulturen so weit ausgebildet, dass eine Artdifferenzierung möglich ist. Die Bebrütung erfolgt meist bei 28–30 °C, Trichophyton verrucosum wächst bei einer Bebrütungstemperatur von 37 °C am besten. Viele Dermatophyten-Nährmedien haben einen Phenolrot-Zusatz als pH-Wert-Indikator, der infolge basischer Stoffwechselprodukte der Dermatophyten zu einer Rotfärbung des Nährmediums führt. Im Gegensatz zu Schimmelpilzen oder Hefen verwerten Dermatophyten zunächst die Proteine des Nährbodens und erst dann die Kohlenhydrate. Daher ist die Rotfärbung innerhalb der ersten Woche ein Hinweis auf Dermatophyten, während sie in der späteren Bebrütungsphase auch bei Schimmelpilzen und Hefen auftreten kann.[2]
Neben dem Aussehen der Kultur wird auch das mikroskopische Bild beurteilt. Hierzu wird ein Teil der Kultur mit einem Haken oder mit Tesafilm entnommen und auf einen Objektträger mit einer Färbelösung (z. B. Methylenblau) gegeben. Durch die Anordnung der Mikro- und Makrokonidien, der Chlamydosporen und Hyphen kann auf die Art geschlossen werden. Es gibt jedoch Gestaltvariationen (Pleomorphie), die die Artbestimmung erschweren können.
Zu beachten ist, dass bei einer Pilzkultur immer auch falsch-positive und falsch-negative Ergebnisse auftreten können. Die Sensitivität beträgt nur etwa 70 %,[23] also fast ein Drittel der Pilzkulturen liefert ein falsch-negatives Resultat. Bei Nagelpilzproben beträgt die Sensitivität sogar nur etwa 30 %, da hier die Pilze oft in vollständig abgeschlossenen Hohlräumen lokalisiert sind.[38] Daher sind unter Umständen weitere Kulturen auf Spezialnährböden und/oder Funktionstests (Urease-Nachweis, Haarperforationstest) notwendig, die in einem auf Mykologie spezialisierten Labor durchgeführt werden.[23]
Hautbiopsie
Die Stanzbiopsie mit anschließender histologischer Untersuchung ist eine weitere Möglichkeit der Diagnostik. Die Probe sollte stets vom Randgebiet des Herdes entnommen werden. Histologisch dominiert eine überschießende Vermehrung fehlgeformter Hornzellen in der Hornschicht (Parahyperkeratose), darüber hinaus eine Spongiose in der Oberhaut und ein entzündliches Infiltrat in der Lederhaut. Zur besseren Darstellung der Dermatophyten im histologischen Schnitt wird meist die PAS-Reaktion eingesetzt. Die Histologie kann falsch-negative Resultate hervorbringen, wenn die Probe nur wenige oder gar keine Sporen enthält. Wenn dann noch immunologische Überreaktionen gegen die Infektion stattfinden, kann das histopathologische Bild fehlinterpretiert werden.[39]
Wood-Lampe

Die Wood-Lampe – nach dem US-amerikanischen Physiker Robert Williams Wood (1868–1955) – sendet UV-Licht im Bereich von 365 nm Wellenlänge aus. Dies führt bei positivem Befund im abgedunkelten Raum zu einer gelbgrünen Fluoreszenz, die durch Tryptophan-Metabolite der Pilze in Haaren verursacht wird. Bei der Untersuchung von Hautschuppen, Krusten oder Pilzkulturen tritt die Fluoreszenz nicht auf.
Eine Fluoreszenz kommt jedoch nur bei einigen Dermatophytenarten vor: Microsporum canis (hier auch nur bei etwa der Hälfte der Stämme), zum Teil auch bei Microsporum distortum, Microsporum audouinii und Trichophyton schoenleinii. Eine negative Fluoreszenz schließt also eine Dermatophytose keinesfalls aus. Falsch-positive Ergebnisse können durch leuchtende Krusten, Fussel oder Staub entstehen. Auch die Hefe Malassezia furfur (Erreger der Pityriasis versicolor) und Bakterien wie Pseudomonaden können eine Fluoreszenz hervorrufen.[40] Ein weiterer Schwachpunkt dieser Untersuchung ist, dass keine Erregerdifferenzierung und damit auch keine Ermittlung der potentiellen Infektionsquelle möglich ist. Vorteil dieser Methode ist die Möglichkeit, unverzüglich eine Behandlung einleiten zu können. Zuvor sollten jedoch Proben für weitere Untersuchungen entnommen werden, weil durch die eingeleitete Therapie falsch-negative Befunde in der Pilzkultur auftreten können.[2]
Molekulare Diagnostik

Die molekulare Sofortdiagnostik für Dermatophyten aus nativem Material von Patienten mit Verdacht auf Dermatomykose mittels Polymerase-Kettenreaktion (PCR) gewinnt immer stärker an Bedeutung. Die PCR vervielfältigt dabei pathogen-spezifische DNA-Sequenzen, die in sogenannten Markergenbereichen der jeweiligen Dermatomykoseerreger lokalisiert sind und eine artspezifische Unterscheidung zulassen. Die Detektion erfolgt z. B. mittels der Agarose-Gelelektrophorese mit anschließender Geldokumentation. Eine leicht handhabbare, routinefähige und sichere Diagnostik der wichtigsten Dermatomykoseerreger innerhalb weniger Stunden wird somit möglich. Die Vorteile einer solchen Multiparameteranalytik sind u. a. die enorme Zeitersparnis, der daraus resultierende therapeutische Mehrwert, die Zuverlässigkeit der Methodik auch bei Mischproben und die Standardisierbarkeit der objektiven Ergebnisse. Mit der Verfügbarkeit eines zugelassenen In-vitro-Diagnostikums (CE-IVD) für die humane Diagnostik sind alle Voraussetzungen geschaffen, diese Vorteile in der breiten labormedizinischen Routine auszunutzen.
Therapie
Dermatophytosen können bei intaktem Immunsystem spontan, also ohne Behandlung, abheilen, wobei dieser Prozess mehrere Monate in Anspruch nehmen kann. Sie können aber auch chronisch über mehrere Jahre verlaufen. Bei einem Nagelpilz sind Spontanheilungen nahezu ausgeschlossen.[41] Milde Dermatophytose-Formen des Fußes und Körpers können durch benzoe- und salicylsäurehaltige Salben oder Cremes zur schnelleren Abheilung gebracht werden. Diese Wirkstoffkombination wurde 1977 in die Liste der unentbehrlichen Arzneimittel der Weltgesundheitsorganisation aufgenommen.[42]
Beim Erfolg einer Behandlung muss zwischen der klinischen Heilung (Verschwinden der Hautveränderungen) und der mykologischen Heilung (vollständige Elimination des Erregers) unterschieden werden.
Antimykotika
Die Behandlung einer Dermatophytose mit Antimykotika setzt immer eine sichere Diagnose voraus, zumindest sollte ein positives Nativpräparat vorliegen. Antimykotika werden je nach Erkrankungstyp lokal (topisch) und/oder systemisch angewendet. Bei ausgeprägter Entzündung wird gegebenenfalls gleichzeitig ein entzündungshemmendes Glukokortikoid verabreicht.[28]
Für die topische Behandlung mit Salben, Cremes und Lösungen werden vor allem Azole wie Clotrimazol, Bifonazol, Sertaconazol und Miconazol, Pyridone wie Ciclopirox oder Allylamine wie Terbinafin eingesetzt. Während die meisten Wirkstoffe Breitband-Antimykotika darstellen, also auch gegen andere Hautpilze wirken, hat Terbinafin eine selektivere Wirkung gegen Dermatophyten. Die lokale Behandlung eines Nagelpilzes war lange Zeit unbefriedigend, erst neuere Wirkstoffe wie Ciclopirox oder Amorolfin (beide als wirkstoffhaltiger Nagellack) zeigen eine bessere Wirkung. Die Behandlungsdauer ist vom Wirkstoff und der Schwere der Erkrankung abhängig und beträgt zwischen einer Woche und sechs Monaten.[28] Für Tiere sind in Deutschland nur Präparate auf der Basis von Miconazol und Enilconazol zugelassen.[43] Bei Nichtansprechen der Therapie können bei Heimtieren Humanpräparate umgewidmet werden, während bei lebensmittelliefernden Tieren der Einsatz nichtzugelassener Wirkstoffe aus Verbraucherschutzgründen durch die Verordnung (EG) Nr. 470/2009 über Rückstandshöchstmengen pharmakologisch wirksamer Stoffe in Lebensmitteln tierischen Ursprungs strikt untersagt ist. Im angelsächsischen Sprachraum ist bei Haustieren seit einigen Jahrzehnten die lokale Behandlung mit verdünntem Schwefelkalk üblich[44]
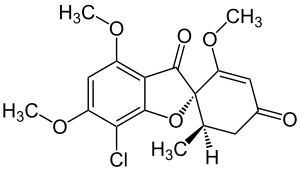
Für die systemische Therapie werden Griseofulvin, Terbinafin, Itraconazol und Fluconazol eingesetzt. Griseofulvin wird vor allem bei Dermatophytosen des Kopfes und des Körpers angewendet und kann bereits bei Kindern nach Vollendung des ersten Lebensjahres eingesetzt werden. Die anderen Wirkstoffe werden vor allem bei einem Nagelpilz verabreicht. Die Behandlungsdauer kann bis zu sechs Monate betragen.[28] Als Tierarzneimittel ist nur Itraconazol zur Anwendung bei der Katze zugelassen.[43]
Chitininhibitoren wie Lufenuron haben keine nachweisbare Wirkung auf Dermatophytosen.[43][45]
Impfung
Die Entwicklung von Impfstoffen aus abgeschwächten Dermatophyten oder Rohantigenfraktionen wurde in der Humanmedizin wegen der Auslösung von Autoimmunerkrankungen eingestellt. Neuere Forschungsansätze sind die Verwendung rekombinant hergestellter Oberflächenantigene von Dermatophyten, die eine spezifische zelluläre Immunantwort auslösen.[43]
Für die Behandlung von Tieren sind in Deutschland mehrere Impfstoffe zur Anwendung bei Rindern, Pferden, Hunden und Katzen zugelassen. Vor allem bei Erstinfektionen und schweren Krankheitsverläufen führt die Impfung bei Katzen zu einer schnelleren klinischen Heilung, bei alleiniger Anwendung aber zu keiner mykologischen Heilung.[46] Bei Pferden[47] und Meerschweinchen[48] wurden ähnliche Ergebnisse erzielt. In Norwegen gelang mittels Impfungen eine Sanierung des Rinderbestandes, allerdings sind hierzu konsequente Impfungen des gesamten Bestandes über mehrere Jahre notwendig.[49] Ähnlich erfolgreich war die Impfung von Füchsen in Pelztierfarmen.[50]
Vorbeugende und begleitende Maßnahmen
Vorbeugend für den Fußpilz ist das Tragen von Schutzschuhen in öffentlichen Einrichtungen (Schwimmbäder, Hotels, …). Da ein feuchtwarmes Klima auf der Haut die Entwicklung von Dermatophyten fördert, sind gründliches Abtrocknen und das Tragen offenen Schuhwerks wirksamere vorbeugende Maßnahmen als beispielsweise die Fußdesinfektion im Schwimmbad.[28] Gegenstände wie Kämme, Bürsten, Kleidung oder Handtücher sollten nicht mit anderen Personen geteilt werden.[51]
Ein häufiger Wäschewechsel sowie das Tragen von kochbarer und den Schweiß gut aufsaugender Baumwollkleidung sind als Begleitmaßnahmen empfehlenswert.[51] Betroffene Hautstellen sollten nicht berührt werden, um eine Verschleppung der Sporen auf andere Körperregionen zu vermeiden: Eine Dermatophytose an den Händen ist fast immer Folge eines Fuß- oder Nagelpilzes.[28]
Vor allem bei langhaarigen Tieren muss eine Schur erwogen werden, um die Menge der an den Haaren haftenden Sporen zu reduzieren. Eine konsequente Dekontamination der Umgebung ist zur Verhinderung von erneuten Erkrankungen (Reinfektionen) bei zoophilen Erregern meist unabdingbar. Gegenstände müssen desinfiziert, mit einem wirksamen Desinfektionsmittel gewaschen, mit einem Dampfstrahler gereinigt oder ganz entsorgt werden.[52] Problematisch ist die Wahl des Desinfektionsmittels. Die pilz- (fungizide) und sporenabtötende (sporozide) Wirksamkeit wird in den üblichen Testverfahren anhand von Candida albicans, also einer Hefe, geprüft. Ein auf der Basis von Microsporum canis entwickeltes Modell zeigte aber, dass lediglich verdünnte Lösungen von Chlorbleiche, Schwefelkalk (Calciumpolysulfid) und Enilconazol sicher gegen diese Dermatophyte wirken. Von den in Desinfektionsmitteln häufig eingesetzten quartären Ammoniumverbindungen zeigte nur Benzalkoniumchlorid eine relativ gute fungizide Wirkung.[53]
Geschichte

Obwohl Dermatophytosen seit vielen Jahrhunderten auftraten, gibt es kaum Berichte darüber.[54] Der Begriff Favus (Erbgrind) wurde bereits im 1. Jahrhundert von Aulus Cornelius Celsus geprägt. Im 10. Jahrhundert beschrieben Ärzte wie Avicenna und Rhazes trockene Hautveränderungen, die sie Sahafats und Alvathin nannten. Für diese entstand im Mittelalter der Begriff Tinea. 1561 wurde Celsus’ Werk erstmals in deutscher Ausgabe gedruckt, 1690 verfasste Tobias Vogel das erste deutsche Dermatologiebuch, in dem verschiedene Erscheinungsformen von Dermatophytosen beschrieben sind.[55] Im Mittelalter waren Dermatophytosen vermutlich weit verbreitet. So zeigen das 1510 entstandene Bild Die Kreuztragung Christi (vermutlich Hieronymus Bosch oder Umfeld) den ebenfalls zum Kreuzestod verurteilten „bösen Schächer“ mit entsprechender Hautveränderung am Kopf[55] und ein Bild des Rembrandt-Schülers Ferdinand Bol (1616–1680) einen Knaben, der eindeutig an Erbgrind leidet. Auch Goyas (1746–1828) Bilder „Knaben beim Erklettern eines Baumes“ und „Die Hochzeit“ (La boda, 1792) stellen Kopfveränderungen dar, die auf eine Tinea capitis hinweisen.[56]

Die Krankheitsursache konnte erst im 19. Jahrhundert aufgeklärt werden. Der Berliner Hochschullehrer Johann Lukas Schönlein (1793–1864) entdeckte 1839, dass Erbgrind durch Pilze verursacht wird. Robert Remak (1815–1865) hatte entsprechende Strukturen zwar bereits vier Jahre früher entdeckt, seine Beobachtung aber nicht publiziert. Er ließ sie aber 1837 als persönliche Mitteilung in der Dissertation seines Schülers Xaver Hube zitieren. Remak identifizierte die kugeligen und stäbchenförmigen Gebilde aber nicht als Pilze, gestand daher Schönlein die Entdeckung zu und benannte den Erreger nach ihm Achorion schoenleinii (heute: Trichophyton schoenleinii). Zudem erkannte Remak die Infektiosität des Erregers, indem er sich selbst mit Sporen infizierte,[23] und züchtete ihn erstmals auf Apfelscheiben an. Ohne Kenntnis der Arbeiten Remaks und Schönleins erforschte der in Paris tätige ungarische Arzt David Gruby (1810–1898) Anfang der 1840er Jahre klinische, epidemiologische und mykologische Details über den Erbgrind, weshalb er auch als Begründer der Dermatomykologie (Hautpilzkunde) gilt. Er beschrieb auch das Eindringen von Microsporum audouinii von außen in das Haar (ektotrich) bei Tinea capitis und Tinea barbae und das Wachstum innerhalb des Haares (endotrich) von Trichophyton tonsurans.[3][54]
Der französische Mikrobiologe Raymond Sabouraud (1864–1938) begann um 1890, sich intensiv mit Dermatophyten zu beschäftigen. Er beschrieb ihre morphologischen Merkmale und stellte eine Taxonomie auf. Der von ihm entwickelte Sabouraud-Agar ist noch heute, wenn auch in leicht abgewandelter Form, der Standard-Nährboden zur Anzüchtung von Dermatophyten. Seine Erkenntnisse fasste er 1910 in „Les Teignes“, dem ersten Standardwerk über Dermatophytosen, zusammen. 1925 führten Margarot und Deveze[57] die 1903 von Robert Williams Wood (1868–1955) entwickelte Wood-Lampe in die mykologische Diagnostik ein.
Die heute noch übliche Einteilung der Dermatophyten in drei Gattungen (Epidermophyton, Trichophyton und Microsporum) wurde 1934, aufbauend auf Sabourauds Arbeiten, von dem US-amerikanischen Mykologen Chester Emmons (1900–1985) aufgestellt. Die geschlechtlichen Formen (Teleomorphe) der Dermatophyten wurden 1959 von Dawson und Gentles[58] bei Trichophyton ajelloi entdeckt, in den 1960er Jahren auch für weitere Dermatophyten. Die Entdeckung der geschlechtlichen Fortpflanzung der Dermatophyten war Voraussetzung für genetische Studien und die Erforschung ihrer Pleomorphie.[3]
Dermatophytosen wurden bis Anfang des 20. Jahrhunderts mit Quecksilber-, Schwefel-, Thallium- oder Iodverbindungen behandelt.[54] Von 1903 bis Ende der 1950er Jahre wurden Dermatophytose-Patienten mit Röntgenstrahlung therapiert. Dies führte zu einem verstärkten Auftreten von strahlenbedingten Krebserkrankungen.[59] Der massenhafte Einsatz der Röntgentherapie bei Einwanderern nach Israel in den 1940er und 1950er Jahren war Gegenstand zweier Dokumentarfilme und führte 1994 zur Verabschiedung eines Entschädigungsgesetzes (→ Ringelflechte-Affäre). 1958 setzte Gentles[60] das bereits 1939 von Albert Edward Oxford und Mitarbeitern[61] isolierte Griseofulvin erstmals im Tierversuch bei Meerschweinchen ein. Dies gilt als Geburtsstunde der Antimykotika-Therapie. Bereits im November 1958 wurde Griseofulvin von dem Wiener Dermatologen Gustav Riehl auch erfolgreich beim Menschen angewendet.[62] Versuche zur Entwicklung von Dermatophytenimpfstoffen wurden bereits in den 1940er Jahren begonnen.[46] Großflächige Impfungen wurden erstmals 1969 bei Hausrindern in der Sowjetunion durchgeführt.[49]
Literatur
- Otto Braun-Falco, Gerd Plewig, Helmut H. Wolff, Walter H. C. Burgdorf, Michael Landthaler: Dermatologie und Venerologie. 5. Auflage. Springer, Berlin u. a. 2005, ISBN 3-540-40525-9.
- Peter Fritsch: Pilzkrankheiten (Mykosen). In: Peter Fritsch: Dermatologie und Venerologie. Lehrbuch und Atlas. Springer, Berlin u. a. 1998, ISBN 3-540-61169-X, S. 282–302.
- Renate Hämmerling, Michael Cieslicki: Dermatophytosen sicher diagnostizieren und die Zoonosegefahr verringern. In: Kleintier-Praxis. Bd. 54, Nr. 11, 2009, ISSN 0023-2076, S. 639–650, Abstract.
- Chiara Noli, Fabia Scarampella: Dermatophytose. In: Chiara Noli, Fabia Scarampella: Praktische Dermatologie bei Hund und Katze. Klinik, Diagnose, Therapie. Schlütersche, Hannover 2004, S. 203–210, ISBN 3-87706-726-3.
- Claus Seebacher: Dermatomykosen. Grundlagen und Therapie. Springer, Berlin u. a. 2000, ISBN 3-540-65100-4.
- Hans-Jürgen Tietz, Horst Ulbricht: Humanpathogene Pilze der Haut und Schleimhäute. Entnahme, Anzucht, Differenzierung. Schlütersche, Hannover 1999, ISBN 3-87706-540-6.
- Irene Weitzman, Richard S. Summerbell: Dermatophytes. In: Clinical Microbiology Reviews. Bd. 8, Nr. 2, 1995, ISSN 0893-8512, S. 240–259, PMID 7621400.
Weblinks
- Leitlinie Tinea der freien Haut. (Memento vom 24. Januar 2013 im Internet Archive) (PDF; 209 kB) Deutsche Dermatologische Gesellschaft
- Leitlinie Tinea capitis. (Memento vom 3. Mai 2014 im Internet Archive) Deutsche Dermatologische Gesellschaft
- Heinz Seeliger und Theresia Heymer: Diagnostik pathogener Pilze des Menschen. Lehrbuch und Atlas. (PDF; 9,3 MB)
Einzelnachweise
- P. Fritsch: Pilzkrankheiten (Mykosen). In: Dermatologie und Venerologie. Lehrbuch und Atlas. Springer-Verlag, Berlin / Heidelberg 1998, ISBN 3-540-61169-X, S. 282–302.
- Renate Hämmerling, Michael Cieslicki: Dermatophytosen sicher diagnostizieren und die Zoonosegefahr verringern. In: Kleintierpraxis, 54, 2011, S. 639–650.
- Irene Weitzman, Richard S. Summerbell: Dermatophytes. In: Clin. Microbiol. Rev., 8, 1995, S. 240–259. PMID 7621400, PMC 172857 (freier Volltext)
- H.-J. Tietz und Renate Hämmerling: Die Bedeutung zoophiler Dermatophyten für den Menschen und anthropophiler Zoonosen für das Tier. In: Prakt. Tierarzt, 88, 2007, S. 78–86.
- P. Van Rooij et al.: Canine dermatophytosis caused by Trichophyton rubrum: an example of man-to-dog transmission. In: Mycoses, 2011 Jul 20. doi:10.1111/j.1439-0507.2011.02071.x. PMID 21771108
- Regina Wagner: Dermatophytosen bei Hund und Katze. In: Kompendium Kleintier 2013, S. 28–32.
- Claus Seebacher et al.: Updates on the epidemiology of dermatophyte infections. In: Mycopathologia, 166, 2008, S. 335–352. PMID 18478365
- L.A. Drake et al.: Guidelines of care for superficial mycotic infections of the skin: tinea corporis, tinea cruris, tinea faciei, tinea manuum, and tinea pedis. Guidelines/Outcomes Committee. American Academy of Dermatology. In: Journal of the American Academy of Dermatology, 34, 1996, S. 282–286. PMID 8642094
- B. Havlickova et al.: Epidemiological trends in skin mycoses worldwide. In: Mycoses, 51, 2008, Suppl. 4, S. 2–15. PMID 18783559
- Claus Seebacher: Zur Veränderung des Dermatophytenspektrums bei dermatologisch relevanten Erkrankungen. In: Mycoses, 46, 2003, Suppl 1, S. 42–46. PMID 12955853
- D. Abeck et al.: Onychomykose: Aktuelle Daten zu Epidemiologie, Erregerspektrum, Risikofaktoren sowie Beeinflussung der Lebensqualität. In: Dtsch. Ärztebl. 97 (2000), S. 1984–1986.
- R.S.A. Mohammedamin et al.: Reported incidence and treatment of dermatophytosis in children in general practice: a comparison between 1987 and 2001. In: Mycopathologia. Band 164, Nr. 6, 2007, S. 271–278, doi:10.1007/s11046-007-9062-3, PMID 17891509, PMC 2780650 (freier Volltext) – (englisch).
- H.H. Zehle et al.: Zur Bekämpfung der Trichophytie. In: 58. Tierärztlicher Erfahrungsaustausch, 23. Mai 2007. Volltext (Memento vom 16. Januar 2014 im Internet Archive)
- R. Papini et al.: High infection rate of Trichophyton verrucosum in calves from Central Italy. In: Zoonoses and Public Health, 56, 2009, S. 59–64. PMID 18705659
- K.H. Böhm et al.: Vorläufige Ergebnisse von aktuellen Studien zur Verbreitung der Mikrosporie in Katzenpopulationen. In: Tierärztl. Praxis, 26, 1998, S. 73.
- K.A. Moriello: Management of dermatophyte infections in catteries and multiple-cat households. In: Vet. Clin. North Am. Small Anim. Pract., 25, 1990, S. 1457–1474. PMID 2251736
- R. Breuer-Strosberg: Nachweishäufigkeit von Dermatophyten bei Katzen und Hunden in Österreich. In: Dtsch. Tierärztl. Wochenschr. 100 (1993), S. 483–485. PMID 8306866
- Y. Gräser und M. Berlin: Leitfaden Dermatophytose beim Meerschweinchen. Nationales Konsiliarlabor für Dermatophyten, 2020, abgerufen am 10. April 2021.
- A. Balsari et al.: Dermatophytes in clinically healthy laboratory animals. In: Lab. Anim., 15, 1981, S. 75–77. PMID 7265899; Volltext (PDF; 745 kB) (Seite nicht mehr abrufbar, Suche in Webarchiven) Info: Der Link wurde automatisch als defekt markiert. Bitte prüfe den Link gemäß Anleitung und entferne dann diesen Hinweis.
- R. López-Martínez et al.: Dermatophytes isolated from laboratory animals. In: Mycopathologia, 88, 1984, S. 111–113. PMID 6527696
- C. Pollock: Fungal diseases of laboratory rodents. In: Vet. Clin. North Am. Exot. Anim. Pract., 6, 2003, S. 401–413. PMID 12827729
- K.A. Moriello und D.J. DeBoer: Feline dermatophytosis. Recent advances and recommendations for therapy. In: Vet. Clin. North Am. Small Anim. Pract., 20, 1995, S. 901–921. PMID 8525573
- Barbara Beifuß: Etablierung einer molekularen Sofortdiagnostik von Dermatophyten auf Speziesebene aus nativem Material von Patienten mit Hautmykosen mittels Polymerasekettenreaktion (PCR) und Real-time PCR (LightCycler). Diss. Ludwig-Maximilians-Universität München 2008; Volltext (PDF; 1,5 MB)
- Ch. Noli und F. Scarampella: Dermatophytose. In: Praktische Dermatologie bei Hund und Katze. Schlütersche, Hannover 2004, ISBN 3-87706-726-3, S. 203–210
- P. Hensel: Die feline Dermatophytose – Diagnostik und Therapie. In: Kleintiermedizin, (5/6)/2006, S. 122–132
- S.R. Almeida: Immunology of dermatophytosis. In: Mycopathologia 166 (2008), S. 277–283. PMID 18478362.
- J.A. Woodfolk: Allergy and dermatophytes. In: Clin Microbiol Rev., 18, 2005, S. 30–43. PMID 15653817. PMC 544172 (freier Volltext)
- Otto Braun-Falco und Helmut Heinrich Wolff: Dermatologie und Venerologie. 5. Auflage. Springer, 2005, ISBN 978-3-540-40525-2.
- Michael Rolle, Anton Mayr: Medizinische Mikrobiologie, Infektions- und Seuchenlehre. 7. Auflage. Georg Thieme Verlag, 2007, ISBN 978-3-8304-1060-7.
- J.C. Roujeau et al.: Chronic dermatomycoses of the foot as risk factors for acute bacterial cellulitis of the leg: a case-control study. In: Dermatology 209 (2004), S. 301–307. PMID 15539893
- K.-H. Huhnstock, W. Kutscha, H. Dehmel: Diagnose und Therapie in der Praxis. 5. Auflage. Springer-Verlag, 2013, ISBN 978-3-642-68385-5, S. 85–86.
- V. Panasiti et al.: Comparison of diagnostic methods in the diagnosis of dermatomycoses and onychomycoses. In: Mycoses 49 (2006), S. 26–29. PMID 16367815
- H.-J. Tietz und H. Ulbricht: Humanpathogene Pilze der Haut und Schleimhäute. Schlütersche Hannover 1999, ISBN 3-87706-540-6
- D. Wilsmann-Theis et al.: New reasons for histopathological nail-clipping examination in the diagnosis of onychomycosis. In: Journal of the European Academy of Dermatology and Venereology. 25 (2011), S. 235–237. PMID 20477921
- J. Garg et al.: Rapid detection of dermatophytes from skin and hair. In: BMC Res Notes. 18 (2009), S. 60. PMID 19374765. PMC 2678142 (freier Volltext)
- A. Hryncewicz-Gwóźdź et al.: Identification and differentiation of Trichophyton rubrum clinical isolates using PCR-RFLP and RAPD methods. In: Eur J Clin Microbiol Infect Dis. 30 (2011), S. 727–731. PMID 21416216 PMC 3088811 (freier Volltext)
- Pressemitteilung: Wohlbefinden ist HAUTsache (Volltext)
- M.A. Lawry et al.: Methods for diagnosing onychomycosis: a comparative study and review of the literature. In: Archives of Dermatology. 136 (2000), S. 1112–1116. PMID 10987866
- Renate Hämmerling: Dermatophytose bei einem Hund mit ungewöhnlicher Symptomatik. In: Veterinärspiegel 2 (2004), S. 78–82.
- L.K. Gupta und M.K. Singhi: Wood’s lamp. In: Indian Journal of Dermatology, Venereology and Leprology. 70 (2004), S. 131–135. (Volltext)
- Claus Seebacher: Dermatomykosen: Grundlagen und Therapie. Springer-Verlag 2000, ISBN 978-3-540-65100-0
- WHO Model List of Essential Medicines. (PDF; 442 kB) abgerufen am 20. September 2012.
- Monika Linek: Update der Therapie von Dermatophytosen. In: Kleintierpraxis 54 (2009), S. 622–632.
- Veterinärdermatologische Studie von 2011: A. Diesel, M. Verbrugge, K. A. Moriello: Efficacy of eight commercial formulations of lime sulphur on in vitro growth inhibition of Microsporum canis. In: Veterinary Dermatology. Band 22, Nummer 2, April 2011, ISSN 1365-3164, S. 197–201, doi:10.1111/j.1365-3164.2010.00928.x, PMID 20868396. Siehe dort insbesondere den einleitenden Satz "Lime sulphur is a common topical treatment for dermatophytosis in animals".
- Michael Cieslicki: Klinische und mykologische Wirksamkeit von Lufenuron bei der Dermatophytose der Katze. In: Kleintierpraxis 9 (2005), S. 575–580.
- Doris Westhoff et al.: Die Behandlung der felinen Dermatophytose mit einem inaktivierten Pilzimpfstoff. In: Kleintierpraxis 8 (2011), S. 401–410.
- J. Karle et al.: Controlled blind study to prove the efficacy of the inactivated vaccine Insol Dermatophyton in artificially infected horses. In: Pferdeheilkunde 18 (2002), S. 625–628.
- Z. Hussin und J.M. Smith: Vaccination procedures and the infectivity of dermatophyte lesions. In: Mycopathol. 40 (1983), S. 71–76. PMID 6855874
- R. Gudding und A. Lund: Immunoprophylaxis of bovine dermatophytosis. In: Can Vet J. 36 (1995), S. 302–306. PMID 7773918, PMC 1686876 (freier Volltext)
- L.K. Bredahl et al.: Efficacy of an experimental Microsporum canis vaccine in farmed foxes. In: Veterinary Dermatology. 12 (2000), S. 45.
- Mark Buchta et al.: Das zweite StEx: Basiswissen klinische Medizin für Examen und Praxis. 2. Auflage. Springer-Verlag, 2004, ISBN 978-3-540-20351-3, S. 388.
- Renate Hämmerling: Dermatophytosen in der Kleintierpraxis. In: Kleintiermedizin 7 (2004), S. 1–6.
- K.A. Moriello et al.: Development of an in vitro, isolated, infected spore testing model for disinfactant testing of Microsporum canis isolates. In: Veterinary Dermatology. 15 (2003), S. 175–179. PMID 15214954
- R. Negroni: Historical aspects of dermatomycoses. In: Clinics in Dermatology. 28 (2010), S. 125–132. PMID 20347652
- Hannelore Mittag: Die Tinea aus historischer Sicht. In: 15. Tagung der Arbeitsgemeinschaft „Mykologische Laboratoriumsdiagnostik“ innerhalb der Deutschsprachigen Mykologischen Gesellschaft (DMykG), Leipzig, 16. November 2001 (Volltext (Memento vom 9. März 2013 im Internet Archive), PDF, 349 kB)
- 50 Jahre Deutschsprachige Mykologische Gesellschaft (Memento vom 29. September 2011 im Internet Archive) (PDF; 389 kB)
- J. Margarot und P. Deveze: Aspect de quelques dermatoses lumiere ultraparaviolette. Note preliminaire. In: Bull. Soc. Sci. Med. Biol. Montpellier 6 (1925), S. 375–378.
- C.O. Dawson und J. Gentles: Perfect stage of Keratinomyces ajelloi. In: Nature 183 (1959), S. 1345–1346.
- R.E. Shore et al.: Skin Cancer after X-Ray Treatment for Scalp Ringworm. In: Radiation Research 157 (2002), S. 410–418. PMID 11893243
- J. Gentles: Experimental ringworm in guinea pigs: oral treatment with griseofulvin. In: Nature 182 (1958), S. 476–477.
- A.E. Oxford et al.: Studies in the biochemistry of microorganisms: Griseofulvin, C(17)H(17)O(6)Cl, a metabolic product of Penicillium griseofulvum Dierckx. In: Biochemical Journal. 33 (1939), S. 240–248
- Gustav Riehl: Griseofulvin als peroral wirksames Antimykotikum. In: Dermatol. Wochenschr. 140 (1959), S. 993.