Allylamin
Allylamin, auch als 3-Aminopropen, 3-Aminopropylen oder 3-Amino-1-propen bezeichnet, ist ein Amino-Derivat des Propens.
| Strukturformel | ||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
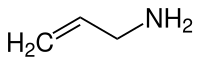 | ||||||||||||||||
| Allgemeines | ||||||||||||||||
| Name | Allylamin | |||||||||||||||
| Andere Namen |
| |||||||||||||||
| Summenformel | C3H7N | |||||||||||||||
| Kurzbeschreibung |
farblose bis gelbliche Flüssigkeit mit ammoniakartigem Geruch[1] | |||||||||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||||||||
| ||||||||||||||||
| Eigenschaften | ||||||||||||||||
| Molare Masse | 57,09 g·mol−1 | |||||||||||||||
| Aggregatzustand |
flüssig[1] | |||||||||||||||
| Dichte |
0,76 g·cm−3[1] | |||||||||||||||
| Schmelzpunkt | ||||||||||||||||
| Siedepunkt |
53 °C[1] | |||||||||||||||
| Dampfdruck | ||||||||||||||||
| Löslichkeit |
mit Wasser mischbar[1] | |||||||||||||||
| Brechungsindex |
1,4205 (20 °C)[2] | |||||||||||||||
| Sicherheitshinweise | ||||||||||||||||
| ||||||||||||||||
| Toxikologische Daten | ||||||||||||||||
| Thermodynamische Eigenschaften | ||||||||||||||||
| ΔHf0 |
−10,0 kJ/mol[4] | |||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. Brechungsindex: Na-D-Linie, 20 °C | ||||||||||||||||
Eigenschaften
Allylamin ist eine leichtentzündliche, mit Wasser mischbare Flüssigkeit. Die wässrige Lösung reagiert alkalisch. Der pH-Wert einer Lösung von 5,7 g in einem Liter Wasser beträgt 11,2. Die Dämpfe des sehr leichtflüchtigen Allylamins können mit Luft explosionsfähige Gemische bilden. Allylamin, sowie einige Derivate dieser Verbindung, sind Inhibitoren des Rinder-Enzyms BPAO (bovine plasma amine oxidase)[5]
Toxizität
Dämpfe von Allylamin, aber auch flüssiges Allylamin, haben eine stark reizende Wirkung auf Augen und Haut. Allylamin ist ein kardiovaskuläres Toxin. So löst die Gabe von Allylamin in Ratten eine zystische Medianekrose Erdheim-Gsell der Aorta[6] sowie Arteriosklerose aus.[7]
Verwendung
Allylamin ist das Basismonomer für die Synthese von Polyallylamin (PAAm beziehungsweise PAH = Polyallylamin Hydrochlorid). Die Polymerisation kann sowohl radikalisch als auch im Plasma (Plasmaunterstützte chemische Gasphasenabscheidung (PECVD)) erfolgen.[8] Allylamin ist ein Baustein zur Synthese von Terbinafin[9] und anderen Fungiziden aus der Klasse der Allylamine.[10][11][12]
Literatur
- P. Nussbaumer, I. Leitner, K. Mraz, A. Stütz: Synthesis and structure-activity relationships of side-chain-substituted analogs of the allylamine antimycotic terbinafine lacking the central amino function. In: Journal of medicinal chemistry. Band 38, Nummer 10, Mai 1995, S. 1831–1836, PMID 7752208.
Einzelnachweise
- Eintrag zu Allylamin in der GESTIS-Stoffdatenbank des IFA, abgerufen am 20. Januar 2022. (JavaScript erforderlich)
- David R. Lide (Hrsg.): CRC Handbook of Chemistry and Physics. 90. Auflage. (Internet-Version: 2010), CRC Press/Taylor and Francis, Boca Raton, FL, Physical Constants of Organic Compounds, S. 3-12.
- Eintrag zu Allylamine im Classification and Labelling Inventory der Europäischen Chemikalienagentur (ECHA), abgerufen am 1. Februar 2016. Hersteller bzw. Inverkehrbringer können die harmonisierte Einstufung und Kennzeichnung erweitern.
- David R. Lide (Hrsg.): CRC Handbook of Chemistry and Physics. 90. Auflage. (Internet-Version: 2010), CRC Press/Taylor and Francis, Boca Raton, FL, Standard Thermodynamic Properties of Chemical Substances, S. 5-24.
- H. B. Jeon, L. M. Sayre: Highly potent propargylamine and allylamine inhibitors of bovine plasma amine oxidase. In: Biochem Biophys Res Commun. 304/2003, S. 788–794; PMID 12727226.
- D. Kumar u. a.: Allylamine and beta-aminopropionitrile induced aortic medial necrosis: mechanisms of synergism. In: Toxicology 125/1998, S. 107–115; PMID 9570326.
- D. J. Conklin, B. J. Boor: Allylamine cardiovascular toxicity: evidence for aberrant vasoreactivity in rats. In: Toxicology and applied pharmacology 148/1998, S. 245–251; PMID 9473532.
- A. Choukourov u. a.: Mechanistic studies of plasma polymerization of allylamine. In: J Phys Chem B 109/2005, S. 23086–23095; PMID 16854007.
- G. Petranyi u. a.: Antifungal activity of the allylamine derivative terbinafine in vitro. In: Antimicrobial Agents and Chemotherapy 31/1987, S. 1365–1368; PMID 3674847; PMC 174943 (freier Volltext).
- N. S. Ryder: Specific inhibition of fungal sterol biosynthesis by SF 86-327, a new allylamine antimycotic agent. In: Antimicrob Agents Chemother 27/1985, S. 252–256; PMID 4039119; PMC 176248 (freier Volltext).
- G. Petranyi u. a.: Allylamine derivatives: new class of synthetic antifungal agents inhibiting fungal squalene epoxidase. In: Science 224/1984, S. 1239–1241; PMID 6547247.
- I. Salmoiraghi u. a.: Allylamine type xanthone antimycotics. In: Arch Pharm 331/1998, S. 225–227. PMID 9713256.


