Lufenuron
Lufenuron ist ein Chitininhibitor, der gegen Larven von Insekten (larvales Insektizid) und gegen Pilze (Antimykotikum) wirksam ist. In der Tiermedizin wird es vor allem gegen Flöhe bei Katzen und bei Hunden, sowie in Kombination mit anderen Wirkstoffen als Breitbandantiparasitikum eingesetzt. Gegen Dermatophytosen erwies es sich als wenig wirksam.[6] Bei Hunden wird der Wirkstoff auch zur Herzwurmprophylaxe eingesetzt. Der Wirkstoff gehört zu den Derivaten des Benzoylphenyl-Harnstoffs.
| Strukturformel | ||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
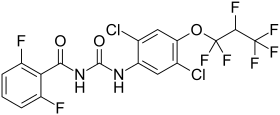 | ||||||||||||||||||||||
| Strukturformel ohne Stereochemie | ||||||||||||||||||||||
| Allgemeines | ||||||||||||||||||||||
| Freiname | Lufenuron | |||||||||||||||||||||
| Andere Namen |
| |||||||||||||||||||||
| Summenformel | C17H8Cl2F8N2O3 | |||||||||||||||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||||||||||||||
| ||||||||||||||||||||||
| Arzneistoffangaben | ||||||||||||||||||||||
| ATC-Code | ||||||||||||||||||||||
| Wirkstoffklasse | ||||||||||||||||||||||
| Eigenschaften | ||||||||||||||||||||||
| Molare Masse | 511,15 g·mol−1 | |||||||||||||||||||||
| Dichte | ||||||||||||||||||||||
| Schmelzpunkt | ||||||||||||||||||||||
| Löslichkeit |
wasserunlöslich.[2] | |||||||||||||||||||||
| Sicherheitshinweise | ||||||||||||||||||||||
| ||||||||||||||||||||||
| Toxikologische Daten | ||||||||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | ||||||||||||||||||||||
Chemie
Synthese
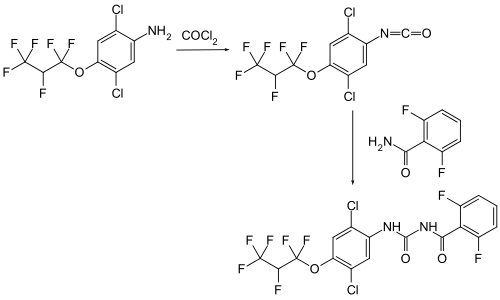
Im ersten Schritt wird der Ausgangsstoff 2,5-Dichlor-4-(1,1,2,3,3,3-hexafluorpropoxy)-anilin mit Phosgen umgesetzt. Nach destillativer Aufkonzentrierung ergibt die Umsetzung des resultierenden Isocyanats mit 2,6-Difluorbenzamid die Zielverbindung.[1] Die Synthesesequenz ergibt das Racemat. Eine Enantiomerentrennung kann chromatographisch über eine chirale Säule erfolgen.[1]
Physikalische Eigenschaften
Lufenuron ist eine farblose, kristalline und stark lipophile Substanz. Die Struktur enthält ein Stereozentrum, so dass zwei Enantiomere existieren. In pharmazeutischen Formulierungen wird allerdings nur das Racemat verwendet.[2] Das Racemat zeigt ein ausgeprägtes polymorphes Verhalten. Es sind vier verschiedene polymorphe Formen bekannt.[1] Die thermodynamisch stabile und kommerziell verwendete Form A schmilzt bei 175 °C mit einer Schmelzenthalpie von 33,3 kJ·mol−1. Eine Form B entsteht durch Kristallisation aus der Schmelze und wandelt sich exotherm zwischen 66 °C und 92 °C in die Form C um, was auf ein monotropes Verhältnis schließen lässt. Form C kann durch Fällungen aus ethanolischer oder Dichlormethan-Lösung bzw. Rekristallisation aus amorphem Material erhalten werden. Der Schmelzpunkt bei 147 °C und die Schmelzenthalpie von 22,3 kJ·mol−1 weisen auf ein monotropes Verhältnis zu Form A hin. Es wurde auch eine exotherme Umwandlung zwischen 91 °C und 121 °C beobachtet, was das monotrope Verhältnis bestätigt. Eine Form D kann ebenfalls aus der Schmelze erhalten werden und wandelt sich ab 94 °C monotrop in Form A um. Die Verbindung ist wasserunlöslich, in organischen Lösungsmitteln wie Methanol, Dichlormethan, Xylolen und Toluol dagegen sehr gut löslich.[2]
Pharmakologie
Der Arzneistoff wird nach oraler oder subkutaner Verabreichung schnell resorbiert und reichert sich im Fettgewebe an. Aus diesem wird es allmählich an das Blut abgegeben, so dass langanhaltende Wirkstoffspiegel (bis 6 Monate) erreicht werden. Lufenuron wird kaum metabolisiert und über die Leber und letztlich über den Kot ausgeschieden.
Lufenuron wird von weiblichen Flöhen und anderen blutsaugenden Insekten aufgenommen und gelangt in diesen in den Eierstock und die Eier. Durch Störung der Biosynthese von Chitin verhindert es die Entwicklung der Larven, so dass es nicht zur Weiterentwicklung kommt. Für eine effektive Bekämpfung von Ektoparasiten wird der Arzneistoff im Regelfall mit einem Adult-Insektizid kombiniert.
Nebenwirkungen
Neben lokalen Schwellungen an der Injektionsstelle können bei oraler Gabe Erbrechen, Abgeschlagenheit, Fressunlust, Durchfall, Atemnot, Juckreiz und andere Hautprobleme auftreten. Bei Hunden darf das Injektionspräparat wegen starker Hautreaktionen nicht eingesetzt werden.[2]
Handelsnamen
Monopräparate: Program
Kombinationspräparate: Program Plus (mit Milbemycinoxim), Sentinel Spectrum (mit Milbemycinoxim und Praziquantel)
Einzelnachweise
- M. Szelagiewicz, C. Marcolli, S. Cianferani, A. P. Hard, A. Vit, A. Burkhard, M. von Raumer, U. Ch. Hofmeier, A. Zilian, E. Francotte, R. Schenker: In situ Characterization of Polymorphic Forms – The Potential of Raman Techniques. In: J. Therm. Anal. Cal. 57, 1999, S. 23–43.
- Eintrag zu Lufenuron bei Vetpharm, abgerufen am 23. November 2011.
- Eintrag zu Lufenuron (ISO) im Classification and Labelling Inventory der Europäischen Chemikalienagentur (ECHA), abgerufen am 17. März 2017. Hersteller bzw. Inverkehrbringer können die harmonisierte Einstufung und Kennzeichnung erweitern.
- Eintrag zu N-(2,5-Dichlor-4-(1,1,2,3,3,3-hexafluorpropoxy)phenylaminocarbonyl)-2,6-difluorbenzamid in der GESTIS-Stoffdatenbank des IFA, abgerufen am 1. Februar 2016. (JavaScript erforderlich)
- Datenblatt Lufenuron bei Sigma-Aldrich, abgerufen am 12. Mai 2017 (PDF).
- Michael Cieslicki: Klinische und mykologische Wirksamkeit von Lufenuron bei der Dermatophytose der Katze. In: Kleintierpraxis. 9, 2005, S. 575–580.