Canine Demodikose
Die canine Demodikose ist eine häufige, durch die übermäßige Vermehrung der Haarbalgmilbe Demodex canis hervorgerufene, parasitäre Hauterkrankung der Hunde (Canidae). Sie kann örtlich begrenzt oder am ganzen Körper auftreten. Die Demodikose entsteht bei älteren Tieren nur im Zusammenhang mit Störungen des Immunsystems, bei Jungtieren ist die Entstehung der Krankheit nicht vollständig aufgeklärt. Die Demodikose beginnt zumeist mit Haarausfall und ohne Juckreiz. Im weiteren Verlauf können sich durch eine bakterielle Sekundärinfektion stärkere Hautveränderungen bis zu einer eitrigen Hautentzündung (Pyodermie) entwickeln. Die Krankheit wird durch den mikroskopischen Nachweis der Milben festgestellt. Die Behandlung erfolgt mit milbenwirksamen Medikamenten.
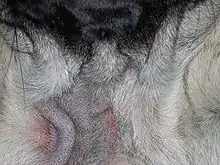
Krankheitsursache

Auslöser einer Demodikose ist vor allem Demodex canis. Demodex canis ist eine schlanke, etwa 250 bis 300 µm lange und 40 µm dicke Milbe, die in den Haarbälgen (Haarfollikeln) und Talgdrüsen parasitiert. Dort ernährt sie sich von Talg, Gewebsflüssigkeit und den natürlich abgestoßenen Zellen. In geringer Zahl kommen diese Milben als Kommensale auch bei vielen klinisch gesunden Tieren vor. Die weiblichen Milben legen Eier, die sich über ein Larven- und Nymphenstadium zu den erwachsenen Milben entwickeln. Der gesamte Entwicklungszyklus findet in den Haarbälgen statt und dauert 20 bis 35 Tage. Außerhalb des Wirtes sind Haarbalgmilben nicht überlebensfähig und sterben infolge Austrocknung schnell ab. Haarbalgmilben produzieren keinen Kot, sondern lagern Stoffwechselabbauprodukte in Zellen des Darmtrakts ein, so dass sie kaum eine Immunantwort provozieren.
In jüngerer Zeit wurden weitere Demodex-canis-ähnliche Milben beschrieben, die größer bzw. kleiner sind. Die kürzere Milbe wurde Demodex cornei,[1] die längere Demodex injai[2] genannt. Demodex cornei lebt vor allem auf der Hautoberfläche und kann in Kombination mit Demodex canis auftreten. Demodex injai scheint sich vor allem in den Talgdrüsen aufzuhalten. Eventuell sind D. injay und D. cornei aber nur morphologische Varianten von Demodex canis und keine eigenständigen Arten.[3]
Krankheitsentstehung und Verbreitung
Die Übertragung der Demodex-Milben erfolgt zumeist schon im Alter von wenigen Lebenstagen von der Hündin auf die Welpen beim Säugen. Diese Infektion bleibt aber in der Regel symptomlos. Eine Übertragung von Hund zu Hund nach dem dritten Lebenstag gilt als unwahrscheinlich. Zum Ausbruch einer Demodikose kommt es erst viel später, wenn sich diese Milben stark vermehren. Betroffene Jungtiere scheinen keine Störungen des Immunsystems zu haben, da sie nicht vermehrt anderen Erkrankungen gegenüber empfindlich sind, man geht daher von einer verminderten milbenspezifischen Immunkompetenz aus. Lediglich eine vorübergehende Verminderung der T-Zell-Immunität wird beobachtet, die unter Umständen aber nur Folge der Erkrankung ist. Bei älteren Tieren kommt es meist durch Störungen des Immunsystems (Tumore, Nebennierenüberfunktion, Schilddrüsenunterfunktion, Leishmaniose, Mangelernährung sowie Behandlung mit Glukokortikoiden, anderen Immunsuppressiva, Progesteron oder Chemotherapeutika) zu einer Demodikose.[3]
Der Erreger verursacht bei Krankheitsausbruch eine Schädigung der beim Hund zusammengesetzten Haarfollikel (bis zu 20 Haare pro Follikel) und eine Störung der Haarbildung.
Die Demodikose tritt weltweit auf. Eine erhöhte Krankheitsneigung bestimmter Hunderassen (Rasseprädisposition) wird in Europa, im Gegensatz zu den Vereinigten Staaten, nicht beobachtet. In Amerika sind vor allem Englische Bulldogge, Französische Bulldogge, Mops, Dobermann, Deutscher Schäferhund, Zwergschnauzer und einige Terrier (Pit Bull, West Highland White, Jack Russel, Staffordshire Bullterrier) betroffen. Dies wird dadurch erklärt, dass in Europa immungeschwächte Tiere („Kümmerer“) nicht zur Zucht verwendet werden. Darüber hinaus scheint es eine individuelle genetische Prädisposition zu geben.
Eine Übertragung auf andere Spezies findet normalerweise nicht statt, da Haarbalgmilben streng wirtsspezifisch sind. Es gibt zwar sehr wenige Fallberichte, dass eng mit erkrankten Hunden zusammenlebende Menschen ebenfalls Krankheitserscheinungen zeigten, von einer Zoonose wird aber dennoch nicht gesprochen.[3]
Klinisches Bild
Demodex-canis-Infektionen

Das erste Zeichen einer Demodikose durch Demodex canis ist zumeist Haarausfall (Alopezie), der nur an umschriebenen Stellen oder auch am ganzen Körper (generalisiert) auftreten kann. Häufig tritt an den haarlosen Stellen eine vermehrte Talg- (Seborrhö) oder Schuppenbildung auf. In einigen Fällen können letztere Symptome auch ohne Haarverlust auftreten. Später kann es zu einer grauen Verfärbung der geschädigten Areale kommen. Bis zu diesem Stadium ist zumeist kein Juckreiz vorhanden.
Bei Jungtieren (jünger als 18 Monate) beginnen die Veränderungen zumeist im Gesichtsbereich („Brillenbildung“, Lefzen, Kinn) und/oder an den Gliedmaßen. Zumeist heilt diese Erkrankung auch ohne Behandlung nach wenigen Wochen ab, sie kann sich aber auch weiter ausdehnen und in eine generalisierte Demodikose übergehen.
Im weiteren Verlauf ist das klinische Bild durch eine bakterielle Sekundärinfektion, vor allem mit Staphylokokken, seltener auch mit Proteus, Klebsiellen oder Escherichia coli gekennzeichnet. Es kommt zu einer Follikulitis, Furunkulose und übermäßigen Verhornung (Hyperkeratose). Gelegentlich kann sich dieses Stadium der Erkrankung auch durch Pusteln manifestieren. Bei tiefem Eindringen der Bakterien in die Haut entwickelt sich eine eitrige Hautentzündung (Pyodermie) mit Bildung von Krusten und Schwellungen der Lymphknoten. Hier ist bei jungen Hunden differentialdiagnostisch eine Canine juvenile Zellulitis auszuschließen.
Sonderformen sind der Befall der Haut der Füße und des Ohrs. Der Befall der Füße (Pododemodikose) äußert sich in Rötung und Schwellung (Ödem) im Zwischenzehenbereich; in ausgeprägten Fällen entwickeln sich Granulome und Fisteln, so dass das Bild einer chronischen Pododermatitis entsteht. Der Befall des äußeren Gehörgangs (Otodemodikose) wird vor allem bei generalisierter Demodikose beobachtet und ist durch ein bräunliches Sekret gekennzeichnet.
Infektionen mit anderen Demodex-Milben
Demodex-injai-Infektionen äußern sich zumeist mit erhöhter Talgproduktion („fettige Haut“), schlechter Haarqualität mit schütterem Haar und vor allem am Rücken auftretendem Juckreiz. Auch Papeln, Pusteln oder „Mitesser“ können auftreten. Diese Form der Demodikose wird vor allem bei Terriern beobachtet. Demodex-cornei-Infektionen zeigen sich in Rötungen der Haut, Schuppenbildung und ausgeprägtem Juckreiz.[4]
Untersuchungsmethoden

Die Diagnose erfolgt durch Nachweis lebender Milben in den Haarfollikeln. Dazu muss in der Regel ein tiefes Hautgeschabsel entnommen werden. Auch mit Herausziehen eines Haarbüschels („hair pluck“), dem Ausquetschen der Haarfollikel bzw. Talgdrüsen mit einer Klemme oder einer Hautbiopsie kann Probenmaterial für die anschließende mikroskopische Untersuchung gewonnen werden. Hautbiopsien sind vor allem bei Pododemodikose mit Granulombildung sowie Rassen mit sehr dicker Haut (Englische Bulldogge, Shar-Pei) sinnvoll, da ein Hautgeschabsel von ausreichender Tiefe hier selten gelingt. Insgesamt ist die Zahl nachgewiesener Milben im Hautgeschabsel größer als mit den anderen Methoden.[5]
Vor allem bei Therapiekontrollen (siehe unten) dürfen keine Aufhellungspräparate mit Kaliumhydroxid angefertigt werden, da dann die Einschätzung der Vitalität der Milben nicht möglich ist. Die Proben sollten daher nur in einen auf einen Objektträger aufgebrachten Tropfen Paraffinöl eingebettet werden. Empfehlenswert ist es, das Präparat vor der Untersuchung etwa 10 Minuten liegen zu lassen, weil die Haarbalgmilben dann aus den Wurzelscheiden der Haare auswandern und somit besser sichtbar sind. Zu beachten ist, dass einzelne Haarbalgmilben einen physiologischen Befund darstellen können, also nur eine deutliche Ansammlung mit Vorhandensein von Eiern, Larven und Nymphen in Zusammenhang mit dem klinischen Bild als eindeutige Diagnose gilt.[6]
Bei stärkerem Befall können Milben auch über die Lymphgefäße in regionäre Lymphknoten gelangen oder durch orale Aufnahme beim Belecken auch im Kot nachgewiesen werden.
Bei bakterieller Sekundärinfektion wird der Erregernachweis durch bakteriologische Untersuchung und die Anfertigung eines Antibiogramms empfohlen.
Behandlung
Eine lokale Demodikose bei Jungtieren bildet sich in 90 % der Fälle wieder spontan zurück. Ob eine Behandlung sinnvoll ist oder nicht, ist in der Literatur umstritten. Zum einen wird sie empfohlen, um eine Generalisierung zu vermeiden, zum anderen wird empfohlen, gerade die mögliche Generalisierung abzuwarten, um sie als Zuchtausschlusskriterium (siehe unten) nutzen zu können. Eine lokale äußerliche (topische) Behandlung zum Beispiel durch Auftragen eines Gels mit Benzoylperoxid, Chlorhexidin oder Rotenon ist dabei zumeist ausreichend. Benzoylperoxid dringt zwar gut in die Haarfollikel ein, wirkt allerdings stark austrocknend und zum Teil hautreizend.[4] Eine ausgeprägte Demodikose ist generell mit einer Ganzkörperbehandlung zu therapieren.
Sowohl bei lokaler als auch systemischer Demodikose hatte sich in der Vergangenheit die regelmäßige Waschbehandlung mit Amitraz bewährt.[7] Einige Zwerghunderassen (Chihuahua, Malteser) reagieren allerdings sehr empfindlich auf diesen Wirkstoff, so dass der Einsatz bei diesen nicht empfohlen wird. Bei starkem Befall wird bei langhaarigen Hunden eine vollständige Schur empfohlen, da der Wirkstoff die Haut gut benetzen muss, um tief genug in die Haarbälge eindringen zu können. Bei starker bakterieller Sekundärinfektion ist zunächst diese zu behandeln, z. B. durch Scheren der betroffenen Partien, Reinigen mit desinfizierend wirkenden Waschlösungen und systemischer Verabreichung von Antibiotika, da Amitraz nicht auf größere Wunden aufgebracht werden sollte. Von Juni 2009 war auch ein Spot-on-Präparat mit Amitraz zur Behandlung der Demodikose zugelassen, das nur 14-täglich aufgetragen werden muss. Insbesondere bei lokaler Demodikose ist eine 14-tägliche Therapiekontrolle sinnvoll, um einem zu frühen Abbruch der Behandlung und damit der Gefahr der Entstehung einer generalisierten Demodikose vorzubeugen. Ein sich abzeichnender Behandlungserfolg ist anhand der Abnahme der Zahl lebender Milben, der Zunahme verkrüppelter Milben und der Abnahme der Larven sichtbar. Eine vollständige Ausheilung wird durch nachgewachsene Haare und fehlenden Nachweis lebender Milben angezeigt und gelingt mit Amitraz etwa in 80 % der Fälle. In etwa 40 % der Fälle treten Nebenwirkungen wie Abgeschlagenheit und Juckreiz auf, die durch stärkere Verdünnung oder Verminderung der Behandlungsfrequenz reduziert werden können. Gelegentlich können auch schwerere Nebenwirkungen wie Fressunlust, Ataxie sowie vermehrter Durst und Harnabsatz auftreten. Da Amitraz auch zu einem Anstieg des Blutzuckerspiegels führt, ist der Einsatz bei zuckerkranken Hunden kontraindiziert. Mittlerweile (Stand August 2020) sind für Hunde aber keine Präparate mit Amitraz mehr zugelassen.
Die systemische Behandlung mit Ivermectin, Moxidectin oder Milbemycinoxim ist ebenfalls gut wirksam. Diese Wirkstoffe werden täglich peroral bis zur erfolgreichen Therapiekontrolle (s. u.) verabreicht.[7] Zu beachten ist, dass einige Hunderassen und Welpen unter 12 Wochen aufgrund der insuffizienten Blut-Hirn-Schranke sehr empfindlich auf einige Avermectine reagieren (→ MDR1-Defekt) und es in Deutschland mit Moxidectin nur ein einziges für Hunde zugelassenes Avermectin-Präparat gibt. Die Behandlung mit Milbemycinoxim ist auch bei Avermectin-empfindlichen Hunden möglich. Sie muss aber im Regelfall über etwa 70 Tage durchgeführt werden[8] und ist daher sehr kostenintensiv.[4] Aktuelle Studien zeigen bei generalisierter Demodikose eine gute Wirksamkeit von Isoxazolinen wie Fluralaner[9], Sarolaner oder Afoxolaner[10]. Seit 2018 bzw. 2019 sind Präparate dieser drei Isoxazoline zur Behandlung der Demodikose zugelassen.[3]
Aufgrund deutlicher Nebenwirkungen und der Gefahr von Vergiftungen werden Akarizide auf der Basis organischer Phosphorsäureester heute kaum noch angewendet.
Unterstützend kann Vitamin E verabreicht werden. Tritt eine Demodikose bei Hündinnen im Zusammenhang mit der Läufigkeit zyklisch auf, ist eine Kastration zu erwägen. Eine Behandlung mit Glukokortikoiden oder Progesteron ist bei Demodikose kontraindiziert.
Bei bakterieller Sekundärinfektion ist zusätzlich zur Milbenbekämpfung eine lokale Behandlung mit desinfizierenden Lösungen (Benzoylperoxid, Chlorhexidin, Povidon-Iod) oder Antibiotika, bei schweren Pyodermien auch die systemische Verabreichung von Antibiotika vor der eigentlichen Milbenbekämpfung angezeigt.[4]
Behandlungsaussicht
Die Behandlung ist bei lokalisierter Demodikose zumeist erfolgreich. Von einer erfolgreichen Therapie wird ausgegangen, wenn sich in zwei, im Abstand von zwei Wochen aufeinanderfolgenden Hautuntersuchungen von vier bis fünf verschiedenen Stellen keine lebenden Milben mehr nachweisen lassen.[4] Schwere, generalisierte Formen und die Pododemodikose können sich als therapieresistent erweisen, insbesondere wenn nicht behebbare Störungen des Immunsystems oder fördernde Primärleiden vorliegen. Die Gefahr von Rezidiven sinkt deutlich, wenn das betroffene Tier ein Jahr symptomfrei bleibt. Bei einigen Tieren kann eine Symptomfreiheit nur durch lebenslange Gabe von Amitraz oder Ivermectin erreicht werden.
Die American Academy of Veterinary Dermatology empfiehlt bei einer generalisierten Demodikose eines Jungtieres oder rezidivierenden Demodikosen den Ausschluss des betroffenen Tieres sowie seiner Eltern und Geschwister von der Zucht.[11]
Literatur und Quellen
- Beat Bigler: Demodikose. In: Peter F. Suter, Hans G. Niemand (Hrsg.): Praktikum der Hundeklinik. 10. Auflage. Paul-Parey-Verlag, 2006, ISBN 3-8304-4141-X, S. 368–369.
- Ch. Noli, F. Scarampella: Demodikose des Hundes. In: Praktische Dermatologie bei Hund und Katze. 2. Auflage. Schlütersche Verlagsanstalt, 2005, ISBN 3-87706-713-1, S. 238–244.
- St. Peters: Demodikose. Zwei neue Milben-Varianten. In: Kleintier konkret. 2/2002, S. 4–9.
- D. Meyer, R. S. Mueller: Die Demodikose des Hundes. In: Tierärztl Praxis. 2008;36 (K), S. 91–98.
Siehe auch
Einzelnachweise
- K. V. Mason: A new species of demodex mite with D. canis causing canine demodicosis: a case report. In: Ninth Proceedings, Annual Members Meeting of American Academy Veterinary Dermatology and American College Veterinary Dermatology, 1993, San Diego. S. 92.
- C. E. Desch, A. Hillier: Demodex injai: a new species of hair follicle mite (Acari: Demodecidae) from the domestic dog (Canidae). In: J Med Entomol. 40 (2003), Heft 2, S. 146–149.
- Tanja Töpfer: Diagnose und Therapie der Demodikose bei Hunden und Katzen. In: Kleintierpraxis Band 65, 2020, Heft 8, S. 444–459.
- M. Shipstone: Generalised demodicosis in dogs, clinical perspective. In: Aust Vet J. Vol 78 (2000), Heft 4, S. 240–242.
- M. N. Saridomichelakis u. a.: Relative sensitivity of hair pluckings and exudate microscopy for the diagnosis of canine demodicosis. In: Vet. Dermatol. 18 (2007), Heft 2, S. 138–141. PMID 17355431
- Ch. Noli, F. Scarampella: Demodikose des Hundes. In: Praktische Dermatologie bei Hund und Katze. 2. Auflage. Schlütersche Verlagsanstalt, 2005, S. 238–244.
- R.S. Mueller: Treatment protocols for demodicosis: an evidence-based review. In: Veterinary Dermatology. 15 (2004), Heft 2, S. 75–89.
- B. R. Holm: Efficacy of milbemycin oxime in the treatment of canine generalized demodicosis: a retrospective study of 99 dogs (1995–2000). In: Vet Dermatol. 14 (2003), S. 189–195.
- Josephus J. Fourie et al.: Efficacy of orally administered fluralaner (BravectoTM) or topically applied imidacloprid/moxidectin (Advocate®) against generalized demodicosis in dogs. In: Parasites & Vectors. Band 8, 2015, S. 187–, doi:10.1186/s13071-015-0775-8, PMID 25881320, PMC 4394402 (freier Volltext).
- F. Beugnet, L. Halos, D. Larsen und C. de Vos: Efficacy of oral afoxolaner for the treatment of canine generalised demodicosis. In: Parasite. Band 23, 2016, S. 14, doi:10.1051/parasite/2016014, PMID 27012161, PMC 4807374 (freier Volltext).
- D. W. Scott u. a.: Muller and Kirk’s Small Animal Dermatology. 5. Auflage. W B Saunders, Philadelphia 1995, S. 417–432.