Azole
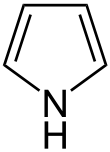
Azole, umgangssprachlich auch Pyrrole, sind eine Gruppe heterocyclischer chemischer Verbindungen. Es handelt sich um fünfgliedride stickstoffhaltige heteroaromatische Verbindungen, deren Stammverbindung das Pyrrol ist. Durch die formale Hydrierung einer Doppelbindung erhält man Pyrroline, die formale Hydrierung beider Doppelbindungen führt zu den Pyrrolidinen.
Eigenschaften
Azole sind aromatische Verbindungen. Fünf mesomere Grenzstrukturen können formuliert werden. Azole erfüllen die Hückel-Kriterien durch die Beteiligung des freien Elektronenpaars des Stickstoffatoms. Bezüglich ihrer Aromatizität liegen sie zwischen den stärker aromatischen Thiophenen und den praktisch nicht mehr aromatischen Oxolen.[1]
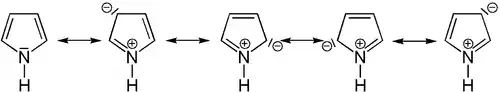
Azole besitzen durch das freie Elektronenpaar des Stickstoffatoms basischen Charakter.
An Azolen können Elektrophile aromatische Substitutionen durchgeführt werden. Auf Grund der besseren Stabilisierung der Zwischenstufen dieser Reaktion finden diese bevorzugt in 2-Position statt. Gegen Lewis-Säuren sind sie jedoch nicht stabil.[1] Diese koordinieren an das Heteroatom und führen zu Ringöffnung.
Wirkungen
Azole zählen zu den Hemmstoffen der Ergosterinsynthese. Sie wirken, indem sie die mikrosomale Lanosterin-Demethylase inhibieren. Es folgt eine Hemmung der Umsetzung von Lanosterin in Ergosterin.[2]
Herstellung
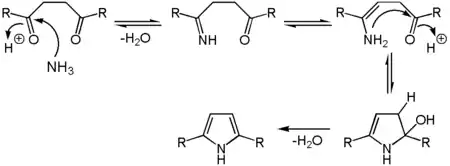
Azole können durch Paal-Knorr-Synthese aus Dicarbonylen wie Diketonen oder Dialdehyden und Ammoniak hergestellt werden.[3]
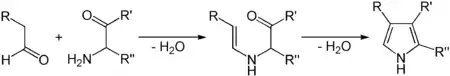
Eine weitere Synthesemöglichkeit ist die Knorr-Pyrrolsynthese, zu der Aldehyde und α-Aminoketone benötigt werden.[4]
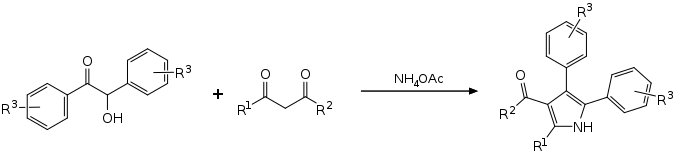
Eine Eintopfreaktion mit substituierten Benzoinen, 1,3-Dicarbonylverbindungen und Ammoniumacetat führt ohne Lösungsmittel und Katalysator zu tetrasubstituierten Pyrrolen.[5][6]
Azole mit mehreren Heteroatomen
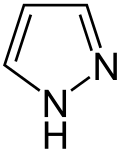
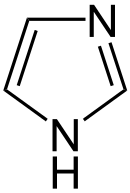
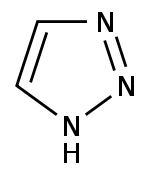
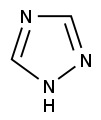
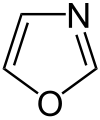
Pyrrol stellt nicht nur die Stammverbindung für die Azole dar, auch weitere heterocyclische Stoffgruppen leiten sich von dieser Struktur ab. Hierzu gehören die Pyrazole und Imidazole, die zwei Stickstoffatome besitzen. Mit drei Stickstoffatomen sind die Triazole und mit vieren das Tetrazol bekannt. Zu den Azolen mit verschiedenartigen Heteroatomen gehören die Oxazole und Thiazole.
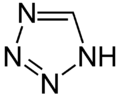
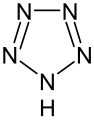 Pentazol
Pentazol
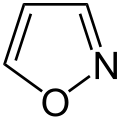
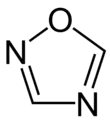 die Oxadiazole
die Oxadiazole
(1,2,4-Oxadiazol)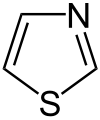
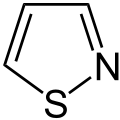
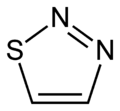 die Thiadiazole
die Thiadiazole
(1,2,3-Thiadiazol)
Vorkommen und Verwendung
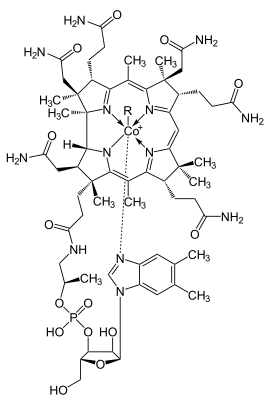
Pyrrole kommen wie die meisten heterocyclischen Verbindungen in zahlreichen Naturstoffen vor. Hierzu zählen beispielsweise die Porphyrine, die die Grundlage der Häme bilden. Auch in weiteren natürlichen makrocyclischen Verbindungen wie Corrin treten sie auf.
Azole sind als Fragmente in zahlreichen Wirkstoffen enthalten. In Kunststoffen treten Azole beispielsweise in den Polypyrrolen auf. Auch jüngere Antimykotika aus der Gruppe der Hemmstoffe der Ergosterin-Biosynthese gehören zu den Azolen.
Azole machten 2013 ein Drittel aller Antimykotika aus, die für Anwendung im Agrarbereich verkauft wurden. Die massive Verwendung von Azolen in der Landwirtschaft wird verdächtigt, für die Entwicklung eines resistenten Stamms von Aspergillus verantwortlich zu sein und möglicherweise auch die Entwicklung des für den Menschen gefährlichen, 2007 erstmals nachgewiesenen, Candida auris befördert zu haben.[7]
Einzelnachweise
- D. T. Davies: Basistexte Chemie: Aromatische Heterocyclen, 1. Auflage, S. 10–34, Wiley-VCH, Weinheim 1995, ISBN 3-527-29289-6.
- Medizinische Mikrobiologie. 7. Auflage. Georg Thieme Verlag, Stuttgart 2019, ISBN 978-3-13-242355-8, doi:10.1055/b-006-163249 (thieme.de [abgerufen am 26. August 2020]).
- L. Knorr: Einwirkung des Diacetbernsteinsäureesters auf Ammoniak und primäre Aminbasen, in: Ber. Dtsch. Chem. Ges. 1885, 18, 299–311; doi:10.1002/cber.18850180154
- L. Knorr: Synthese von Pyrrolderivaten, in Ber. Dtsch. Chem. Ges. 1884, 17, 1635–1642; doi:10.1002/cber.18840170220.
- Bhat, S.I.; Trivedi, D.R.: A catalyst- and solvent-free three-component reaction for the regioselective one-pot access to polyfunctionalized pyrroles in Tetrahedron Lett. 54 (2013) 5577–5582, doi:10.1016/j.tetlet.2013.07.153.
- e-EROS Encyclopedia of Reagents for Organic Synthesis, 1999–2013, John Wiley and Sons, Inc., Eintrag für Ammonium acetate, abgerufen am 17. Februar 2018.
- Matt Richtel und Andrew Jacobs: "A Mysterious Infection, Spanning the Globe in a Climate of Secrecy" New York Times vom 6. April 2018.