Candida albicans
Candida albicans (früher Monilia albicans und Oidium albicans), der „Soorpilz“, ist ein Pilz der Candidagruppe, die den Hefepilzen zugeordnet wird. Er ist der häufigste Erreger der Kandidose (auch Candidose, Candidiasis, Candidamykose, Monoliasis, Soor oder bei Babys „Windelpilz“ genannt). Dieser Pilz ist bei Gleichwarmen („Warmblüter“) und somit auch beim Menschen häufig auf den Schleimhäuten von Mund und Rachen und im Genitalbereich sowie im Verdauungstrakt zu finden. Bei etwa 75 % aller gesunden Menschen kann er laut der Deutschen Gesellschaft für Ernährung nachgewiesen werden. Der Pilz kann auch zwischen Fingern und Zehen sowie auf den Finger- und Fußnägeln vorkommen.
| Candida albicans | ||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|
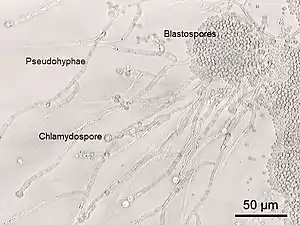
Candida albicans, Pseudohyphen (links, mit Blastokonidien und Chlamydosporen) und hefeartige Zellen (rechts) | ||||||||||||
| Systematik | ||||||||||||
| ||||||||||||
| Wissenschaftlicher Name | ||||||||||||
| Candida albicans | ||||||||||||
| (C.P.Robin) Berkhout | ||||||||||||
C. albicans gehört zu den fakultativ pathogenen Erregern (nur unter bestimmten Bedingungen eine Krankheit auslösend) und ist als ein Saprobiont anzusehen, der in einem Gleichgewichtszustand mit der menschlichen Immunabwehr und anderen Mikroorganismen siedelt. Die Besiedelung durch diesen Pilz verursacht in der Regel kaum Beschwerden. Bei fehlender oder verminderter Immunität (im Rahmen von anderen Grundkrankheiten, wie Diabetes mellitus, Krebs, AIDS, oder durch die Gabe bestimmter Medikamente wie Antibiotika) kann die Besiedelung mit Candida albicans oder ihm verwandten Pilzen jedoch stark zunehmen, die sich dann als Mykose manifestiert. Meistens handelt es sich dabei um endogene Infektionen, das heißt, der Erreger war bereits vor Krankheitsausbruch am Ort der Infektion, seltener um exogene Infektionen, also durch von außen erworbene Erreger.
Behandeln lässt sich eine Candidose mit Antimykotika (Antipilzmittel), die in die Synthese der Pilzzellwand (zum Beispiel Caspofungin) oder der Zellmembran (zum Beispiel Fluconazol, Nystatin) eingreifen.
Candida lässt sich gut unter Zugabe von Antibiotika (zur Unterdrückung von Bakterienkolonien) auf einfachen Nährböden anzüchten und bildet in Kultur bei 37 °C innerhalb von ein bis zwei Tagen kleine weißliche Kolonien.
Morphologie und Fortpflanzung
Candida ist ein polymorpher Pilz, d. h., er bildet unterschiedliche Wachstumsformen aus. Die einzelnen Pilzzellen sind rundlich-oval und haben einen Durchmesser von ungefähr 4–10 µm (extreme Werte aus der Literatur). Typisch sind für Candida albicans sowohl die Bildung von Pseudomyzelen (Fadenform) als auch die Bildung von echten Hyphen, die jedoch schon ein Hinweis für die nicht mehr saprobiotische, sondern invasive Besiedelungsform im Rahmen einer manifesten Infektion sind. Einzelne Myzelfäden können bereits mit bloßem Auge im Untersuchungsmaterial erkannt werden.
Candida bildet sogenannte Blastokonidien, die durch Sprossung entstehen (vgl. Konidiogenese und Dehiszenz). Auch Dauersporen, die sogenannten Chlamydosporen, sind ein wichtiges Unterscheidungsmerkmal von Candida albicans zu anderen Hefen, kommen jedoch auch bei einem engen und ebenfalls klinisch relevanten Verwandten, Candida dubliniensis, vor. Diese Chlamydosporen bilden eine widerstandsfähige Zellwand und sind größer als Blastokonidien. Candida albicans besitzt als diploider Organismus ein Genom mit einer Größe von 2x16 Megabasenpaaren, welches auf 2x8 Chromosomen verteilt ist. Lange war bei diesem Pilz kein sexuelles Stadium bekannt, so dass er zu den Fungi imperfecti zählte. Neuere Forschungsergebnisse deuten jedoch darauf hin, dass Candida albicans sich unter bestimmten Bedingungen sexueller Mechanismen für den Austausch genetischen Materials zwischen verschiedenen Isolaten bedient, und dass diese Fähigkeit eine Rolle in der Anpassung des Pilzes an bestimmte Stressbedingungen spielt.[1]
Seit 2013 ist bekannt, dass C. albicans vorübergehend in einer haploiden Form vorkommt, die sich durch sexuelle Fortpflanzung oder Autodiploidisierung in die diploide Form zurückverwandeln kann.[2]
.jpg.webp)
Gentechnik
Das KEGG-Genom von C. albicans besteht aus 14.629 proteincodierenden Genen und 32 RNA-kodierenden Genen.[3] 13 weitere Genome sind erfasst.[4] Die Proteinstruktur ist online verfügbar.[5]
Kariogenität
Die Zahnkaries ist eine Erkrankung der Zahnhartgewebe Zahnschmelz und Dentin. Neuere Forschung hat ergeben, dass ein Zusammenspiel des kariogenen Streptococcus mutans mit dem Pilz Candida albicans besteht, wodurch das Bakterium seine Virulenz verändert. Der Pilz produziert Signalmoleküle, die Gene des Bakteriums zur Produktion zelleigener Antibiotika anregen. Das Bakterium kann durch den Pilz fremdes Erbgut aufnehmen. Streptococcus mutans bildet Dextrane, die zur Bildung der Plaque (Zahnbelag) beitragen. Mikroorganismen verfügen an ihrer Zellwand über spezielle Rezeptoren, die ihnen diese Bindung ermöglichen. Die Produktion klebriger Substanzen, einer wichtigen Voraussetzung für die Haftung des Streptococcus mutans auf dem Zahn, wird durch den Pilz unterstützt.[6]
Candida albicans in polymikrobiellen Biofilmen
Der Hefepilz Candida albicans steht mit vielen anderen Mikroben des humanen Mikrobioms in Symbiose, denn er trägt mit diesen zur Biofilmbildung bzw. regt sie zur Bildung eines Biofilms an.[7][8][9] Da Immunzellen nur bedingt gegen einen Biofilm vorgehen können, kann es auch bei immunkompetenten Patienten z. B. zu chronischen Reizungen, leichten chronischen Entzündungen, Gelenkschmerzen oder chronischer Müdigkeit kommen.[10] Zudem können temporär verabreichte, immunsuppressive Medikamente (z. B. Steroide, Kortison) oder Infektionen (Influenza) zur invasiven Ausbreitung des Biofilms beitragen. Dies kann zu chronischen Reizungen und Entzündungen im Bereich der inneren Organe (Endokarditis, Meningitis, Endophthalmitis etc.) führen.[11]
Der Biofilm begünstigt das Austauschen von Resistenzgenen zwischen einzelnen Bakterien.[12] Des Weiteren produziert der Hefepilz Candida albicans ein Sekret, welches undurchlässig für das Antibiotikum Vancomycin ist und somit die sich im Biofilm befindlichen Bakterien vor jenem Antibiotikum schützt.[7] Es ist davon auszugehen, dass auch andere Antibiotika von dem Sekret blockiert werden können. Das Sekret kann jedoch mit Antimykotika (z. B. Amphotericin-B, Anidulafungin) und einigen NSAR (z. B. Ibuprofen und Aspirin) gelöst werden.[7][13][14] Auch kann Stickstoffmonoxid bereits in einer für den Menschen ungefährlichen Konzentration bestimmte Mikroorganismen zur Auflösung des Biofilms anregen.[15]
Einzelnachweise
- K. Nielsen & J. Heitmann: Sex and virulence of human pathogenic fungi. Adv Genet. 2007;57:143–173. PMID 17352904.
- M. A. Hickman, G. Zeng u. a.: The 'obligate diploid' Candida albicans forms mating-competent haploids. In: Nature. Band 494, Nummer 7435, Februar 2013, S. 55–59. doi:10.1038/nature11865. PMID 23364695. PMC 3583542 (freier Volltext).
- http://www.genome.jp/kegg-bin/show_organism?org=cal Kegg
- http://www.candidagenome.org/Strains.shtml Candida albicans Strains
- D. Reinhardt: Cystische Fibrose. Springer-Verlag, 12. März 2013, ISBN 978-3-642-56796-4, S. 141.
- H. Sztajer, S. P. Szafranski, J. Tomasch, M. Reck, M. Nimtz, M. Rohde, I. Wagner-Döbler: Cross-feeding and interkingdom communication in dual-species biofilms of Streptococcus mutans and Candida albicans. In: The ISME journal. Band 8, Nummer 11, November 2014, S. 2256–2271. doi:10.1038/ismej.2014.73. PMID 24824668.
- Melphine M. Harriott, Mairi C. Noverr: Candida albicans and Staphylococcus aureus Form Polymicrobial Biofilms: Effects on Antimicrobial Resistance. In: Antimicrobial Agents and Chemotherapy. Band 53, Nr. 9, 1. September 2009, ISSN 0066-4804, S. 3914–3922, doi:10.1128/AAC.00657-09, PMID 19564370 (asm.org [abgerufen am 14. Januar 2020]).
- Clarissa J. Nobile, Alexander D. Johnson: Candida albicans Biofilms and Human Disease. In: Annual review of microbiology. Band 69, 2015, ISSN 0066-4227, S. 71–92, doi:10.1146/annurev-micro-091014-104330, PMID 26488273, PMC 4930275 (freier Volltext).
- Megan L. Falsetta, Marlise I. Klein, Punsiri M. Colonne, Kathleen Scott-Anne, Stacy Gregoire: Symbiotic relationship between Streptococcus mutans and Candida albicans synergizes virulence of plaque biofilms in vivo. In: Infection and Immunity. Band 82, Nr. 5, Mai 2014, ISSN 1098-5522, S. 1968–1981, doi:10.1128/IAI.00087-14, PMID 24566629, PMC 3993459 (freier Volltext).
- Anikó Kilár, Ágnes Dörnyei, Béla Kocsis: Structural characterization of bacterial lipopolysaccharides with mass spectrometry and on- and off-line separation techniques. In: Mass Spectrometry Reviews. Band 32, Nr. 2, 2013, ISSN 1098-2787, S. 90–117, doi:10.1002/mas.21352 (wiley.com [abgerufen am 14. Januar 2020]).
- Melphine M. Harriott, Mairi C. Noverr: Importance of Candida-bacterial polymicrobial biofilms in disease. In: Trends in microbiology. Band 19, Nr. 11, November 2011, ISSN 0966-842X, S. 557–563, doi:10.1016/j.tim.2011.07.004, PMID 21855346, PMC 3205277 (freier Volltext).
- Scott Chimileski, Michael J Franklin, R Thane Papke: Biofilms formed by the archaeon Haloferax volcanii exhibit cellular differentiation and social motility, and facilitate horizontal gene transfer. In: BMC Biology. Band 12, 14. August 2014, ISSN 1741-7007, doi:10.1186/s12915-014-0065-5, PMID 25124934, PMC 4180959 (freier Volltext).
- Ona Rogiers, Michelle Holtappels, Wafi Siala, Mohamed Lamkanfi, Françoise Van Bambeke: Anidulafungin increases the antibacterial activity of tigecycline in polymicrobial Candida albicans/Staphylococcus aureus biofilms on intraperitoneally implanted foreign bodies. In: Journal of Antimicrobial Chemotherapy. Band 73, Nr. 10, 1. Oktober 2018, ISSN 0305-7453, S. 2806–2814, doi:10.1093/jac/dky246 (oup.com [abgerufen am 14. Januar 2020]).
- Mohammed A. S. Alem, L. Julia Douglas: Effects of Aspirin and Other Nonsteroidal Anti-Inflammatory Drugs on Biofilms and Planktonic Cells of Candida albicans. In: Antimicrobial Agents and Chemotherapy. Band 48, Nr. 1, 1. Januar 2004, ISSN 0066-4804, S. 41–47, doi:10.1128/AAC.48.1.41-47.2004, PMID 14693516 (asm.org [abgerufen am 14. Januar 2020]).
- Dispersal of Biofilms in Cystic Fibrosis | Biological Sciences | University of Southampton. Abgerufen am 14. Januar 2020.