Albert Eschenmoser
Albert Jakob Eschenmoser (* 5. August 1925 in Erstfeld/Schweiz) ist ein Schweizer Chemiker.
-Portr_12128.tif.jpg.webp)
Leben
Albert Eschenmoser, zweitgeborener Sohn aus Balgach im St. Galler Rheintal stammender Eltern, Alfons Otto Eschenmoser (1887–1977) und Johanna, geb. Oesch (1894–1978), verbrachte als Bürger von Balgach seine Jugend in Erstfeld (Kanton Uri), wo sein Vater als Metzger tätig war. Er besuchte die Realschule am Kollegium St. Borromäus in Altdorf UR, die Oberrealschule an der Kantonsschule in St. Gallen mit Maturitätsabschluss in mathematisch-naturwissenschaftlicher Richtung, studierte Naturwissenschaften mit Hauptfach Chemie an der ETH Zürich und erhielt 1949 das Diplom (dipl.sc. nat. ETH).[1]
Er promovierte 1951 am Institut von Leopold Ruzicka in der Arbeitsgruppe von Hans Schinz[2] mit dem Dissertationsthema „Zur säurekatalysierten Cyclisierung bei Mono- und Sesquiterpenverbindungen“.[3][4] Auf Anordnung von Ruzicka konnte er anschliessend die in der Doktorarbeit begonnene Forschung mit einer eigenen Doktorandengruppe fortsetzen.
1956 wurde er Privatdozent,[5] und 1960 ausserordentlicher Professor. Eschenmoser war von 1965 bis zu seiner Emeritierung 1992 ordentlicher Professor für allgemeine organische Chemie an der ETH Zürich.
Nach seiner Emeritierung setzte er seine Forschung in kleinem Rahmen mit Postdoktoranden fort: an der ETH Zürich bis zum Jahr 2000, von 1993 bis 1996 zudem als Gast im Laboratorium von Christian Noe[6] am Biozentrum der Universität Frankfurt/Main in Zusammenarbeit mit Gerhard Quinkert, und von 1996 bis 2009 als Professor am Scripps Research Institute in La Jolla, wo er eine Forschungsgruppe zusammen mit seinem ehemaligen ETH-Postdoktoranden Ramanarayanan Krishnamurthy[7] leitete.
Eschenmoser war Gastprofessor am Massachusetts Institute of Technology, Cambridge MA (1961), an der University of Wisconsin–Madison (1965), am Technion in Haifa (1969), an der University of Chicago (1970), Cambridge University, UK (1980), Harvard University, Cambridge MA (1984), TH Darmstadt (1993), Johann Wolfgang Goethe-Universität Frankfurt am Main (1994), Université catholique de Louvain/Katholieke Universiteit Leuven (1996) und der Universität Wien (2001).
Seit 1954 ist Albert Eschenmoser mit Elisabeth, geb. Baschnonga, verheiratet. Er ist Vater einer Tochter (Esther, 1961) sowie zweier Söhne (Jürg, 1958) und (Philipp, 1963). Er lebt seit 1963 in Küsnacht (Kanton Zürich).
Forschung
Eschenmoser war in seiner Forschung auf verschiedenen Teilgebieten der organischen und bioorganischen Chemie tätig. Die hauptsächlichen sind: Terpen-Biogenese, Mechanismus und Stereochemie organisch-chemischer Reaktionen, Entwicklung neuer Reaktionen und Methoden für die organische Synthese, Totalsynthese komplexer Naturstoffe, Chemie hydroporphinoider Ligandsysteme, Ätiologie der Vitamin-B12-Struktur, Ätiologie des Strukturtyps der natürlichen Nukleinsäuren, sowie schließlich Probleme der präbiotischen Chemie.
Terpenbiogenese
In seiner Promotionsarbeit[3] schlug Eschenmoser vor, dass die Strukturformeln aller bis dahin bekannten cyclischen Sesquiterpene formal durch Cyclisierungs- und Umlagerungsschritte von einem gemeinsamen aliphatischen Vorläufer ableitbar seien. Er belegte die Bedeutung des Postulats mit dem Vorschlag neuer Strukturformeln für die Sesquiterpene Zingiberen, β-Caryophyllen, Cloven, α-Caryophyllen (Humulen), Cedren, Elemol und Lanceol.[3] In der Folge erweiterte er dieses Postulat durch die Hypothese der oxidativen Initiation einer kationischen Cyclisierung des Triterpenkohlenwasserstoffs Squalen. Damit gelang die Ableitung der Konstitutionsformeln aller damals bekannten tetra- und pentacyclischen Triterpene aus der Formel dieses aliphatischen C30-Vorläufers. Diese formal-mechanistischen Zusammenhänge bildeten Anlass und Grundlage für die Formulierung der biogenetischen Isoprenregel durch Leopold Ruzicka[8] im Jahre 1953. Mit Hilfe eines Sets von stereoelektronischen und konformationellen Regeln[9][10] über den sterischen Verlauf kationischer Polyen-Cyclisierungen und Umlagerungen gelang 1955 Eschenmoser gemeinsam mit Duilio Arigoni die Ableitung nicht nur der Konstitution, sondern auch der Konfiguration sämtlicher damals strukturell bekannter tetra- und pentacyclischen Triterpene.[11] Die biogenetische Isoprenregel wurde zu einem wichtigen Instrument der Aufklärung der Struktur und der Biosynthese terpenoider Naturstoffe.
Mechanismus und Stereochemie organisch-chemischer Reaktionen
Zu Eschenmosers reaktionsmechanistisch-stereochemischen Untersuchungen gehört nebst den frühen Arbeiten über den sterischen Verlauf von kationischen Polyen-Cyclisierungen[9][10] in der Terpenreihe eine experimentelle Studie über die relative Geschwindigkeit der Oxydation von sekundären alicylischen Alkoholen zu Ketonen mit Chromsäure.[12] Diese Studie wies nach, dass der Unterschied in der Oxydationsgeschwindigkeit epimerer sekundärer Alkohole nicht auf unterschiedliche sterische Behinderung der Proton-Elimination zurückzuführen ist, sondern auf den Abbau sterischer Spannung beim Übergang vom Edukt ins Produkt. Eine 1970 erschienene Arbeit[13] über nukleophile Substitutionsreaktionen am tetrahedralen Kohlenstoff wies erstmals darauf hin, dass endocyclische Substitutionen des SN2-Typs, bei denen im Übergangszustand der Reaktion die lineare Anordnung von Nukleophil, Substitutionszentrum und Abgangsgruppe nicht möglich ist, aus stereoelektronischen Gründen verboten sind. Zu Eschenmosers stereochemischen Studien zählen auch Arbeiten über langsame Stickstoff-Inversion in N-Chlor-aziridinen[14] und N-Alkoxy-1,2-oxazolidinen.[15]
Entwicklung neuer Reaktionen und synthetischer Methoden
Ein im Oevre Eschenmosers mehrfach wiederkehrendes Forschungsthema ist der Reaktionstyp der anionischen C,C-Fragmentierung als Methode der regioselektiven Bildung von Olefin-Doppelbindungen und C≡C-Dreifachbindungen. Konzeption und erste gezielte Anwendung dieses Reaktionstyps in einer Olefinsynthese gehen auf das Jahr 1952 zurück.[16] Spätere Beiträge zu Thematik sind u. a. die α,β-Epoxyketon → Alkinon Fragmentierung[17] und die decarboxylative Doppelfragmentierung von bicyclischen δ-Tosyloxy-Carboxylaten.[18] Ein weiterer Schwerpunkt war die Chemie von Vinyl-nitrosonium Ionen als hoch-elektrophile Reaktionspartner.[19] Arbeiten über die Verschiebung (Umpolung[20]) nukleophiler Reaktivität von der α- in die β-Stellung konjugierter Enonsysteme durch Oximierung der Carbonylgruppe stammen aus den Jahren 1958 und 1965.[21]
Zu den Entwicklungen, die im Laufe der Synthese von Vitamin B12 gemacht wurden, gehören: die reduktive C,C-Fragmentierung von Diels-Alder-Addukt α,α,β,β-Tetraestern,[22] C,C-Verknüpfung durch Iminoester/Enamin-Kondensation[22] und mittels der Methode der "Sulfid-Kontraktion",[23][24][25] die Amidacetal-Variante der Claisen-Umlagerung,[26] das in kristallisierter Form zugänglich gemachte Mannich-Salz N,N-Dimethyl-N-methyliden-ammonium-iodid als Methylenierungs- und Methylierungs-Reagens,[27] und schliesslich die gegenüber Methoxycarbonylgruppen selektive Hydrolyse einer primären Carboxamidgruppe mittels eines Vinylnitrosonium-Salzes.[28]
Die Epoxyketon → Alkinon-Fragmentierung, die Amidacetal-Variante der Claisen-Umlagerung, die C,C-Kupplungsreaktion durch Sulfidkontraktion, sowie das Methylenierungs-Reagens tragen Eschenmosers Namen (vgl. auch [29]).
Synthese von Naturstoffen
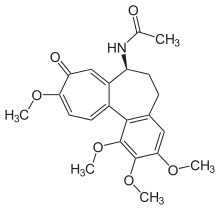
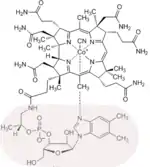
Der Hauptbeitrag Eschenmosers auf dem Gebiete der Totalsynthese von Naturstoffen ist nebst der Synthese des Alkaloids der Herbstzeitlose, Colchicin,[30] die in Zusammenarbeit mit Robert B. Woodward (Harvard University) in Cambridge (Massachusetts) durchgeführte Synthese des Vitamins B12. Dieses komplizierteste aller Vitamine enthält als zentrales Element ein Corrin-Ligandsystem, das sich von den biogenetisch verwandten tetrapyrrolischen Ligandsystemen der Porphyrine (z. B. Häm) und Chlorophylle durch die Struktur des Chromophors, dessen periphere Begrenzung mit C-Methylgruppen, und durch die Direktverknüpfung der Ringe A und D unterscheidet. An der ETH Zürich wurden in Modellstudien 1964 bzw. 1968 zwei unterschiedliche Synthesewege zum synthetisch bis dahin unerschlossenen Strukturtyp des Corrin-Ligandsystems des Vitamins entwickelt.[22][23][31]
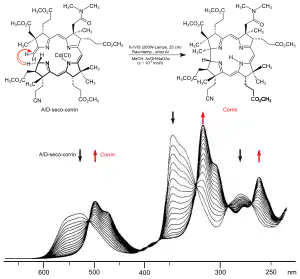
An Harvard und ETH sind dann 1972 zwei unterschiedliche Synthesen der Cobyrsäure (und damit implizite des Vitamins B12[33]) gleichzeitig vollendet worden.[28][32][34][35][36][37][38][39] Die Strategien der beiden Cobyrsäure-Synthesen entsprechen den Strategien der beiden Corrin-Modellsynthesen und unterscheiden sich vor allem in der Konstruktion jenes Strukturteils, der die stereochemisch komplexe direkte Verknüpfung der Ringe A und D enthält. In der einen, vor allem vom Harvard-Team bearbeiteten, Variante steht ein strategisch komplexer Aufbau dieses Strukturteils im Zentrum der Synthese.[37] In der ETH-Variante entsteht dieser Strukturteil stereoselektiv in einer neuartigen photochemischen Ringschluss-Reaktion (A/D-Secocorrin→Corrin-Cycloisomerisierung).[35] Beiden Varianten gemeinsam ist der Aufbau des Corrin-Chromphorsystems durch mehrfachen Einsatz einer im Zuge des Syntheseprojekts entwickelten neuen Methode der C,C-Verknüpfung (Sulfidkontraktion[25]). Diese beiden rund 60 bzw. 40 Reaktionsstufen umfassenden Cobyrsäure-Synthesen waren das Ergebnis einer für die Forschung auf dem Gebiete der organischen Chemie einzigartigen Zusammenarbeit zweier Laboratorien, wobei in Cambridge und in Zürich im Laufe von rund 12 Jahren rund hundert Postdoktoranden und Doktoranden mitwirkten.[40]
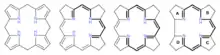
Nach Abschluss des Syntheseprojekts begann an der ETH eine systematische Suche nach „Dunkel-Varianten“ der photochemischen A/D-Secocorrin→Cyclosisomerisierung[35] im Hinblick auf die damals noch offene Frage nach der Entstehung des A/D-Strukturteils in der Biosynthese des Vitamins B12.[41] Dabei wurden eine ganze Reihe solch alternativer (A→D)-Cyclisierungen entdeckt,[42] was offenlegte, dass im A/D-Strukturteil ein sich besonders leicht konstituierendes Strukturelement des Vitamin-B12-Moleküls vorliegt: das Gegenteil dessen, was ursprünglich angenommen worden war! Dies markierte den Beginn experimenteller Untersuchungen zur Ätiologie der Vitamin-B12-Struktur.[43] Diese Untersuchungen erstreckten sich u. a. auf Strukturtypen neuer hexahydroporphinoider Ligandsysteme, deren Chromophorsysteme jenem des Corrins entsprechen: Corphin[44][45][46] und Pyrrocorphin.[47][48] Hexahydroporphinoide dieses Typs erlangten in der gerade damals in anderen Laboratorien angelaufenen Erforschung der Biosynthese[41] des Vitamins B12 aus Uroporphyrinogen III zentrale Bedeutung.
Ein neuartiges dihydrocorphinoides Ligandsystem wurde bei der durch die an der ETH in Zusammenarbeit mit dem Mikrobiologen Rudolf Thauer in Marburg durchgeführten Aufklärung der Struktur[49] des nickelhaltigen Coenzyms F430 aus methanogenen Bakterien entdeckt. Die Synthese einer Modellverbindung dieses Ligandsystems gelang mittels Methoden der Corrin-Synthetik.[50]
Ätiologie der Vitamin-B12-Struktur
Experimente zur Ätiologie einer Biomolekülstruktur gehen von der Frage aus: „Warum ist eine Biomolekülstruktur so und nicht anders konstitutiert?“ Fragen solcher Art können Experimente auslösen, die zu Annäherungen an eine Antwort führen. Die in Eschenmosers Studien zur Ätiologie der B12-Struktur[43][51][52] gemachten Beobachtungen relativieren die gemäss formaler Kriterien hohe Komplexität der Struktur durch den experimentell erbrachten Nachweis, dass die wichtigsten Strukturelemente des Vitamins B12 (Kohlenstoff/Stickstoff-Skelett, Chromophorsystem, Dimension des makrocyclischen Corrin-Rings, Muster der peripheren C-Methylgruppen, Anknüpfung der Nukleotidkette) ein ausgeprägtes Selbstkonstituierungs-Potential aufweisen. Chromophorsystem: Gemäss Modellstudien liegt das thermodynamische Gleichgewicht zwischen den hexahydroporphinoiden Ligandsystemen Porphyrinogen und Pyrrocorphin bei den freien Liganden auf der Seite des Porphyrinogens; letzteres isomerisiert jedoch in Gegenwart von Metall-Ionen via extensive Tautomerisierung zu entsprechenden Metall-Komplexen des Pyrrocorphins.[47] Corrin-Komplexe sind thermodynamisch stabiler als corphinoide Komplexe gleicher Chromphorstruktur: dies belegt eine thermisch ausgelöste Ligandsystem-Kontraktion eines entweder mit Nickel(II)- oder mit Dicyano-cobalt(III) koordinierten 20-Hydroxy-20-methyl-19,20-dihydrocorphinats zum entsprechenden 19-Acetyl-corrinat.[53] Dimension des Corrin-Rings: Die unterschiedlichen Dimension der Koordinationsräume[54] von corphinoiden (16-gliedriger Ring) und corrinoiden (15-gliedriger Ring) Ligandsystemen hat eine unterschiedliche Haftfestigkeit axialer Liganden in entsprechenden Ni(II)- und Dicyano-cobalt(III)-Komplexen zur Folge: Axial koordinierte Liganden in corrinoiden Metallkomplexen sind labiler als in entsprechenden corphinoiden Komplexen.[55][52][56] Dieser Unterschied ist für die Funktion des Coenzyms B12 im Sinne der Frage relevant: „Warum ist Vitamin B12 ein Corrin und nicht ein Corphin?“ Peripherie des Macrocyclus: Umsetzung von Zink- oder Magnesium-Pyrrocorphinaten mit Methylierungsagenzien führt zu C-Methylierung an der Makroringperipherie mit einer Regioselektivität, die an das in der B12-Struktur vorliegende Methylierungsmuster erinnert.[57][45] Anknüpfung des Nukleotids: Die für die Struktur des Vitamins B12 charakteristische Anknüpfungsstelle an der Propionsäure-Seitenkette im Ring D ist die unter allen vier konstitutionell analogen Anknüpfungsmöglichkeiten die thermodynamisch stabilste, bzw. die unter geeigneten Nukleotidierungsbedingungen sich selektiv bildende.[51][58]
Ätiologie des Strukturtyps der natürlichen Nukleinsäuren
Die den Untersuchungen zur Ätiologie der B12-Struktur zugrunde liegende Fragestellung „Warum so und nicht anders?“ übertrug Eschenmoser schliesslich auf den Strukturtyp der natürlichen Nukleinsäuren: „Warum Pentose- und nicht Hexose-Nukleinsäuren? Warum Furanose-RNA und nicht Pyranose-RNA?“.[59][60] Die Synthese und die systematische Prüfung des Paarungsverhalten synthetisch hergestellter, potentiell ebenfalls natürlicher Varianten des Strukturtyps der natürlichen Nukleinsäuren offenbarte die Tatsache, dass die Watson-Crick’sche Basenpaarung keine spezifische Eigenschaft der DNA und RNA ist: Alternative Systeme wie z. B. die Homo-DNA,[59] die Pyranose-RNA („p-RNA“)[61] oder die Threose-Nukleinsäure („TNA“)[62] sind ebenfalls informationstragende Oligomersysteme. Einige von ihnen zeigen sogar stärkere Basenpaarung als RNA, so z. B. „p-RNA“, die aus den gleichen Bausteinen aufgebaut ist wie RNA, jedoch den Ribose-Baustein in der Pyranose anstelle der Furanose-Form enthält. Duplexe von „p-RNA“-Basensequenzen weisen eine quasi-lineare Struktur auf und nicht eine helikale wie die RNA.[63] Demzufolge geht „p-RNA“ mit RNA keine Kreuzpaarung ein. Die „TNA“ hingegen, in welcher der Zucker-Baustein als Furanose vorliegt und die eine ähnliche Raumstruktur[64] aufweist wie RNA, zeigt ein ähnliches Paarungsverhalten auf wie RNA und zudem die Fähigkeit, sowohl mit RNA als auch mit DNA informationell zu paaren.[62] Für die „p-RNA“ wurde als Beispiel einer nichtenzymatischen, chiroselektiven Selbstkonstituierung von Oligonucleotid-Duplexen gezeigt, dass Tetranucleotid′-2′,3′-cylophosphate dieses Typs mit einer je zur Hälfte komplementären Sequenz der vier Nukleobasen (z. B. ATCG) imstande sind, spontan zu Duplexen höherer Oligomeren spezifischer Basensequenz zu oligomerisieren.[65][52]
Präbiotische Chemie
In der präbiotischen Chemie ist die mögliche abiotische Bildung wichtiger Biomoleküle wie Nukleotide, Zucker und Aminosäuren ein zentraler Themenbereich. Experimentelle Beiträge von Eschenmoser hierzu sind die Chemie des α-Amino-acrylonitrils[66] und des hieraus photochemisch sich bildenden 2-Cyano-aziridins,[67] und vor allem die Chemie des Glycolaldehyd-phosphats, dessen Bildung aus Glycolaldehyd in hochverdünnter wässeriger Lösung mit Amido-triphosphat,[68] und der Nachweis der bevorzugten Bildung von rac-Ribose-2,4-diphosphat bei dessen Aldolisierung unter basischen Bedingungen in Gegenwart von Formaldehyd.[69] In seinem Vorschlag eines „Glyoxylat-Scenarios“ hat Eschenmoser auf eine möglicherweise zentrale Rolle der Glyoxylsäure und deren „Dimeren“ Dihydroxy-fumarsäure für die Biogenese hingewiesen.[70]
Auszeichnungen (Auswahl)
Insgesamt hat Eschenmoser rund 30 nationale und internationale akademische Preise erhalten, darunter folgende:
- Ruzicka-Preis, ETH Zürich 1958
- Marcel-Benoist-Preis, Eidgenössisches Departement des Innern, Bern 1973
- Robert A. Welch Award, R.A. Welch Foundation, Houston TX 1974[71]
- August-Wilhelm-von-Hofmann-Denkmünze, Gesellschaft Deutscher Chemiker 1976
- Robert Robinson Award 1976
- Kirkwood Medal, Yale University (1976)
- Davy Medal, Royal Society, London 1978
- Tetrahedron-Preis, Pergamon Press, London 1981
- Arthur C. Cope Award, American Chemical Society 1984
- Wolf Prize in Chemistry, Wolf Foundation, Israel 1986
- Cothenius-Medaille, Deutsche Akademie der Naturforscher Leopoldina, Halle 1991
- Paracelsus-Preis, Schweizerische Chemische Gesellschaft 1999
- Grande médaille de l’Académie des sciences, Académie des Sciences, Paris 2001
- Oparin Medal, International Society for the Study of the Origin of Life (ISSOL) (2002)
- Roger Adams Award 2003
- Sir Derek H. Barton Gold Medal, Royal Society of Chemistry, London 2004
- Benjamin Franklin Medal, Franklin Institute, Philadelphia 2008
- Paul-Karrer-Medaille, Universität Zürich 2008[72]
Albert Eschenmoser ist Dr. h.c. der Universitäten Fribourg, Chicago, Edinburgh, Bologna, Frankfurt/Main, Strasbourg, Harvard, Innsbruck und des Scripps Research Institute (La Jolla, CA, U.S.A.).
Mitgliedschaften (Auswahl)
- American Academy of Arts and Sciences, Boston MA (Foreign Member, 1966)
- National Academy of Sciences, Washington, D.C. (Foreign Associate, 1973)
- Deutsche Akademie der Naturforscher Leopoldina, Halle (Mitglied, 1976)
- Pontificia Academia Scientiarum, Stato della Città del Vaticano (Mitglied, 1986)
- Akademie der Wissenschaften zu Göttingen (Korrespondierendes Mitglied, 1986)
- Royal Society, London (Foreign Member, 1986)
- Academia Europaea, London (Founding Member, 1988)
- Orden Pour le mérite für Wissenschaften und Künste, Berlin (Ausländisches Mitglied, 1992)
- Österreichisches Ehrenzeichen für Wissenschaft und Kunst, Wien (Ausländisches Mitglied, 1993)
- Hrvatska akademija znanosti i umjetnosti, Zagreb, Kroatien (Korrespondierendes Mitglied, 1994)
Literatur
Das wissenschaftliche Werk von Albert Eschenmoser ist inhaltlich ungewöhnlich breit gefächert und umfasst über 270 Publikationen: Albert Eschenmoser List of Scientific Publications. In: Heterocycles. Band 82, 2010, S. 31, doi:10.3987/COM-10-S(E)publications.
Literatur über Albert Eschenmoser:
- „Herr Woodward bedauert dass die Sache fertig ist“: Woodward und Eschenmoser über Vitamin B12 und die Situation der organischen Chemie (Interview). In: Nachrichten aus Chemie und Technik. Band 20, 1972, S. 147–150.
- D. Arigoni: Professor Albert Eschenmoser zum 60. Geburtstag. In: Chimia. Band 39, 1985, S. 336.
- W.R. Pötsch, A. Fischer, W. Müller, H.Cassebaum: Lexikon bedeutender Chemiker. Verlag Harri Deutsch, Thun 1989, ISBN 3-8171-1055-3, S. 140.
- V. Prelog: Albert Eschenmoser. In: Aldrichimica Acta. Band 23, 1990, S. 59–64.
- E. Zass: Hommage a Albert Eschenmoser. In: Chimia. Band 47, 1993, S. 154–159.
- E.J. Sorensen: Albert Eschenmoser. In: Helv. Chim. Acta. Band 83, 2000, S. 1673–1677, doi:10.1002/1522-2675(20000809)83:8<1673::AID-HLCA1673>3.0.CO;2-I.
- G. Quinkert: Preface. In: G. Quinkert, M.V. Kisakurek (Hrsg.): Hominatio: An International Tribute to Albert Eschenmoser. Verlag Helvetica Chimica Acta, Zürich 2001, ISBN 978-3-906390-27-7, VII–XIII, doi:10.1002/9783906390451.fmatter
- I. Hargittai: Albert Eschenmoser (Interview). In: M. Hargittai (Hrsg.): Candid Science III: More Conversations with Famous Chemists. Imperial College Press, London 2003, ISBN 978-1-86094-336-2, S. 79–108, doi:10.1142/9781848161344_0007
- N. Hall: The quest for the chemical roots of life. In: Chemical Communications (Cambridge, United Kingdom). 2004, S. 1247–1252, doi:10.1039/b401124b.
- Curriculum vitae Albert Eschenmoser. Band 82, 2010, S. 15–23, doi:10.3987/COM-10-S(E)CV.
- B. Kräutler: Congratulations To Professor Albert Eschenmoser On His 85th Birthday. In: Heterocycles. Band 82, 2010, S. 1–4, doi:10.3987/COM-10-S(E)Foreword_1.
- S.E. Denmark, E.J. Sorensen: Preface To Special Issue Of Heterocycles Honoring The 85th Birthday Of Prof. Dr. Albert Eschenmoser. In: Heterocycles. Band 82, 2010, S. 5–10, doi:10.3987/COM-10-S(E)Foreword_2.
- L. Weber: „Erfolgsmomente in der Forschung sind ausserordentlich lustvoll!“ Interview mit Albert Eschenmoser, neues Ehrenmitglied der SCG. In: Chimia. Band 64, 2010, S. 323–327, doi:10.2533/chimia.2010.323.
Weblinks
- Engelbert Zass: Eschenmoser, Albert. In: Historisches Lexikon der Schweiz. 21. November 2005.
- Prof. Dr. Albert Eschenmoser (Lebenslauf, ETH Zürich, Departement Chemie und Angewandte Biowissenschaften)
- Literatur von und über Albert Eschenmoser im Katalog der Deutschen Nationalbibliothek
- Zur Aetiologie des Strukturtyps der natürlichen Nukleinsäuren (Rudolf-Criegee-Vorlesung 2005, Universität Karlsruhe)
- Michael Marshall: The secret of how life on earth began, auf: BBC – Earth, vom 31. Oktober 2016
Einzelnachweise
- Albert Eschenmoser: Synthese von 2,5-Dimethyl-3-oxymethyl-heptadien-(1,5). Diplomarbeit, ETH Zürich 1948, doi:10.3929/ethz-a-006069807.
- Dr. Hans Schinz (1899–1990), ehemaliger Doktorand von Ruzicka, war bis zu seiner Emeritierung als Forschungschemiker der Firmenich Co., Genf im Ruzicka’schen Institut an der ETH Zürich tätig, wo er während des Krieges mit eigenen Doktoranden das Praktikum in organischer Chemie für Studenten der Naturwissenschaftlichen Abteilung betreute. Vgl. biographische Angaben über Hans Schinz in Helv. Chim. Acta. 93 (2010), 1439, doi:10.1002/hlca.201000255
- Albert Eschenmoser: Zur säurekatalysierten Zyklisierung bei Mono- und Sesquiterpenverbindungen. ETH Zürich 1952, doi:10.3929/ethz-a-000087828 (Promotionsarbeit Nr. 2018).
- Lebensdaten, Publikationen und Akademischer Stammbaum von Albert Jakob Eschenmoser bei academictree.org, abgerufen am 4. Februar 2018.
- Albert Eschenmoser: Zur Kenntnis Säurekatalysierter Cyclisationen von Polyenverbindungen der Terpenreihe. Habilitationsschrift, ETH Zürich 1956, doi:10.3929/ethz-a-006078807.
- Christian Noe auf scienceblog.at
- The Krishnamurthy Lab auf scripps.edu
- L. Ruzicka, A. Eschenmoser, H. Heusser: Biogenesis of Steroids and Terpenic Compounds. In: Experientia. Band 9, 1953, S. 362–366. in L. Ruzicka: Biogenesis of Steroids and Terpenic Compounds. In: Experientia. Band 9, 1953, S. 357–367.
- G. Gamboni, H. Schinz, A. Eschenmoser: Über den sterischen Verlauf der säurekatalysierten Cyclisation in der Terpenreihe. Cyclisation der cis-7-Methyloctadien-(2,6)-säure-(1). In: Helv. Chim. Acta. Band 37, Nr. 4, 1954, S. 964–971, doi:10.1002/hlca.19540370404.
- P.A. Stadler, A. Nechvatal, A.J. Frey, A. Eschenmoser: Untersuchungen über den sterischen Verlauf säurekatalysierter Cyclisationen bei terpenoiden Polyenverbindungen. Cyclisation der 7,11-Dimethy1-2(trans),6(trans), 10-dodecatrien- und der 7,11-Dimethyl-2(cis),6(trans), 10-dodecatrien-säure. In: Helv. Chim. Acta. Band 40, Nr. 5, 1957, S. 1373–1409, doi:10.1002/hlca.19570400527.
- A. Eschenmoser, L. Ruzicka, O. Jeger, D. Arigoni: Eine stereochemische Interpretation der biogenetischen Isoprenregel bei den Triterpenen. In: Helv. Chim. Acta. Band 38, Nr. 7, 1955, S. 1890–1904, doi:10.1002/hlca.19550380728.; A. Eschenmoser, D. Arigoni: Revisited after 50 Years: The ‘Stereochemical Interpretation of the Biogenetic Isoprene Rule for the Triterpenes’. In: Helv. Chim. Acta. Band 88, Nr. 12, 2005, S. 3011–3050, doi:10.1002/hlca.200590245.
- J. Schreiber, A. Eschenmoser: Über die relative Geschwindigkeit der Chromsäureoxydation sekundärer, alicyclischer Alkohole. In: Helv. Chim. Acta. Band 38, Nr. 6, 1955, S. 1529–1536, doi:10.1002/hlca.19550380627.
- L. Tenud, S. Farooq, J. Seibl, A. Eschenmoser: Endocyclische SN-Reaktionen am gesättigten Kohlenstoff? In: Helv. Chim. Acta. Band 53, Nr. 8, 1970, S. 2059–2069, doi:10.1002/hlca.19700530816.
- D. Felix, A. Eschenmoser: Slow Inversion at Pyramidal Nitrogen: Isolation of Diastereomeric 7-Chloro-7-azabicyclo-[4.1.0]heptanes at Room Temperature. In: Angewandte Chemie International Edition in English. Band 7, Nr. 3, 1968, S. 224–225, doi:10.1002/anie.196802241.
- K. Müller, A. Eschenmoser: Langsame Inversion am pyramidal gebundenen Stickstoff: Isolierung und Epimerisierung diastereomerer N-Methoxy-3,3-di-methoxycarbonyl-5-cyan-1,2-oxazolidine. In: Helv. Chim. Acta. Band 52, Nr. 7, 1969, S. 1823–1830, doi:10.1002/hlca.19690520707.
- A. Eschenmoser, A. Frey: Über die Spaltung des Mesylesters von 2-Methyl-2-oxymethyl-cyclopentanon mit Basen. In: Helv. Chim. Acta. Band 35, Nr. 5, 1952, S. 1660–1666, doi:10.1002/hlca.19520350532.
- A. Eschenmoser, D. Felix, G. Ohloff: Eine neuartige Fragmentierung cyclischer α,β-ungesättigter Carbonylsysteme; Synthese von Exalton und rac-Muscon aus Cyclododecanon. In: Helv. Chim. Acta. Band 50, Nr. 2, 1967, S. 708–713, doi:10.1002/hlca.19670500232.; D. Felix, R.K. Müller, U. Horn, R. Joos, J. Schreiber, A. Eschenmoser: α,β-Epoxyketon → Alkinon-Fragmentierung II: Pyrolytischer Zerfall der Hydrazone aus α,β-Epoxyketonen und N-Amino-aziridinen. Über synthetische Methoden, 4. Mitteilung. In: Helv. Chim. Acta. Band 55, Nr. 4, 1972, S. 1276–1319, doi:10.1002/hlca.19720550424.
- D. Sternbach, M. Shibuya, F. Jaisli, M. Bonetti, A. Eschenmoser: A Fragmentational Approach to Macrolides: (5-E, 8-Z)-6-methyl-5,8-undecadien-11-olide. In: Angew. Chem., Int. Ed. Engl. Band 18, Nr. 8, 1979, S. 634–636, doi:10.1002/anie.197906341.
- U.M. Kempe, T.K. Das Gupta, K. Blatt, P. Gygax, Dorothee Felix, A. Eschenmoser: α-Chlor-nitrone I: Darstellung und Ag+-induzierte Reaktion mit Olefinen. In: Helv. Chim. Acta. Band 55, Nr. 6, 1972, S. 2187–2198, doi:10.1002/hlca.19720550640.
- E.J. Corey, D. Seebach: Synthesis of 1,n-Dicarbonyl Derivates Using Carbanions from 1,3-Dithianes. In: Angew. Chem., Int. Ed. Engl. Band 4, Nr. 12, 1965, S. 1077–1078, doi:10.1002/anie.196510771.; D. Seebach: Methods of Reactivity Umpolung. In: Angew. Chem., Int. Ed. Engl. Band 18, Nr. 4, 1979, S. 239–258, doi:10.1002/anie.197902393.
- J. Schreiber, M. Pesaro, W. Leimgruber, A. Eschenmoser: Über eine neue Bildungsweise des Troponsystems. In: Helv. Chim. Acta. Band 41, Nr. 7, 1958, S. 2103–2108, doi:10.1002/hlca.19580410718.; D. Felix, P. Jakober, A. Eschenmoser: Alkali-induzierte Elimination von HBr in 5-Brom-β-jonon-Derivaten. In: Chimia. Band 19, 1965, S. 538.
- E. Bertele, H. Boos, J.D. Dunitz, F. Elsinger, A. Eschenmoser, I. Felner, H.P. Gribi, H. Gschwend, E.F. Meyer, M. Pesaro, R. Scheffold: A Synthetic Route to the Corrin System. In: Angew. Chem., Int. Ed. Engl. Band 3, Nr. 7, 1964, S. 490–496, doi:10.1002/anie.196404901.
- Y. Yamada, D. Miljkovic, P. Wehrli, B. Golding, P. Löliger, R. Keese, K. Müller, A. Eschenmoser: A New Type of Corrin Synthesis. In: Angew. Chem., Int. Ed. Engl. Band 8, 1969, S. 343–348, doi:10.1002/anie.196903431.
- M. Roth, P. Dubs, E. Götschi, A. Eschenmoser: Sulfidkontraktion via alkylative Kupplung: eine Methode zur Darstellung von β-Dicarbonylderivaten. In: Helv. Chim. Acta. Band 54, Nr. 2, 1971, S. 710–734, doi:10.1002/hlca.19710540229.
- A. Fischli, A. Eschenmoser: A Synthetic Route to Metal-free Corrins. In: Angew. Chem., Int. Ed. Engl. Band 6, Nr. 10, 1967, S. 866–868, doi:10.1002/anie.196708661.
- A. Wick, D. Felix, K. Steen, A. Eschenmoser: Claisen’sche Umlagerungen bei Allyl und Benzylalkoholen mit Hilfe von Acetalen des N,N-Dimethylacetamids. In: Helv. Chim. Acta. Band 47, Nr. 8, 1964, S. 2425–2429, doi:10.1002/hlca.19640470835.
- J. Schreiber, H. Maag, N. Hashimoto, A. Eschenmoser: Dimethyl(methylene)ammonium Iodide. In: Angew. Chem., Int. Ed. Engl. Band 10, Nr. 5, 1971, S. 330–331, doi:10.1002/anie.197103301.
- R.B. Woodward: The Total Synthesis of Vitamin B12. In: Pure Appl. Chem. Band 33, 1973, S. 145–178, doi:10.1351/pac197333010145.
- Eintrag zu Grob-Eschenmoser-Fragmentierung. In: Römpp Online. Georg Thieme Verlag, abgerufen am 30. April 2015.
- J. Schreiber, W. Leimgruber, M. Pesaro, P. Schudel, A. Eschenmoser: Synthese des Colchicins. In: Angew. Chem. Band 71, Nr. 20, 1959, S. 637–640, doi:10.1002/ange.19590712002.; J. Schreiber, W. Leimgruber, M. Pesaro, P. Schudel, T. Threlfall, A. Eschenmoser: Synthese des Colchicins. In: Helv. Chim. Acta. Band 44, Nr. 2, 1961, S. 540–597, doi:10.1002/hlca.19610440225.
- A. Eschenmoser: Roads to Corrins (Centenary Lecture). In: Q. Rev., Chem. Soc. Band 24, 1970, S. 366–415, doi:10.1039/qr9702400366. Umfassender Überblick im Helv. Chim. Acta Special Issue 11/12 Dec. 2012: A. Eschenmoser: Introductory Remarks on the Publication Series ‘Corrin Syntheses-Parts I-VI’. In: Helvetica Chimica Acta. Band 98, Nr. 11-12, 2015, S. 1475–1482, doi:10.1002/hlca.201400399. A. Eschenmoser: Corrin Syntheses. Part I. Introduction and Overview. In: Helvetica Chimica Acta. Band 98, Nr. 11–12, 2015, S. 1483–1600, doi:10.1002/hlca.201400277. R. Scheffold, E. Bertele, H. Gschwend, W. Häusermann, P. Wehrli, W. Huber, A. Eschenmoser: Corrin Syntheses. Part II. Synthesis of Corrin Complexes via A→B Ring Closure. Preparation of Hemicorrinoid B/C-Components, and Model Studies on Enamides and Imido Ester C,C Condensations. In: Helvetica Chimica Acta. Band 98, Nr. 11–12, 2015, S. 1601–1682, doi:10.1002/hlca.201200095. M. Pesaro, F. Elsinger, H. Boos, I. Felner-Cabogy, H. Gribi, A. Wick, H. Gschwend, A. Eschenmoser: Corrin Syntheses. Part III. Synthesis of Corrin Complexes via A→B Ring Closure. Preparation of A/D Components. In: Helvetica Chimica Acta. Band 98, Nr. 11–12, 2015, S. 1683–1754, doi:10.1002/hlca.201200308. E. Bertele, R. Scheffold, H. Gschwend, M. Pesaro, A. Fischli, M. Roth, J. Schossig, A. Eschenmoser: Corrin Syntheses. Part IV. Synthesis of Corrin Complexes via A→B Ring Closure. Coupling of Hemicorrinoid A/D und B/C Components to Corrin by Imido-ester-Enamine Condensations. In: Helvetica Chimica Acta. Band 98, Nr. 11–12, 2015, S. 1755–1844, doi:10.1002/hlca.201200342. H.-U. Blaser, E.-L. Winnacker, A. Fischli, B. Hardegger, D. Bormann, N. Hashimoto, J. Schossig, R. Keese, A. Eschenmoser: Corrin Syntheses. Part V. Preparation of Metal-Free Corrin Derivatives via A→B Ring Closure. Complexation of the Corrin Chromophore with Metal Ions, and Some Properties of the Ligands in Corrin Complexes. In: Helvetica Chimica Acta. Band 98, Nr. 11–12, 2015, S. 1845–1920, doi:10.1002/hlca.201300064. Y. Yamada, P. Wehrli, D. Miljkovic, H.-J. Wild, N. Bühler, E. Götschi, B. Golding, P. Löliger, J. Gleason, B. Pace, L. Ellis, W. Hunkeler, P. Schneider, W. Fuhrer, R. Nordmann, K. Srinivasachar, R. Keese, K. Müller, R. Neier, A. Eschenmoser: Corrin Syntheses. Part VI. Corrin Synthesis via A→D Ring Closure. The Construction of A/D-Secocorrin Chromophore Systems by the ‘Sulfide Contraction’ Method and the Photochemical A/B-Secocorrin→Corrin Cycloisomerization. In: Helvetica Chimica Acta. Band 98, Nr. 11–12, 2015, S. 1921–2054, doi:10.1002/hlca.201500012.
- Walter Fuhrer: Totalsynthese von Vitamin B-12: der photochemische Weg. ETH Zürich 1973, doi:10.3929/ethz-a-000086601 (Promotionsarbeit Nr. 5158).
- Eine Partialsynthese von Vitamin B12 aus Cobyrsäure war bereits 1960 durchgeführt worden: W. Friedrich, G. Gross, K. Bernhauer, P. Zeller: Synthesen auf dem Vitamin-B12-Gebiet. 4. Mitteilung Partialsynthese von Vitamin B12. In: Helvetica Chimica Acta. Band 43, 1960, S. 704–712, doi:10.1002/hlca.19600430314.
- Hans Maag: Totalsynthese von Vitamin B-12: Dicyano-Co(III)-Cobyrinsäure-Hexamethylester-f-Amid. ETH Zürich 1973, doi:10.3929/ethz-a-000085446 (Promotionsarbeit Nr. 5173).; Peter Schneider: Totalsynthese von Derivaten des Dicyano-cobalt(III)-5,15-bis-nor-cobyrinsäure-hepta-methylesters. ETH Zürich 1972, doi:10.3929/ethz-a-000090603 (Promotionsarbeit Nr. 4819).
- A. Eschenmoser: Studies on Organic Synthesis. In: 23rd Int. Congress of Pure and Applied Chemistry, Boston, Pure & Appl. Chem. Supplement Vol. 2, 1971, S. 69–106, doi:10.3929/ethz-a-010165162 (englisch).; A. Eschenmoser, "The Final Phase of the Harvard/ETH Collaboration on the Synthesis of Vitamin B12", in: A. Eschenmoser: Corrin Syntheses. Part I. Introduction and Overview. In: Helvetica Chimica Acta. Band 98, Nr. 11–12, 2015, S. 1483–1600, doi:10.1002/hlca.201400277., ch. 3 (pp. 1555-1574)
- A. Eschenmoser, C.E. Wintner: Natural Product Synthesis and Vitamin B12. In: Science (Washington, DC, U. S.). Band 196, Nr. 4297, 1977, S. 1410–1420, doi:10.1126/science.867037.
- R.B. Woodward: Revent Advances in the Chemistry of Natural Products. In: Pure Appl. Chem. Band 17, 1968, S. 519–547, doi:10.1351/pac196817030519.
- R.B. Woodward: Recent Advances in the Chemistry of Natural Products. In: Pure Appl. Chem. Band 25, 1971, S. 283–304, doi:10.1351/pac197125010283.
- A. Eschenmoser: Epilogue: Synthesis of Coenzyme B12: A Vehicle for the Teaching of Organic Chemistry. In: G. Quinkert, M.V. Kisakürek (Hrsg.): Essays in Contemporary Chemistry: From Molecular Structure towards Biology. Verlag Helvetica Chimica Acta, Weinheim 2001, S. 391–441, doi:10.1002/9783906390451.ch12.
- Diese Synthesen wurden nie im üblichen Detail publiziert; https://en.wiki.li/Vitamin_B12_total_synthesis bietet eine Übersicht über beide Synthesen und zur umfangreichen Literatur darüber: ausser publizierten Vorträgen von Eschenmoser und Woodward relevante (und frei als PDFs zugängliche) Dissertationen der Eschenmoser-Gruppe, die auch experimentelle Details enthalten.
- A.R. Battersby, E. McDonald: Biosynthesis of Porphyrins, Chlorins and Corrins. In: K.M. Smith (Hrsg.): Porphyrins and Metalloporphyrins. Elsevier Science Publishers, Amsterdam 1975, ISBN 978-0-444-41375-8, S. 61–122.; A.I. Scott: Tetrahedron report: Concerning the biosynthesis of vitamin B12. In: Tetrahedron. Band 31, Nr. 21, 1975, S. 2639–2653, doi:10.1016/0040-4020(75)80326-7.
- A. Pfaltz, N. Bühler, R. Neier, K. Hirai, A. Eschenmoser: Photochemische und nicht-photochemische A/D-Secocorrin→Corrin-Cyclisierungen bei 19-Carboxy- und 19-Formyl-1-methyliden-1,19-secocorrinaten. Decarboxylierbarkeit und Deformylierbarkeit von Nickel(II)-19-carboxy- bzw. 19-formyl-corrinaten. In: Helv. Chim. Acta 60. Band 60, Nr. 8, 1977, S. 2653–2672, doi:10.1002/hlca.19770600817.
- A. Eschenmoser: Post-B12 Problems in Corrin Synthesis (Robert Robinson Lecture). In: Chem. Soc. Rev. Band 5, 1976, S. 377–410, doi:10.1039/cs9760500377.
- A.P. Johnson, P. Wehrli, R. Fletcher, A. Eschenmoser: Corphin, a Corrinoid-Porphinoid Ligand System. In: Angew. Chem., Int. Ed. Engl. Band 7, Nr. 8, 1968, S. 623–625, doi:10.1002/anie.196806231.; P.M. Müller, S. Farooq, B. Hardegger, W.S. Salmond, A. Eschenmoser: Metal-Free Derivatives of the Corphin Ligand System. In: Angew. Chem., Int. Ed. Engl. Band 12, Nr. 11, 1973, S. 914–916, doi:10.1002/anie.197309141.
- A. Eschenmoser: Chemistry of Corphinoids. In: Ann. N. Y. Acad. Sci. Band 471, 1986, S. 108–129, doi:10.1111/j.1749-6632.1986.tb48030.x.
- Eintrag zu Corphin(e). In: Römpp Online. Georg Thieme Verlag, abgerufen am 30. April 2015.
- R. Waditschatka, A. Eschenmoser: The Chemistry of Pyrrocorphins: Stereoselectivity in the Porphyrinogen → Pyrrocorphin Tautomerization. In: Angew. Chem., Int. Ed. Engl. Band 22, Nr. 8, 1983, S. 630–631, doi:10.1002/anie.198306301.
- R. Schwesinger, R. Waditschatka, J. Rigby, R. Nordmann, W.B. Schweizer, E. Zass, A. Eschenmoser: Das Pyrrocorphin-Ligandsystem: Synthese des 2,2,7,7,12,12,17-Heptamethyl-2,3,7,8,12,13-hexahydroporphyrins. In: Helv. Chim. Acta. Band 65, Nr. 2, 1982, S. 600–610, doi:10.1002/hlca.19820650220.
- A. Pfaltz, B. Jaun, A. Fässler, A. Eschenmoser; R. Jaenchen, H.H. Gilles, G. Diekert, R.K. Thauer: Zur Kenntnis des Faktors F430 aus methanogenen Bakterien: Struktur des porphinoiden Ligandsystems. In: Helv. Chim. Acta. Band 65, Nr. 3, 1982, S. 828–865, doi:10.1002/hlca.19820650320.
- A. Fässler, A. Pfaltz, B. Kräutler, A. Eschenmoser: Chemistry of Corphinoids: Synthesis of a Nickel(II) Complex Containing the Chromophore System of Coenzyme F430. In: J. Chem. Soc., Chem. Commun. Nr. 20, 1984, S. 1365–1367, doi:10.1039/C39840001365.
- A. Eschenmoser: Vitamin B12: Experiments Concerning the Origin of its Molecular Structure. In: Angew. Chem., Int. Ed. Engl. Band 27, Nr. 1, 1988, S. 5–39, doi:10.1002/anie.198800051.
- A. Eschenmoser: Etiology of Potentially Primordial Biomolecular Structures: From Vitamin B12 to the Nucleic Acids and an Inquiry into the Chemistry of Life’s Origin: a Retrospective. In: Angew. Chem., Int. Ed. Band 50, Nr. 52, 2011, S. 12412–12472, doi:10.1002/anie.201103672.
- V. Rasetti, A. Pfaltz, C. Kratky, A. Eschenmoser: Ring Contraction of Hydroporphinoid to Corrinoid Complexes. In: Proc. Natl. Acad. Sci. U. S. A. Band 78, Nr. 1, 1981, S. 16–19, doi:10.1073/pnas.78.1.16.; V. Rasetti, K. Hilpert, A. Fässler, A. Pfaltz, A. Eschenmoser: The Dihydrocorphinol → Corrin Ring Contraction: A Potentially Biomimetic Mode of Formation of the Corrin Structure. In: Angew. Chem., Int. Ed. Engl. Band 20, Nr. 12, 1981, S. 1058–1060, doi:10.1002/anie.198110581.
- C. Kratky; R. Waditschatka, C. Angst, J.E. Johansen, J.C. Plaquevent, J. Schreiber, A. Eschenmoser: Die Sattelkonformation der hydroporphinoiden Nickel(II)-Komplexe: Struktur, Ursprung und stereochemische Konsequenzen. In: Helv. Chim. Acta. Band 68, Nr. 5, 1985, S. 1312–1337, doi:10.1002/hlca.19850680526.
- C. Kratky, A. Fässler, A. Pfaltz, B. Kräutler, B. Jaun, A. Eschenmoser: Chemistry of Corphinoids: Structural Properties of Corphinoid Nickel(II) Complexes related to Coenzme F430. In: J. Chem. Soc., Chem. Commun. Nr. 20, 1984, S. 1368–1371, doi:10.1039/C39840001368.
- Kaspar Zimmermann: Vergleichende Untersuchungen an Cobaltcorphin- und Cobaltcorrinkomplexen. ETH Zürich 1989, doi:10.3929/ethz-a-000541314 (Promotionsarbeit Nr. 9038).
- R. Waditschatka, E. Diener, A. Eschenmoser: The Chemistry of Pyrrocorphins: C-Methylation of Pyrrocorphinates at the Ligand Periphery. In: Angew. Chem., Int. Ed. Engl. Band 22, Nr. 8, 1983, S. 631–632, doi:10.1002/anie.198306311.; C. Leumann, K. Hilpert, J. Schreiber, A. Eschenmoser: Chemistry of Pyrrocorphins: C-Methylations at the Periphery of Pyrrocorphins and Related Corphinoid Ligand Systems. In: J. Chem. Soc., Chem. Commun. Nr. 23, 1983, S. 1404–1407, doi:10.1039/C39830001404.
- Fritz Kreppelt: Regioselektive Rekonstituierung von Vitamin B12 durch Nukleotidierung von Cobyrinsaure-heptakis(cyanmethyl)ester. ETH Zürich 1991, doi:10.3929/ethz-a-000626280 (Promotionsarbeit Nr. 9458).
- J. Hunziker, H.-J. Roth, M. Böhringer, A. Giger, U. Diederichsen, M. Göbel, R. Krishnan, B. Jaun, C. Leumann, A. Eschenmoser: Warum Pentose- und nicht Hexose-Nucleinsäuren? Teil III. Oligo(2',3'-dideoxy-β-D-glucopyranosyl)nucleotide ('Homo-DNS'): Paarungseigenschaften. In: Helv. Chim. Acta. Band 76, 1993, S. 259–352, doi:10.1002/hlca.19930760119.
- A. Eschenmoser: Chemical Etiology of Nucleic Acid Structure. In: Science (Washington, DC, U. S.). Band 284, Nr. 5423, 1999, S. 2118–2124, doi:10.1126/science.284.5423.2118.; A. Eschenmoser: Warum Pentose- und nicht Hexose-Nucleinsäuren? In: Nachr. Chem., Tech. Lab. Band 39, Nr. 7-8, 1991, S. 795–807, doi:10.1002/nadc.19910390707.
- S. Pitsch, S. Wendeborn, B. Jaun, A. Eschenmoser: Why Pentose- and not Hexose- Nucleic Acids? Pyranosyl-RNA ("p-RNA"). In: Helv. Chim. Acta. Band 76, Nr. 6, 1993, S. 2161–2183, doi:10.1002/hlca.19930760602.; M. Beier, F. Reck, T. Wagner, R. Krishnamurthy, A. Eschenmoser: Chemical Etiology of Nucleic Acid Structure: Comparing Pentopyranosyl-(2'&rarr4') Oligonucleotides with RNA. In: Science (Washington, DC, U. S.). Band 283, Nr. 5402, 1999, S. 699–703, doi:10.1126/science.283.5402.699.
- K.-U. Schöning, P. Scholz, S. Guntha, X. Wu, R. Krishnamurthy, A. Eschenmoser: Chemical Etiology of Nucleic Acid Structure: The α-Threofuranosyl-(3'→2')Oligonucleotide System. In: Science (Washington, DC, U. S.). Band 290, Nr. 5495, 2000, S. 1347–1351, doi:10.1126/science.290.5495.1347.; K.-U. Schöning, P. Scholz, X.Wu, S. Guntha, G. Delgado, R. Krishnamurthy, A. Eschenmoser: The α-L-Threofuranosyl-(3'-2')-oligonucleotide System ('TNA'): Synthesis and Pairing Properties. In: Helv. Chim. Acta. Band 85, Nr. 12, 2002, S. 4111–4153, doi:10.1002/hlca.200290000.
- I. Schlönvogt, S. Pitsch, C. Lesueur, A. Eschenmoser, B. Jaun, R. M. Wolf: Pyranosyl-RNA ('p-RNA'): NMR and Molecular-Dynamics Study of the Duplex Formed by Self-pairing of Ribopyranosyl-(C-G-A-A-T-T-C-G). In: Helv. Chim. Acta. Band 79, Nr. 8, 1996, S. 2316–2345, doi:10.1002/hlca.19960790820.
- M.-O. Ebert, C. Mang, R. Krishnamurthy, A. Eschenmoser, B. Jaun: The Structure of a TNA-TNA Complex in Solution: NMR Study of the Octamer Duplex Derived from α-(L)-Threofuranosyl-(3’→2’)-CGAATTCG. In: J. Am.Chem. Soc. Band 130, 2008, S. 15105–15115, doi:10.1021/ja8041959.
- M. Bolli, R. Micura, A. Eschenmoser: Pyranosyl-RNA: Chiroselective Self-assembly of Base Sequences by Ligative Oligomerization of Tetranucleotide-2',3'-cyclophosphates (with a Commentary Concerning the Origin of Biomolecular Homochirality). In: Chem. Biol. (Oxford, U. K.). Band 4, Nr. 4, 1997, S. 309–320, doi:10.1016/S1074-5521(97)90074-0.
- G. Ksander, G. Bold, R. Lattmann, C. Lehmann, T. Früh, Y.-B. Xiang, K. Inomata, H.-P. Buser, J.Schreiber, E. Zass, A. Eschenmoser: Chemie der α-Aminonitrile. 1. Mitt.: Einleitung und Wege zu Uroporphyrinogen-octanitrilen. In: Helv. Chim. Acta. Band 70, Nr. 4, 1987, S. 1115–1172, doi:10.1002/hlca.19870700424.
- S. Drenkard, J. Ferris, A. Eschenmoser: Chemie von α-Aminonitrilen. Aziridin-2-carbonitril: photochemische Bildung aus 2-Aminopropennitril. In: Helv. Chim. Acta. Band 73, Nr. 5, 1990, S. 1373–1390, doi:10.1002/hlca.19900730524.
- R. Krishnamurthy, G. Arrhenius, A. Eschenmoser: Formation of Glycolaldehyde Phosphate from Glycolaldehyde in Aqueous Solution. In: Origins Life Evol. Biospheres. Band 29, 1999, S. 333.; R. Krishnamurthy, S. Guntha, A. Eschenmoser: Regioselective α-Phosphorylation of Aldoses in Aqueous Solution. In: Angew. Chem., Int. Ed. Band 39, 2000, S. 2281–2285, doi:10.1002/1521-3773(20000703)39:13<2281::AID-ANIE2281>3.0.CO;2-2.
- D. Müller, S. Pitsch, A. Kittaka, E. Wagner, C.E. Wintner, A. Eschenmoser: Chemie von α-Aminonitrilen. Aldomerisierung von Glykolaldehyd-phosphat zu racemischen Hexose-2,4,6-triphosphaten und (in Gegenwart von Formaldehyd) racemischen Pentose-2,4-diphosphaten: rac-Allose-2,4,6-triphosphat und rac-Ribose-2,4-diphosphat sind die Reaktionshauptprodukte. In: Helv. Chim. Acta. Band 73, Nr. 5, 1990, S. 1410–1468, doi:10.1002/hlca.19900730526.
- A. Eschenmoser: The Search for the Chemistry of Life’s Origin. In: Tetrahedron. Band 63, Nr. 52, 2007, S. 12821–12844, doi:10.1016/j.tet.2007.10.012.
- A. Eschenmoser: On Organic Natural Product Synthesis and Vitamin B12 (R.A. Welch Award Address). In: Proc. Robert A. Welch Found. Conf. Chem. Res. Band 18, 1974, S. 269.
- A. Eschenmoser: Naturstoff-Strukturen hinterfragen. In: Helv. Chim. Acta. Band 93, Nr. 8, 2010, S. 1439–1499, doi:10.1002/hlca.201000255.