Corrin
Corrin ist ein heterocyclisches Ringsystem, verwandt mit dem Porphyrin-Ring im Hämoglobin. Er besteht aus vier reduzierten Pyrrol-Untereinheiten (Tetrapyrrol), die auf drei Seiten über je eine –C(CH)= Methin-Brücke und auf einer Seite direkt verbunden sind. Verglichen mit Porphyrin fehlt somit eine Methin-Brücke zwischen zwei Pyrrolen.
| Strukturformel | ||||||||||
|---|---|---|---|---|---|---|---|---|---|---|
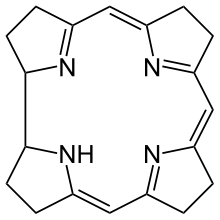 | ||||||||||
| Allgemeines | ||||||||||
| Name | Corrin | |||||||||
| Andere Namen |
CRN | |||||||||
| Summenformel | C19H22N4 | |||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||
| ||||||||||
| Eigenschaften | ||||||||||
| Molare Masse | 306,41 g·mol−1 | |||||||||
| Sicherheitshinweise | ||||||||||
| ||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | ||||||||||
Die Corrin-Ringstruktur ist die zentrale Komponente im Cobalt-haltigen Vitamin B12 (Cyanocobalamin). Sie hat ähnliche Eigenschaften wie der 18π-Aromat[2] Porphyrin, ist jedoch
- beweglicher,
- nicht so eben wie Porphyrin und
- verfügt mit einer fehlenden Methin-Brücke und fehlender Doppelbindungen nicht über aromatische Eigenschaften.
Corrinoide
Verbindungen, die Corrin als Grundgerüst enthalten, werden Corrinoide genannt. Fast alle natürlichen, metallhaltigen Corrinoide enthalten ein zentrales Cobaltatom, wohingegen die verwandten Porphyrine verschiedene Metalle enthalten können (wie Platin, Nickel, Cobalt, Kupfer, Eisen, Zink und Magnesium). Aus phototrophen Bakterien wurden metallfreie Corrinoide isoliert. Corrinoide werden nur von Mikroorganismen produziert.
Biosynthese
Der Genus Propionibakterium synthetisiert verschiedene Corrinoide ausgehend von 5-Aminolävulinsäure (5-ALA). Diese wird zum Porphobilinogen (PBG) dimerisiert. Vier PBG-Einheiten werden zu verschiedenen Uroporphyrinogenen (UPG I, II, III) verknüpft, die mittels des Enzyms Uroporphyrinogen-III-Methyltransferase methyliert werden. Danach entsteht in einer Kette von ca. 30 Reaktionsschritten aus UPG ein biologisch aktives Corrinoid wie z.Bsp. das Cobalamin.[3] Viele höhere Lebewesen wie Wirbeltiere, einige Mollusken sowie wenige Crustaceen und Insekten synthetisieren auf einem ähnlichen Weg das strukturell verwandte, aber Eisen statt Cobalt enthaltende Hämoglobin; ihnen fehlt die Möglichkeit, die Methinbrücke zwischen den beiden in Corrinoiden direkt verbundenen Pyrrol-Untereinheiten zu entfernen.
Quellen
- Dieser Stoff wurde in Bezug auf seine Gefährlichkeit entweder noch nicht eingestuft oder eine verlässliche und zitierfähige Quelle hierzu wurde noch nicht gefunden.
- Eintrag zu Porphyrine. In: Römpp Online. Georg Thieme Verlag, abgerufen am 8. Juli 2012.
- Lena I. Vorobjeva: Propionibacteria. Springer, 1999, ISBN 0-7923-5884-8, S. 160–161; eingeschränkte Vorschau in der Google-Buchsuche.