Methionin-Synthase
Die Methionin-Synthase (Gen: MTR, auch als Homocystein-Methyltransferase bekannt) katalysiert den letzten Schritt in der Regeneration von Methionin (Met) aus Homocystein (Hcy) mithilfe des Cofaktors Methylcobalamin bzw. Vitamin B12.
| N5-Methyl-Tetrahydrofolat-Homocystein-S-Methyltransferase | ||
|---|---|---|
 | ||
| Eigenschaften des menschlichen Proteins | ||
| Masse/Länge Primärstruktur | 1227 Aminosäuren | |
| Bezeichner | ||
| Gen-Name | MTR | |
| Externe IDs | ||
| Enzymklassifikation | ||
| EC, Kategorie | 2.1.1.13, Transferase | |
| Substrat | 5-Methyltetrahydrofolat, L-Homocystein | |
| Produkte | Tetrahydrofolsäure, L-Methionin | |
| Vorkommen | ||
| Homologie-Familie | HOG000251409 | |
| Übergeordnetes Taxon | Lebewesen | |
Methionin ist eine essentielle Aminosäure, die vom menschlichen Körper nicht de novo synthetisiert wird. Sie ist Ausgangssubstanz für S-Adenosylmethionin, welches eine wichtige Quelle für aktive Methylgruppen darstellt.[1]
Eine Fehlfunktion der Methionin-Synthase scheint auch Ursache für Neuralrohrdefekte zu sein.[2]
Funktion
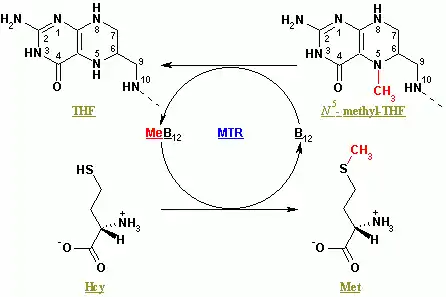
Literatur
- Y. N. Li, S. Gulati, P. J. Baker, L. C. Brody, R. Banerjee, W. D. Kruger: Cloning, mapping and RNA analysis of the human methionine synthase gene. In: Hum Mol Genet. 5 (12), Dezember 1996, 1851–1858. doi:10.1093/hmg/5.12.1851. PMID 8968735.
- R. V. Banerjee, R. G. Matthews: Cobalamin-dependent methionine synthase. In: FASEB J. 4 (5), März 1990, S. 1450–1459. PMID 2407589.
- T. M. Zydowsky: Stereochemical analysis of the methyl transfer catalyzed by cobalamin-dependent methionine synthase from Escherichia coli B. In: Journal of the American Chemical Society. 108 (11), 1986, S. 3152–3153. doi:10.1021/ja00271a081.
- Z. Zhang, C. Tian, S. Zhou, W. Wang, Y. Guo, J. Xia, Z. Liu, B. Wang, X. Wang, B. T. Golding, R. J. Griff, Y. Du, J. Liu: Mechanism-based design, synthesis and biological studies of N5-substituted tetrahydrofolate analogs as inhibitors of cobalamin-dependent methionine synthase and potential anticancer agents. In: European Journal of Medicinal Chemistry. 58, 2012, S. 228–236. doi:10.1016/j.ejmech.2012.09.027. PMID 23124219.
- R. G. Matthews, A. E. Smith, Z. S. Zhou, R. E. Taurog, V. Bandarian, J. C. Evans, M. Ludwig: Cobalamin-Dependent and Cobalamin-Independent Methionine Synthases: Are There Two Solutions to the Same Chemical Problem? In: Helvetica Chimica Acta. 86 (12), 2003, S. 3939. doi:10.1002/hlca.200390329.
- K. R. Wolthers, N. S. Scrutton: Protein Interactions in the Human Methionine Synthase-Methionine Synthase Reductase Complex and Implications for the Mechanism of Enzyme Reactivation. In: Biochemistry. 46 (23), 2007, S. 6696–6709. doi:10.1021/bi700339v. PMID 17477549.
- R. Pejchal, M. L. Ludwig: Cobalamin-Independent Methionine Synthase (MetE): A Face-to-Face Double Barrel That Evolved by Gene Duplication. In: PLoS Biology. 3 (2), 2005, S. e31. doi:10.1371/journal.pbio.0030031. PMC 539065 (freier Volltext). PMID 15630480.
- J. C. Evans, D. P. Huddler, M. T. Hilgers, G. Romanchuk, R. G. Matthews, M. L. Ludwig: Inaugural Article: Structures of the N-terminal modules imply large domain motions during catalysis by methionine synthase. In: Proceedings of the National Academy of Sciences 101 (11), 2004, S. 3729–3736. doi:10.1073/pnas.0308082100. PMC 374312 (freier Volltext). PMID 14752199.
- H. Hesse, R. Hoefgen: Molecular aspects of methionine biosynthesis. In: Trends in Plant Science. 8 (6), 2003, S. 259–262. doi:10.1016/S1360-1385(03)00107-9. PMID 12818659.
- O. Outteryck, J. De Sèze, T. Stojkovic, J. -M. Cuisset, D. Dobbelaere, S. Delalande, A. Lacour, M. Cabaret, A.-C. Lepoutre, V. Deramecourt, H. Zéphir, B. Fowler, P. Vermersch: Methionine synthase deficiency: A rare cause of adult-onset leukoencephalopathy. In: Neurology. 79 (4), 2012, S. 386–388. doi:10.1212/WNL.0b013e318260451b. PMID 22786600.
Einzelnachweise
- Holger Hesse, Rainer Hoefgen: Molecular aspects of methionine biosynthesis. In: Trends in Plant Science. Band 8, Nr. 6, Juni 2003, S. 259, doi:10.1016/S1360-1385(03)00107-9 (englisch).
- Eintrag zu Neuralrohr-Defekte. In: Römpp Online. Georg Thieme Verlag, abgerufen am 3. März 2015.
This article is issued from Wikipedia. The text is licensed under Creative Commons - Attribution - Sharealike. The authors of the article are listed here. Additional terms may apply for the media files, click on images to show image meta data.