Vitamin K
K-Vitamine (K für Koagulation) gehören neben den Vitaminen A, D und E zu den fettlöslichen Vitaminen und werden unter dem Sammelbegriff Vitamin K zusammengefasst. Sie sind ein Kofaktor in Reaktionen der γ-Glutamylcarboxylase. Über diesen Mechanismus werden mehrere Gerinnungsfaktoren in einen aktivierbaren Zustand versetzt (Aktivierung später proteolytisch) und gerinnungshemmende Faktoren aktiviert und reguliert.
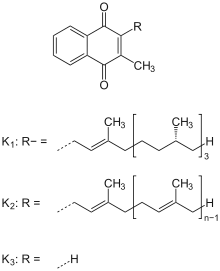
Vitamin K1 = Phyllochinon.
Vitamin K2 = Menachinon-n.
Vitamin K3 = Menadion
Ferner spielen K-Vitamine für die Aktivierung von Osteocalcin (ein Knochenprotein), Calbindin und der Liganden für einige Rezeptor-Tyrosinkinasen wie zum Beispiel das Growth-arrest-specific gene-6 eine wichtige Rolle für das Zellwachstum.
In Pflanzen ist Vitamin K1 für die Photosynthese unverzichtbar.
Geschichte
Die Existenz eines „Vitamins K“ wurde durch den dänischen Forscher Carl Peter Henrik Dam postuliert, nachdem ihm 1929 bei Untersuchungen zur Cholesterinsynthese von Küken aufgefallen war, dass es bei diesen durch die dabei verabreichte besondere cholesterinfreie Diät nach mehr als zwei bis drei Wochen zu Blutungen unter der Haut sowie in Muskeln und anderen Organen kam. Dass diese Erscheinungen durch einen Mangel an Vitamin A, D, B1, B2 oder C, Fetten oder Cholesterin selbst entstünden, konnte er mit seinen Arbeiten ausschließen.[1]
1931 berichteten kanadische Forscher (McFarlane u. a.) am Ontario Agricultural College anlässlich von Untersuchungen zum Vitamin-A- und -D-Bedarf von Hühnern über Blutungen und eine verzögerte Blutgerinnung, als sie diese an den Flügeln markierten, gingen dieser Beobachtung jedoch nicht weiter nach.
1933 fanden zwei US-amerikanische Forscher (Holst und Halbrook) an der University of California heraus, dass diese Blutungsneigung bei Küken durch Verfüttern von frischem Kohl verhindert werden konnte, führten dies aber fälschlicherweise auf einen Mangel an Vitamin C zurück.
Nachdem bald darauf auch reines Vitamin C zur Verfügung stand, verabreichte Dam den Hühnern dieses parenteral, um noch auszuschließen, dass eine beeinträchtigte Resorption aus dem Verdauungstrakt (als Folge einer durch die Diät gestörten Darmfunktion) für die Blutungen verantwortlich gemacht werden könne. Und nachdem die Verfütterung von Weizenkeimöl keinen Schutz bot, andererseits die Verabreichung von Getreidekörnern und Samen die Gerinnungsstörung verhinderte, fühlte er sich 1934 berechtigt, den Mangel einer bestimmten, wenn auch noch unbekannten Substanz in der Nahrung für die beobachteten Probleme verantwortlich zu machen.
Weitere Fütterungsversuche folgten und 1935 wurde diese Substanzgruppe schließlich als ein essentielles Vitamin mit lipophilen Eigenschaften erkannt. Der Buchstabe K wurde ursprünglich der Einfachheit halber gewählt, weil das Fehlen dieser Substanz eine ausreichende Ko-agulationfähigkeit (Gerinnung) des Blutes behinderte.[2] Die chemische Struktur von Vitamin K wurde kurze Zeit später von Almquist und Stokstad an der University of California in Berkeley aufgeklärt.
1943 erhielten Henrik Dam für die Entdeckung sowie Edward Adelbert Doisy für die Strukturaufklärung dieser Vitamingruppe gemeinsam den Nobelpreis für Medizin.[3]
Vertreter
Alle Substanzen mit Vitamin-K-Wirksamkeit leiten sich chemisch vom natürlich nicht vorkommenden 2-Methyl-1,4-Naphthochinon (Menadion) ab. Voraussetzungen für die Vitamin-K-Aktivität sind neben dem unsubstituierten, aromatischen Ring die Methylgruppe; die lipophile Seitenkette (die je nach K-Vitamin unterschiedlich lang sein kann) bestimmt die Fettlöslichkeit und andere Eigenschaften.[4] Optimal sind natürliche Terpenketten mit 20 Kohlenstoffatomen. Seitenketten unter 8 Kohlenstoffatomen führen außer bei Menadion zur Inaktivität. Es sind bis zu 100 Verbindungen mit Vitamin-K-Wirksamkeit bekannt.
Von praktischer Bedeutung im (menschlichen) Stoffwechsel sind nur das Vitamin K1 und K2. Andere 1,4-Naphthochinone haben wegen nachteiliger, z. T. toxischer Effekte keine praktische Bedeutung.
- Vitamin K1 bzw. Phyllochinon kommt in unterschiedlichen Konzentrationen in den Chloroplasten der Grünpflanzen als normaler Bestandteil des Photosyntheseapparates vor und zum Teil in deren Früchten.
- Vitamin K2 bzw. Menachinon wird von Bakterien (z. B. von einigen Stämmen von Escherichia coli oder Bacteroides fragilis) auch im Darm des Menschen produziert. Es kann laut neuerer Studien vom Menschen und höheren Tieren in limitierten Mengen aus dem Phyllochinon synthetisiert werden.[5] Die zumeist vorkommende Form ist Menachinon-4 (im obigen Bild wäre dann n=4). Verglichen mit den anderen Vitamin-K-Analoga hat Menachinon-4 die potenteste γ-Carboxylierungsaktivität.
- Vitamin K3 bzw. Menadion ist eine synthetisch hergestellte Substanz ohne Seitenkette (diese wird vom menschlichen Organismus nach der Aufnahme ergänzt). Das wasserunlösliche Vitamin K3 wurde früher in Form des wasserlöslichen Hydrogensulfit-Adukts als künstliches „Provitamin K“ angewandt.
Resorption und Stoffwechsel
Aufgrund der Hitzestabilität der Vitamin-K-Gruppe treten beim Zubereiten, insbesondere beim Garen nur wenig Vitaminverluste auf. Vitamin K ist auch gegenüber Sauerstoff stabil. Unter Einstrahlung von Licht wird Vitamin K inaktiv und verliert schnell seine Bioverfügbarkeit.
Das mit der Nahrung aufgenommene fettlösliche Vitamin K wird unter Mitwirkung von Gallensäure und Pankreaslipase als Emulgatoren durch aktiven Transport in die Mukosazellen des oberen Dünndarms (Jejunum) zu 20–70 % aufgenommen. Vitamin K2 gelangt dagegen durch Diffusion in das Darmgewebe.[4] Von den Mukosazellen des Jejunums gelangt Vitamin K, an Chylomikronen und andere Lipoproteine gebunden, über die Lymphe in den Ductus thoracicus, von dort in das Blut und über das Blut schließlich in die Gewebe, in denen es verwendet wird (z. B. Leber). Hier kann eine Speicherung bis zu 14 Tagen erfolgen. Im Nabelschnurblut findet sich kein Vitamin K, es wird kaum diaplazentar übertragen. Der fetale Vitamin-K-Vorrat in der Leber beträgt ein Fünftel dessen eines älteren Kindes oder eines Erwachsenen.

Im Endoplasmatischen Retikulum wird das Vitamin-K-Chinon zu seiner biologisch aktiven Form, dem Vitamin-K-Hydrochinon (auch: Vitamin KH2) hydroxyliert (reduziert). Bei der γ-Carboxylierungsreaktion wirkt das aktivierte Vitamin KH2 als Kofaktor der γ-Glutamylcarboxylase und wird zu einem Vitamin-K-2,3-Epoxid umgewandelt, während die Glutaminsäure des Proteins mittels CO2 und Energie aus ATP zur γ-Carboxy-Glutaminsäure carboxyliert wird.
γ-Carboxy-Glutaminsäure ist eine nicht-kanonische Aminosäure, sie besitzt als funktionelle Gruppe eine Malonsäurestruktur. Malonsäure ist eine Dicarbonsäure, ihre beiden Carboxylgruppen besitzen gerade den Abstand zueinander, dass sie mit Ca2+-Ionen Chelatkomplexe bilden können.[6] Diese Chelat-Bildungs-Fähigkeit ist Voraussetzung der Blutgerinnung. γ-Carboxy-Glutaminsäure ist sogar eine Tricarbonsäure.
Das Epoxid des Vitamin K wird anschließend mittels Vitamin-K-Epoxid-Reduktase (kurz: VKOR) zum Chinon des Vitamin K zurückverwandelt und der Zyklus kann von Neuem beginnen.
Die biologische Aktivität von Vitamin K ist also auf seine Fähigkeit zurückzuführen, zwischen seinen oxidierten (Chinon) und reduzierten (Hydrochinon) Formen im Vitamin-K-Zyklus zu wechseln. Die Epoxidreduktase und die Vitamin-K-Reduktase können durch die gerinnungshemmenden Medikamente Dicoumarol, Marcumar und Warfarin inhibiert werden.
Die K-Vitamine werden zu 50 % glucuronidiert via Galle über den Stuhl und zu 20 % in wasserlöslicher Form via Nieren über den Urin wieder ausgeschieden.[4]
Das Allel des Apolipoproteins E2 scheint ein Risikofaktor für die Entwicklung eines Vitamin-K-Mangels zu sein.[7]
Funktionen beim Menschen
Die wesentliche Bedeutung von Vitamin K liegt in seinem Beitrag zur posttranslationalen Einführung einer Carboxygruppe in die γ-Position von Glutamylresten bestimmter Proteine, wodurch diese aktiviert werden. Bisher sind vierzehn Proteine bekannt, die über eine γ-Carboxy-Glutaminsäure verfügen und für deren Synthese daher Vitamin K notwendig ist. Davon sind sechs Proteine mit dem Blut-Gerinnungssystem verbunden.
Für Vitamin K2 ist inzwischen eine essenzielle Funktion als Elektronentransporter in den Mitochondrien nachgewiesen.[8]
Blutgerinnung
Vitamin K ist daran beteiligt, die Gerinnungsfaktoren II (Prothrombin), VII (Proconvertin), IX (Christmas-Faktor) und X (Stuart-Prower-Faktor) in ihre gerinnungswirksamen Formen zu überführen. Diese können dann durch ihre Carboxyglutamatreste in Gegenwart von Calciumionen an Phospholipidmembranen gebunden werden. Darin liegt ihre biochemische Aktivität im Gerinnungssystem, in dem sie wesentliche Funktionen beim Ablauf der plasmatischen Gerinnung haben.
Die gerinnungshemmenden Proteine Protein C und Protein S werden ebenfalls als Vorstufen in der Leber synthetisiert und ebenfalls unter Mitwirkung von Vitamin K carboxyliert. Damit hat Vitamin K eine wesentliche Funktion in der Regulierung der Blutgerinnung.[4] Hohe Dosierungen von Vitamin K (bis 40 mg tgl.) gehen nicht mit pathologisch veränderten Gerinnungswerten (z. B. einer verstärkten Blutgerinnung und Thromboseneigung) einher, da die erhöhte Gerinnungsneigung und Fibrinolyse im Gleichgewicht bleiben.[5]
Gerinnungshemmende Arzneistoffe der Cumarin-Gruppe wie Phenprocoumon oder Warfarin können durch vergleichsweise kleine Mengen Vitamin K (1 mg) in ihrer Wirkung aufgehoben werden; sind sie im Einsatz, darf kein Vitamin K zusätzlich zur normalen Nahrung gegeben werden.
Knochenstoffwechsel
Vitamin K ist ein Kofaktor der γ-Glutamylcarboxylase, die in verschiedenen Proteinen posttranslational Glutaminsäurereste (Glu) zu γ-Carboxyglutaminsäureresten (Gla) carboxyliert. Zu diesen Proteinen gehört Osteocalcin, welches in carboxylierter Form Hydroxylapatit binden kann und daher an der Knochenmineralisation beteiligt ist. Um eine vollständige Carboxylierung des Osteocalcins zu erreichen, sind höhere Spiegel des Vitamin K notwendig als zur vollständigen Aktivierung des Gerinnungssystems. Ein erhöhter Spiegel nicht vollständig carboxylierten Osteocalcins geht mit einer geringeren Knochendichte und einer erhöhten Knochenbruchgefahr bei älteren Frauen einher.[5]
Während der Nurses’ Health Study, einer Studie mit über 72.000 Probandinnen, wurde gezeigt, dass Vitamin K1 einen wesentlichen Einfluss auf das Osteoporoserisiko hat.[9] Die Gruppe, die am wenigsten Vitamin K1 zu sich nahm, hatte ein um ca. 42 % erhöhtes Risiko für Hüftknochenbrüche (verursacht durch Osteoporose). Interessanterweise zeigte sich außerdem, dass Probanden mit höherer Vitamin-D-Einnahme bei gleichzeitiger geringer Vitamin-K-Einnahme ein erhöhtes Knochenbruch-Risiko aufwiesen. Aufgrund dieser und anderer Studien hat die Europäische Behörde für Lebensmittelsicherheit (EFSA) ein positives Gutachten erstellt – damit ist eine gesundheitsbezogene Aussage („Vitamin K trägt zur Erhaltung normaler Knochen“) erlaubt.[10][11] Im Gutachten der EFSA ist eine ausreichende Vitamin-K-Aufnahme durch eine ausgewogene Ernährung gewährleistet.
Vitamin K hemmt darüber hinaus die Osteoklastenaktivität: Der 1,25(OH)2D3-VDR-Komplex in den Osteoblasten erhöht die Bildung von RANKL und fördert damit (isoliert im Osteoblasten betrachtet und vor allem unter Bedingungen deutlicher Vitamin-D-Überdosierungen) den Knochenabbau.[12] Unter Bedingungen des (häufiger vorliegenden) Vitamin-D-Mangels ist diese Wirkung nicht relevant, da 1,25(OH)2D3 ebenfalls das Parathormon unterdrückt und für eine gute Versorgung des Körpers mit Calcium und Phosphat sorgt, also auf diesen Wegen indirekt knochenstärkend wirkt. Diese knochenabbauende Wirkung des 1,25(OH)2D3-VDR-Komplexes kann durch Vitamin K2 unterdrückt werden,[5] so dass eine Osteoporose-Therapie mit Vitamin D durch Vitamin K2 unterstützt werden kann.
Vitamin K2 hemmt dosisabhängig die Cyclooxygenase-2, und darüber die Synthese von PGE2 (welche von 1,25(OH)2VitD3 induziert wird) und welches die Knochenresorption steigert.[5]
In Tierversuchen mit Ratten konnte gezeigt werden, dass hohe Dosen (um die 30 mg/kg tgl.) von Vitamin K2 den Knochenabbau hemmten, der durch Verhältnisse wie bei Inaktivitätsosteoporose, Prednisolongabe, Überexpression von G-CSF oder Knochenverlust durch Phenytoin hervorgerufen war.[5]
Vitamin K1 und Vitamin K2 wurden in verschiedenen klinischen Studien auf ihre Wirksamkeit in der Osteoporoseprophylaxe und -therapie getestet: Frauen nach der Menopause gelten als wichtige Risikogruppe für eine Osteoporose. Nach Auswertung verschiedener Studien hat eine Vitamin-K-Supplementation keinen Effekt, das Risiko von Wirbelbrüchen zu senken.[11] Bezüglich Brüchen an anderen Knochen zeigte sich allenfalls ein kleiner Nutzen, der aber bei Studien mit guter Qualität nicht mehr zum Vorschein kommt.[11]
Zellwachstumsregulierung
Es existiert eine Reihe von Vitamin-K-abhängigen Rezeptor-Ligand-Systemen, die am Zellmetabolismus, dem Zellüberleben, ihren Transformationen und ihren Replikationen beteiligt sind. Hierzu gehören das Gas6, ein Vitamin-K-abhängiges Protein, welches als Ligand an verschiedene Rezeptor-Tyrosinkinasen bindet und diese aktiviert. Hierüber ist Vitamin K mit der Zellwachstumsregulation und der Entstehung von Tumoren verbunden.
In vitro und in vivo wurden mit Vitamin K1, Vitamin K2 und Vitamin K3 Versuche zu verschiedenen Tumoren und bei verschiedenen Krebserkrankungen gemacht, die häufig vielversprechende Ergebnisse zeigten, während die relevanten Wirkmechanismen noch Gegenstand verschiedener Forschungen sind.[13]
Andererseits hatten zwei epidemiologische Studien Anfang der 1990er Jahre eine erhöhte Krebsrate bei Kindern gezeigt, die als Neugeborene Vitamin K zur Prophylaxe einer Vitamin-K-Mangelblutung intramuskulär erhalten hatten. Diese Ergebnisse konnten zwar nicht bestätigt werden, führten aber doch in vielen Ländern zu einer vorzugsweise vorgenommenen oralen Vitamin-K-Prophylaxe bei gesunden Neugeborenen.[14]
Gefäßverkalkung
Es wird vermutet, dass auch der Prozess der Gefäßverkalkung durch Proteine mit γ-carboxylierten Glutaminsäureresten („Gla-Proteine“) gesteuert ist. Verkalkungen großer Arterien kommen vor allem bei älteren Menschen mit Osteoporose vor, die einen wenig gesättigten Vitamin-K-Status haben. Es wird daher spekuliert, dass Vitamin K vor „Arterienverkalkung“ schützt.[15]
Vitamin K2 ist wichtig für ein gesundes Herz-Kreislauf-System: Die Rotterdam-Herz-Studie zeigte, dass Menschen, die sich über einen zehnjährigen Beobachtungszeitraum von Nahrungsmitteln mit hohem Anteil an natürlichem Vitamin K2 (mindestens 32 µg täglich) ernährten, deutlich weniger Calciumablagerungen in den Arterien und eine weit bessere Herz-Kreislauf-Gesundheit aufwiesen als andere. Das Ergebnis der Studie ist, dass Vitamin K2 das Risiko, eine Gefäßverkalkung zu entwickeln oder an einer Herz-Kreislauf-Erkrankung zu sterben, um 50 % reduziert.[16] Eine weitere Studie zeigte, dass Vitamin K2 die Kalzifikation nicht nur verhindern, sondern sogar umkehren kann: In der Studie wurde Ratten der Vitamin-K-Antagonist Warfarin verabreicht, um eine Verkalkung der Arterien herbeizuführen. Ein Teil der Ratten erhielt danach Vitamin-K2-haltiges Futter, während die anderen mit normaler Nahrung gefüttert wurden. Das Vitamin K2 führte bei den Tieren zu einer Reduktion des Calciumgehalts in den Arterien um 50 %.[17]
Vorkommen
| Lebensmittel | Vitamin-K-Gehalt pro 100 g Lebensmittel |
|---|---|
| Grünkohl | 817 μg |
| Portulak | 381 μg |
| Schnittlauch | 380 μg |
| Spinat | 305 μg |
| Traubenkernöl | 280 μg |
| Kichererbsen | 264 μg |
| Brunnenkresse | 250 μg |
| Fenchel | 240 μg |
| Rosenkohl | 236 μg |
| Sojamehl | 200 μg |
| Mungbohnen | 170 μg |
| Broccoli | 155 μg |
| Rapsöl | 150 μg |
| Sojaöl | 138 μg |
| Weizenkeime | 131 μg |
| Linsen | 123 μg |
| Sauerkraut | 7,7 μg[18] |
| Souci/Fachmann/Kraut: Die Zusammensetzung der Lebensmittel – Nährwert-Tabellen. 7. Auflage. 2008[19] | |
In Nahrungsmitteln kommt vor allem Phyllochinon vor, weshalb Genaueres dazu dort zu finden ist. Inwieweit bakterielle Menachinone aus der Darmflora zur Vitamin-K-Versorgung beitragen, ist umstritten. Im Körper scheint Phyllochinon zu dem aktiveren Menachinon-4 umgewandelt werden zu können, da es sich in extrahepatischen Geweben vermehrt findet. Der Mechanismus ist noch unbekannt. Vitamin K ist u. a. in grünem Blattgemüse (Spinat, Blattsalat), Kohl, Petersilie, Avocado enthalten (siehe nebenstehende Tabelle). Außerdem ist es in manchen tierischen Produkten wie Vollmilch beziehungsweise fetten Milchprodukten, Eigelb und Fleisch (Innereien, Muskelfleisch) zu finden.
Wichtig ist, dass das Vitamin K kaum diaplazentar übertragen wird und das Neugeborene auch mit der Muttermilch wenig Vitamin K erhält. Entgegen der weitverbreiteten Meinung, dass das Kolostrum im Vergleich zur Muttermilch viel Vitamin K enthalte, konnte in einer Studie gezeigt werden, dass es praktisch keine Unterschiede im Vitamin-K-Gehalt von Muttermilch und Kolostrum gibt. Der Vitamin-K-Gehalt der Muttermilch hängt von der Nahrungszufuhr der Mutter ab und liegt bei etwa 3 µg / L.[20]
Bedarf
Die Deutsche Gesellschaft für Ernährung empfiehlt eine tägliche Aufnahme von 4–10 µg für Säuglinge, 15–50 µg – mit dem Alter aufsteigend – für Kinder bis 14 Jahre, 60–65 µg für Frauen und 70–80 µg für Männer.[21] Da gestillte Säuglinge dem (seltenen) Risiko eines klinisch relevanten Vitamin-K-Mangels mit der Gefahr gefährlicher Hirnblutungen ausgesetzt sind, wird eine Vitamin-K-Prophylaxe in den meisten Ländern der Welt empfohlen. In Deutschland wird sie zumeist oral mit 3 × 2 mg zur Geburt, nach ca. 1 Woche und nach ca. 4–6 Wochen dosiert. In anderen Ländern gibt es andere Dosisschemata.
Nachweismethoden und Statusbestimmung
Die Plasmakonzentration von Vitamin K1 wird je nach Nachweismethode mit 0,3–1 ng/ml Blut angegeben.[4]
Mit dem Koller-Test (Änderung des Quickwertes nach einmaliger intravenöser Gabe von Vitamin K) kann festgestellt werden, ob eine Carboxylierungsstörung der Vitamin-K-abhängigen Gerinnungsproteine an einer mangelhaften Resorption von Vitamin K (Vitamin-K-Mangel in der Leber z. B. bei Cholestase) oder an einem Leberzellschaden mit einer Proteinsynthesestörung und daher an einer Verwertungsstörung für Vitamin K liegt. Empfindlicher ist der Nachweis ungenügend carboxylierter Vitamin-K-abhängiger Proteine.
Mangelerscheinung (Hypovitaminosen)
Insgesamt sind bei normaler Ernährung ernstere Hypovitaminosen und Avitaminosen selten (wenn man den Bedarf nicht nach den Erfordernissen einer Osteoporoseprophylaxe etc. bemisst, die wesentlich höhere Dosen erfordert). Es gibt jedoch einige Situationen, in denen sie sehr wohl auftreten können:
Medikamentöse Antikoagulation
Cumarin-Derivate, die zur oralen Antikoagulation eingesetzt werden, sind Gegenspieler (Antagonisten) des Vitamin K und können bei Überdosierung zu lebensgefährlichen Blutungen aufgrund eines relativen Vitamin-K-Mangels führen. Dabei sind die Cumarin-Derivate Enzymhemmer vor allem der Vitamin-K-Epoxid-Reduktase (VKOR) und führen somit, trotz ausreichendem Vorhandenseins von Vitamin-K-Epoxid, zu einem Mangel an Vitamin-K-Hydrochinon, das für den Carboxylase-Schritt bei der Proteinbildung der Vitamin-K-abhängigen Proteine notwendig ist.
Da es Polymorphismen im VKORC1-Gen, das das VKOR-Enzym codiert, gibt, die unterschiedlich stark von Cumarin-Derivaten gehemmt werden, gibt es teilweise Schwierigkeiten, die korrekte Cumarin-Dosierung zu finden und Überlegungen, mittels eines Gentests VKOR-Polymorphismen vorab nachzuweisen. Ob dies allerdings tatsächlich zu einer besseren Dosierung und weniger Komplikationen führt, ist trotz dreier großer Studien unklar.[22]
Vitamin-K-Mangelblutung des Neugeborenen (Morbus haemorrhagicus neonatorum)
Das Neugeborene kommt zunächst nur wenig mit Vitamin K in Berührung. Vitamin K ist kaum plazentagängig und erscheint nur sehr geringen Mengen im Kolostrum und in der normalen Muttermilch.[20] Daher haben gestillte Neugeborene ohne zusätzliche Vitamin-K-Prophylaxe ein Risiko von ungefähr 1:10.000, an Vitamin-K-Mangelblutungen zu erkranken,[23] was in schweren Fällen zum Tode führen kann (z. B. durch plötzliche Hirnblutungen).[24] Insbesondere Neugeborene mit einer Leber- oder Gallenkrankheit, Frühgeborene oder fehlernährte Säuglinge haben ein hohes Risiko, da diese das wenige Vitamin K, das angeboten wird, nicht richtig resorbieren und verwerten können. Die Blutungen treten in der Regel in den ersten zwölf Wochen auf.[25] Alle gesunden Neugeborenen können deshalb eine Vitamin-K-Prophylaxe erhalten. Diese wird typischerweise entweder als 1 mg Vitamin K intramuskulär (z. B. Australien, USA), 3 × 2 mg Vitamin K1, oral im Alter von 0, 1 und 4 Wochen (z. B. in Deutschland (U1-U3), Schweiz) oder 1 mg nach der Geburt oral und anschließend täglich 150 µg bis zur 12. Woche (Niederlanden[26]) dosiert. Das Risiko für eine späte Vitamin-K-Mangelblutung kann so auf 0:100.000 bzw. 0,44:100.000 reduziert werden.[27][28]
Man beachte jedoch, dass über einen Zusammenhang zwischen intramuskulär verabreichter Vitamin-K-Dosis für Neugeborene und späteren Leukämieerkrankungen berichtet wurde, welcher aufgrund neuerer Studien zwar als sehr gering einzustufen ist, aber auch nicht eindeutig ausgeschlossen werden kann.[29][30]
Fehlernährung
Auch durch eine Vitamin-K-arme Ernährung kann ein Mangel mit Störungen der Blutgerinnung auftreten. Dies ist jedoch sehr selten und kommt dann meistens als Mischform mit Mangelzuständen anderer Nährstoffe oder Vitamine vor.
Fettresorptionsstörung
Ursache eines Vitamin-K Mangels kann eine verminderte Aufnahme von fettlöslichen Vitaminen, z. B. in Folge einer exokrinen Pankreasinsuffizienz sein.[31]
Überdosierungen (Hypervitaminosen)
Oral verabreichtes Vitamin K zeigt eine geringe akute und chronische Toxizität.[32] Eine Hypervitaminose ist nicht bekannt, wenn man von der Substitutionsbehandlung beim Neugeborenen absieht: Hier kann Vitamin K in hohen Dosen eine Hämolyse auslösen, weil beim Neugeborenen der noch wenig entwickelte Glucuronidierungsmechanismus durch Vitamin K so sehr in Anspruch genommen wird, dass Bilirubin nicht mehr ausreichend glucuronidiert werden kann und somit eine Ausscheidungsstörung für Bilirubin auftritt (Neugeborenenikterus), der sich pathologisch ausweiten kann.[4] Dies betraf vor allem den Einsatz des Menadions in der Vitamin-K-Prophylaxe, welches vorübergehend eingesetzt wurde, weil es als wasserlösliches Provitamin sicherer resorbiert werden sollte. Eine intramuskuläre Gabe von 1 mg Vitamin K1 nach der Geburt führt zu einem 100-fach erhöhten Blutspiegel nach 4 Tagen.
Vitamin K schwächt aber die therapeutische Wirkung oraler Antikoagulanzien vom Cumarin-Typ (Vitamin-K-Antagonisten) ab.[32] Daher sollen Personen, die solche gerinnungshemmenden Medikamente einnehmen, ihre Vitamin K-Aufnahme aus Lebensmitteln möglichst konstant halten. Vor dem Verzehr Vitamin K-haltiger Nahrungsergänzungsmittel sollten sie zudem den Rat eines Arztes einholen.
Literatur
- C. G. Victora, P. van Haecke: Vitamin K prophylaxis in less developed countries: policy issues and relevance to breastfeeding promotion. In: Am. J. Public. Health, Band 88, 1998, S. 203–209; PMID 9491008; PMC 1508196 (freier Volltext).
- Alexandra Schek: Vitamin K – ein Update, Teil 1 (englische Version, (PDF)), 14. November 2017, Ernährungs-Umschau
- Alexandra Schek: Vitamin K – ein Update, Teil 2 (englische Version, (PDF)), 13. Dezember 2017, Ernährungs-Umschau
Weblinks
- A. Goldinger: Vitamin-K-Gehalt verschiedener Lebensmittel. Universität Mainz.
- Höchstmengenvorschläge für Vitamin K in Lebensmitteln inklusive Nahrungsergänzungsmitteln (PDF; 168 kB), Bundesinstitut für Risikobewertung, 2021
- Vitamin K-Produkte – was ist sinnvoll?, Verbraucherzentrale, 11. Oktober 2021
Einzelnachweise
- Katja Wiemann: Beitrag zur Geschichte der Ernährungsforschung beim Haushuhn (bis 1950). (PDF; 8,4 MB) Tierärztliche Hochschule Hannover
- Henrik Dam: Vorlesung zur Nobelpreisverleihung am 12. Dezember 1945. (englisch)
- Informationen der Nobelstiftung zur Preisverleihung 1943 an Henrik Dam und Edward A. Doisy (englisch)
- H.K. Biesalsky (Hrsg.): Ernährungsmedizin. 2. Auflage. Georg Thieme Verlag, Stuttgart 1999, ISBN 3-13-100292-1.
- S. M. Plaza, D. W. Lamson: Vitamin K2 in bone metabolism and osteoporosis. (PDF) In: Alternative medicine review: a journal of clinical therapeutic, Band 10, Nummer 1, März 2005, S. 24–35, PMID 15771560 (Review).
- https://www.pnas.org/content/pnas/71/7/2730.full.pdf Proc. Nat. Acad. Sci. USA Vol. 71, No. 7, pp. 2730-2733, July 1974 Vitamin K Dependent Modifications of Glutamic Acid Residues in Prothrombin
- A. M. Craciun, C. Vermeer: Apolipoprotein E genotype may influence urinary gammacarboxyglutamate (Gla) concentrations in young individuals. In: General physiology and biophysics. ahead of print, 2. Juli 2013, PMID 23817635, doi:10.4149/gpb_2013030
- M. Vos, G. Esposito u. a.: Vitamin K2 Is a Mitochondrial Electron Carrier That Rescues Pink1 Deficiency. In: Science. 336, 2012, S. 1306–1310, doi:10.1126/science.1218632.
- D. Feskanich, P. Weber, W. C. Willett, H. Rockett, S. L. Booth, G. A. Colditz: Vitamin K intake and hip fractures in women: a prospective study. In: The American journal of clinical nutrition, Band 69, Nummer 1, Januar 1999, S. 74–79, PMID 9925126.
- Scientific Opinion on the substantiation of health claims related to vitamin K and maintenance of bone. In: EFSA Journal, 2009, 7 (9), S. 1228, doi:10.2903/j.efsa.2009.1228
- Iris Hinneburg: Osteoporose: Schützt Vitamin K vor spröden Knochen? In: Medizin transparent. 9. Juni 2020, abgerufen am 27. August 2020.
- A. S. Dusso, A. J. Brown, E. Slatopolsky: Vitamin D. In: American Journal of Physiology – Renal physiology. Band 289, Nummer 1, Juli 2005, S. F8–28, doi:10.1152/ajprenal.00336.2004, PMID 15951480 (Review).
- D. W. Lamson, S. M. Plaza: The anticancer effects of vitamin K. In: Alternative medicine review: a journal of clinical therapeutic. Band 8, Nummer 3, August 2003, S. 303–318, PMID 12946240 (Review).
- U. Göbel, R. von Kries: Vitamin-K-Prophylaxe: Schutz vor Blutungen ohne Krebsrisiko möglich. In: Deutsches Ärzteblatt, Band 94, 1997, Nr. 46, S. A-3109-3113.
- L. J. Schurgers u. a.: Role of vitamin K and vitamin-K-dependent proteins in vascular calcification. In: Zeitschrift für Kardiologie, Band 90, 2001, Nr. 3, S. 57–63. PMID 11374034
- Geleijnse u. a.: Dietary intake of menaquinone is associated with a reduced risk of coronary heart disease: the Rotterdam Study In: J Nutr., 2004 Nov, 134(11), S. 3100–3105, PMID 15514282
- Schurgers u. a.: Regression of warfarin-induced medial elastocalcinosis by high intake of vitamin K in rats In: Blood, 2007 Apr 1, 109(7), S. 2823–2831, PMID 17138823
- Zu oftmals fehlerhaften Angaben zu Sauerkraut vgl. Messfehler bei Sauerkraut (Memento vom 30. August 2017; PDF; 32 kB)
- Vitamin K in Lebensmitteln. (PDF; 52 kB) In: Souci, Fachmann, Kraut: Die Zusammensetzung der Lebensmittel – Nährwert-Tabellen. 7. Auflage. 2008, ISBN 978-3-8047-5038-8.
- LM Canfield et al.: Vitamin K in colostrum and mature human milk over the lactation period--a cross-sectional study. In: Am J Clin Nutr., 1991 Mar;53(3), S. 730–735
- Vitamin K: Schätzwerte für eine angemessene Zufuhr. Deutsche Gesellschaft für Ernährung, abgerufen am 2. Februar 2017.
- Bruce Furie: Do Pharmacogenetics Have a Role in the Dosing of Vitamin K Antagonists? In: New England Journal of Medicine. 369, 2013, S. 2345–2346, doi:10.1056/NEJMe1313682
- A. H. Sutor: Vitamin K deficiency bleeding in infants and children. A status report. In: Seminars in Thrombosis and Hemostasis, Vol. 21 (1995), S. 317–329.
- Vgl. auch Ludwig Weissbecker: Vitamin K-Avitaminose (Hypoprothrombinämie). In: Ludwig Heilmeyer (Hrsg.): Lehrbuch der Inneren Medizin. Springer-Verlag, Berlin/Göttingen/Heidelberg 1955; 2. Auflage ebenda 1961, S. 1089 f.
- A. H. Sutor u. a.: Vitamin K Deficiency Bleeding (VKDB) in Infancy. In: Thrombosis and Haemostasis. Vol. 81 (1999), S. 457.
- J. Peter de Winter, Koen F. M. Joosten, Marloes M. Ijland, Henkjan J. Verkade, Martin Offringa: [New Dutch practice guideline for administration of vitamin K to full-term newborns]. In: Nederlands Tijdschrift Voor Geneeskunde. Band 155, Nr. 18, 1. Januar 2011, S. A936, PMID 21672291.
- M. Cornelissen u. a.: "Prevention of vitamin K deficiency bleeding: efficacy of different multiple oral dose schedules of vitamin K", Eur J Pediatr, Vol. 156 (1997), S. 126.
- R. von Kries, A. Hachmeister, U. Göbel: Can 3 oral 2 mg doses of vitamin K effectively prevent late vitamin K deficiency bleeding? In: Eur J Pediatr. Vol. 158 Suppl. 3 (1999), S. 183.
- J. Golding u. a.: Childhood cancer, intramuscular vitamin K, and pethidine given during labour. In: BMJ. Vol. 305 (1992), S. 341–346.
- S. Passmore u. a.: Case-control studies of relation between childhood cancer and neonatal vitamin K administration. In: BMJ. Vol. 316 (1998), S. 178.
- Silke Klapdor, Eva Richter, Rainer Klapdor: Fettlösliche Vitamine bei Erkrankungen der Bauchspeicheldrüse. In: Ernährungs-Umschau, Ausgabe 08/12, S. 436–441.
- Höchstmengenvorschläge für Vitamin K in Lebensmitteln inklusive Nahrungsergänzungsmitteln. (PDF) In: Bundesinstitut für Risikobewertung. 2021, abgerufen am 9. Januar 2022.