Hülsenfrüchtler
Die Hülsenfrüchtler (Fabaceae oder Leguminosae; früher: Papilionaceae), auch Leguminosen genannt, sind eine der artenreichsten Pflanzenfamilien und gehören zur Ordnung der Schmetterlingsblütenartigen (Fabales). Sie wurde früher in drei Unterfamilien, die manchmal auch als eigene Familien behandelt wurden, seit 2017 in sechs Unterfamilien, mit vielen Tribus, gegliedert und enthält insgesamt etwa 730 Gattungen mit fast 20.000 Arten.[1] Sie enthält die artenreichste Gattung innerhalb der Gefäßpflanzen: Astragalus mit etwa 2000 Arten.
| Hülsenfrüchtler | ||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|

Zottige Wicke (Vicia villosa), Blüten und unreife Hülsenfrucht | ||||||||||||
| Systematik | ||||||||||||
| ||||||||||||
| Wissenschaftlicher Name | ||||||||||||
| Fabaceae | ||||||||||||
| Lindl. |
Die Hülsenfrüchtler sind eine von wenigen Familien, die zwei gültige, alternativ verwendbare wissenschaftliche Namen besitzen: Der Name Leguminosae wurde von Michel Adanson im Jahr 1763 geschaffen. Erst 1836 wurde von John Lindley der neue Name Fabaceae gebildet. Der nomenklatorische Typus zu beiden Namen ist die Gattung Faba Miller, ein Synonym von Vicia L.
Beschreibung

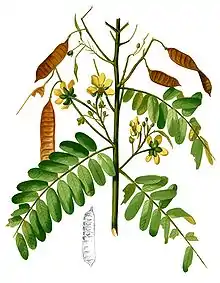
Erscheinungsbild
Es sind zum einen ein- bis zweijährige oder ausdauernde krautige Pflanzen und zum anderen verholzende Pflanzen: Bäume, Sträucher und Lianen. Sie wachsen selbständig aufrecht, kriechend oder kletternd. Bei einer ganzen Reihe von Arten oder Sorten der Kulturpflanzen führen die Sprossachsen kreisende Bewegungen meist in, seltener gegen den Uhrzeigersinn aus; es sind windende Pflanzen, die an anderen Pflanzen oder Gegenständen empor klettern. Einige Arten sind Epiphyten. Einige Arten besitzen xerophytische Anpassungen. Die Pflanzen können mit Stacheln oder Dornen bewehrt sein.
Laubblätter und Nebenblätter
Die meist wechselständigen Laubblätter sind meist gefiedert. Bei allen Unterfamilien sind ursprünglich Fiederblätter vorhanden, die in einigen Gattungen und Arten auf die Endfieder reduziert sein können, wie beispielsweise beim Färber-Ginster (Genista tinctoria), oder nur aus drei Blättchen bestehen, wie bei den Klee-Arten (Trifolium). Sie können sehr unterschiedlich groß sein.
Bei manchen Arten sind die Fiederblätter völlig oder bei vielen Arten teilweise zu Ranken umgebildet; meist werden die Ranken nur von der Endfieder gebildet. Wenn die Endfieder zu einer Ranke umgebildet ist oder fehlt, nennt man das paarig gefiedert und wenn die Endfieder normal ausgebildet ist, nennt man das unpaarig gefiedert. Bei den Cercideae sind die Blätter einfach.
Es sind Nebenblätter vorhanden, die je nach Art sehr unterschiedlich ausgeprägt sein können. Die Nebenblätter können wie bei der Robinie (Robinia pseudoacacia) zu Dornen („Nebenblattdornen“) umgebildet sein, oder sie sind wie beispielsweise bei der Ranken-Platterbse (Lathyrus aphaca) besonders groß und übernehmen die Hauptassimilationsfunktion, da die eigentlichen Blattorgane zu Ranken umgebildet sind. Einige Arten besitzen eine verdickte Stelle im unteren Teil des Nebenblattes, die Bewegungen bewirken kann („Pulvinus“).
Bei einigen Arten sind die Blätter reduziert und Phyllodien übernehmen die Aufgabe der Photosynthese.
Blütenstände und Blüten
Die Blüten können in traubigen, ährigen, rispigen, wickelförmigen oder kopfigen Blütenständen zusammen stehen.
Die meist zwittrigen, radiärsymmetrischen bis zygomorphen Blüten sind meist fünfzählig mit doppeltem Perianth. Besonders bei den Mimosoideae kommen auch einhäusig getrenntgeschlechtige (monözische) Arten vor. Die meist fünf (drei bis sechs) Kelchblätter sind verwachsen. Besonders im Bau der Blüten unterscheiden sich die Unterfamilien.
In der Knospenlage besitzen die Kronblätter Faboideae eine absteigende Deckung, aber bei den Caesalpinioideae mit aufsteigender Deckung. Es sind meist fünf (ein bis fünf) Kronblätter vorhanden; mindestens drei Kronblätter sind untereinander frei. Die typischen Schmetterlingsblüten, es geht um die Blütenkrone, entsteht durch die Ausformung der meist fünf Blütenkronblätter. Das obere, meist aufgerichtete Kronblatt nennt man Fahne („Vexillum“), die beiden seitlichen nennt man Flügel („Alae“), die beiden unteren schließlich sind mehr oder weniger stark verwachsen oder verklebt und bilden das Schiffchen („Carina“). Die Kronblätter können genagelt sein. Nur bei 26 Gattungen der Caesalpinioideae, einigen Gattungen der Swartzieae und Amorphieae fehlen Blütenhüllblätter, dann sind die Staubblätter am auffälligsten und es dienen bei ihnen meist Fledertiere als Bestäuber.
Wenn zehn Staubblätter vorhanden sind, dann sind sie bei den Faboideae meist alle oder nur zu neunt verwachsen und bilden eine lange Röhre (bzw. Rinne bei 9 verwachsenen), die das Fruchtblatt umgibt; oder die Staubblätter sind untereinander frei (Sophora). Bei den Mimosoideae sind drei bis hundert Staubblätter vorhanden. Selten sind nur ein oder zwei Staubblätter vorhanden. Bei wenigen Taxa sind die Staubblätter mit den Kronblättern verwachsen. Entweder sind alle Staubblätter fertil oder ein Teil ist zu Staminodien umgewandelt. Die Pollenkörner besitzen meist drei oder sechs, seltener zwei, vier oder keine Aperturen; sie sind meist colporat, oder seltener porat, colpat, oder rugat; sie sind fast immer zweizellig oder bei wenigen Mimosoideae dreizellig. In jeder Blüte gibt es meist nur ein oberständiges Fruchtblatt; bei wenigen Mimosoideae sind zwei bis 16 freie Fruchtblätter vorhanden.
Die Bestäubung erfolgt durch Insekten (Entomophilie), Vögel (Ornithophilie, besonders bei südaustralischen Arten) oder Fledertiere (Chiropterophilie). Die Übertragungsmechanismen des Pollens auf Insekten bei der Bestäubung sind bei vielen Arten sehr interessant, es gibt beispielsweise einen „Explosionsmechanismus“ (Besenginster, Cytisus scoparius) oder „Klappmechanismus“ (Färberginster, Genista tinctoria).
20100315_04.jpg.webp)
Früchte und Samen
Die Hülsenfrüchtler haben ihren Namen von der „Hülsenfrucht“, einem Fruchttyp, der nur hier vorkommt. Es wird eine Hülsenfrucht gebildet, die sich bei Reife meist an der Bauch- und Rückennaht öffnet. Seltener werden auch Gliederhülsen mit Bruchfrüchten (Kleiner Vogelfuß, Ornithopus perpusillus), die sich zu Nüsschen entwickeln, ausgebildet. Einige wenige Taxa bilden auch Balgfrüchte, Samaras, achänen-, beeren- oder steinfruchtähnliche Früchte. Bei einigen Mimosoideae können auch mehrere Früchte zu einer Sammelfrucht vereint sein. Die Früchte enthalten ein bis hundert Samen. Die kleinen bis sehr großen Samen sind meist ungeflügelt oder besitzen selten, wie bei einigen Mimosoideae, Flügel. Die stärkehaltigen oder -freien Samen können eine Mikropyle besitzen, die zickzackförmig sein kann.
Ökologie
Symbiose mit Bakterien und Pilzen
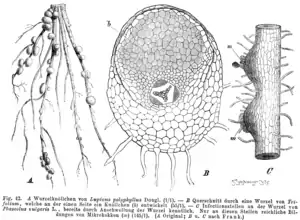
Die meisten Leguminosen gehen in ihren Wurzelknöllchen eine Symbiose mit stickstofffixierenden Bakterien (Rhizobien) ein. Sie machen sich dadurch unabhängig vom Nitratgehalt des Bodens und sind in extrem stickstoffarmen Böden (zum Beispiel Akazien in der „Wüste“) erst lebensfähig. Zum Schutz der Bakterien vor Luftsauerstoff sind Leguminosen in der Lage, das Sauerstoff-bindende Protein Leghämoglobin zu bilden.
Durch ihre Rhizobien tragen Leguminosen zur Fruchtbarkeit des Bodens bei (siehe Gründüngung). In der Landwirtschaft werden sie daher gern zur Melioration als Zwischenfrüchte angebaut. Die Stickstofffixierung kann 100 kg/ha pro Monat erreichen.
In Gesellschaft mit der Gartenbohne (Phaseolus vulgaris) wurde ein Pilz entdeckt, der Insekten befällt und deren Stickstoff an die Pflanze weitergibt.[2]
Inhaltsstoffe
Leguminosen sind sehr nährstoffreiche Pflanzen, die reichlich Proteine, Vitamine und Mineralstoffe, aber auch antinutrive Stoffe beinhalten. Die antinutritiven Inhaltsstoffe sind der Grund, warum Leguminosen in der Regel durch Kochen und/oder Keimen verarbeitet werden müssen.[3]
In den Samen vieler Arten der Fabaceae kommen sogenannte Lektine bzw. Glykoproteine vor. Diese können mit Kohlenhydratgruppen von Glykolipiden oder Glykoproteinen auf Zelloberflächen spezifische Bindungen eingehen, ähnlich wie Antigen-Antikörper-Reaktionen. Die Reaktion kann Blutgruppen-spezifisch erfolgen. Verbreitet kommen toxische Lektine vor, diese sind beispielsweise bei Phaseolus für die Giftigkeit roher Früchte verantwortlich.
Häufig sind Alkaloide enthalten. Als Fraßschutz sind Chinolizidin-Alkaloide vorhanden; bei sogenannten „Süß-Lupinen“ wurden sie durch Züchtung entfernt, sodass diese Sorten als Futtermittel angebaut werden können. Auch andere cyanogene Verbindungen dienen als Fraßschutz.
Auch Saponine stellen eine wichtige Inhaltsstoffgruppe dar. Flavonole können vorhanden sein.
Bedeutung als Nutzpflanzen
Aufgrund ihres hohen Eiweißgehalts (Legumin) sind Früchte und Samen der Hülsenfrüchtler fast weltweit ein wichtiger Bestandteil der menschlichen Ernährung. Insbesondere bei fleischarmer oder vegetarischer Kost sind sie fast unverzichtbar. Beispiele sind etwa Erbsen, Kichererbsen, Bohnen, Azukibohnen, Limabohnen und Linsen, die zur Unterfamilie der Schmetterlingsblütler (Faboideae) gehören. Oft werden nur die Samen gegessen und umgangssprachlich werden dann die Samen – totum pro parte – meist „Hülsenfrüchte“ genannt. Beispielsweise werden bei grünen Bohnen und Zuckererbsen die Früchte gegessen. Einige Hülsenfrüchte können wie Zuckererbsen roh gegessen werden. Aufgrund der enthaltenen Alkaloide und Lektine sind viele im rohen Zustand gesundheitsschädlich. Speziell grüne Bohnen müssen vor dem Verzehr vollständig durchgegart werden. Die Lagerung erfolgt meist in getrocknetem Zustand. Außer bei Linsen und geschälten, halben Erbsen ist in der Regel ein Einweichen in Wasser (über Nacht) notwendig, um die Kochzeit auf ein vertretbares Maß zu reduzieren.
| Fruchtart | Wasser | Proteine | Kohlenhydrate | Ballaststoffe | Fette |
|---|---|---|---|---|---|
| grüne Bohnen | 82–90 | 2,5–6 | 6,5–8,5 | na | 0,3 |
| Bohnen, getrocknet | 11–14 | 24–26 | 47–55 | na | 1,5–2 |
| frische Erbsen | 80 | 2,5–6,5 | 4–12,5 | na | 0,5 |
| Erbsen, getrocknet | 14 | 23 | 53 | na | 2 |
| Kichererbsen, getrocknet | 20,5 | 61 | na | 4,8 | |
| Linsen, getrocknet | 12 | 26 | 53 | na | 2 |
| Sojabohnen, getrocknet | 10 | 34 | 27 | na | 19 |
| Erdnüsse, getrocknet | 2 | 24 | 22 | na | 50 |
| Lupinen, getrocknet | 15 | 38 | 25 | na | 4 |
Der überwiegende Anteil der in den Hülsenfrüchten enthaltenen Kohlenhydrate sind Mehrfachzucker, vor allem Raffinose.
In Europa wird der größte Anteil der angebauten Leguminosen als Futtermittel für Wiederkäuer, Schweine und Hühner eingesetzt. Für die Fütterung werden besonders Erbsen, Ackerbohnen, Lupinen, Luzerne (Alfalfa) und Sojabohnen angebaut. Der Großteil des Bedarfs an eiweißreichen Futtermitteln in Europa wird durch Importe von Sojabohnen vor allem aus Lateinamerika gedeckt.[4]
Die positiven Umweltwirkungen der Leguminosen haben zu einer Förderung dieser Kulturen im Rahmen der Gemeinsamen Agrarpolitik geführt.[5] Ökonomisch sind die Kulturen noch wenig attraktiv, wenn sie als Einzelkulturen verglichen werden. Wird ihr Vorfruchtwert in der Fruchtfolge mit berücksichtigt, können Leguminosen unter bestimmten Bedingungen ökonomisch attraktiv sein.[6] Für eine solche Bewertung sind Modelle entwickelt worden, welche diese Annahme bestätigen und gleichzeitig aufzeigen, dass große Mengen Stickstoffdünger eingespart und Lachgas[[emission]]en reduziert werden können.[7] Die Einsparungen können bis zu 50 % betragen.[8]
Viele Arten liefern tropische Hölzer (Palisander: Dalbergia- und Machaerium-Arten, Sophora-Arten). In den gemäßigten Gebieten wurde die Robinie als Forstpflanze angepflanzt und ist verwildert. Viele Arten und ihre Sorten werden als Zierpflanzen verwendet.
Systematik und botanische Geschichte
Die Familie Fabaceae wurde 1836 durch John Lindley in An Introduction to the Natural System of Botany, 148 aufgestellt.[9]
Die Familie Fabaceae umfasst etwa 730 Gattungen mit fast 20.000 Arten. Sie wurde Anfang des 21. Jahrhunderts noch in drei Unterfamilien und etwa 35 Tribus gegliedert[10] (Gattungen siehe Unterfamilien und Tribus): Die Forschungsarbeiten der 2000er Jahre zeigten, dass noch mehr Gruppen aus den Unterfamilien ausgegliedert werden müssen, damit die Unterfamilien monophyletisch werden. Dabei scheint wohl die Unterfamilie Faboideae in ihrem Umfang der 2000er Jahre monophyletisch zu sein. Die Tribus war noch 2006 Cassieae s. l. ist polyphyletisch. Die Unterfamilie Caesalpinioideae ist 2006 weitgehend aufgelöst.[11]
Synonyme der Familie Fabaceae Lindl. sind: Acaciaceae E.Mey., Aspalathaceae Martinov, Astragalaceae Bercht. & J.Presl, Caesalpiniaceae R.Br. nom. cons., Cassiaceae Vest, Ceratoniaceae Link, Detariaceae (DC.) Hess, Hedysaraceae Oken, Inocarpaceae Zoll., Leguminosae Adans., nom. cons., Mimosaceae R.Br., nom. cons., Papilionaceae Giseke, nom. cons., Phaseolaceae Schnitzl., Swartziaceae (DC.) Bartl., Viciaceae Bercht. & J.Presl.[10]
Schmetterlingsblütler (Faboideae)
Schmetterlingsblütler (Faboideae): Sie wird in etwa 28 Tribus gegliedert und enthält etwa 476 Gattungen mit etwa 13855 Arten. Sie besitzen die typischen, zygomorphen Schmetterlingsblüten.
- Abreae
- Amorpheae
- Bossiaeeae
- Brongniartieae
- Cicereae
- Crotalarieae
- Dalbergieae
- Desmodieae
- Dipterygeae
- Euchresteae
- Fabeae
- Galegeae
- Genisteae
- Hedysareae
- Hypocalypteae
- Indigofereae
- Loteae
- Millettieae
- Mirbelieae
- Phaseoleae
- Podalyrieae
- Psoraleeae
- Robinieae
- Sesbanieae
- Sophoreae
- Swartzieae
- Thermopsideae
- Trifolieae
Mimosengewächse (Mimosoideae)
Mimosengewächse (Mimosoideae): Sie wird in etwa drei Tribus gegliedert und enthält etwa 82 Gattungen mit etwa 3275 Arten. Die Blüten sind meist radiärsymmetrisch.
- Ingeae
- Mimoseae
Johannisbrotgewächse (Caesalpinioideae)
Johannisbrotgewächse (Caesalpinioideae): Sie wird in etwa zwei Tribus gegliedert und enthält etwa 140 Gattungen mit über 1000 verholzenden Arten. Die Blüten sind meist zygomorph:
- Caesalpinieae
- Cassieae
2006 wurden wenige Tribus keiner der drei Unterfamilien zugeordnet, aber sie haben ab 2010, 2013, 2018 den Rang von weiteren Unterfamilien:[1]


Unterfamilie Cercidoideae
Unterfamilie Cercidoideae Azani et al.: Sie wird in zwei Tribus gegliedert:[12][13][1][14][15][16]
- Tribus Bauhinieae Benth.: Sie enthält etwa zehn Gattungen:[16]
- Barklya F.Muell.: Es gibt nur eine Art:
- Barklya syringifolia F.Muell.: Sie kommt in den australischen Bundesstaaten New South Wales sowie Queensland vor.
- Bauhinia L. (Syn.: Alvesia Welw., Amaria Mutis ex Caldas, Ariaria Cuervo, Bracteolanthus de Wit, Cansenia Raf., Caspareopsis Britton & Rose, Casparia Kunth, Mandarus Raf., Monoteles Raf., Pauletia Cav., Perlebia Mart.): Die nur noch etwa 200 Arten sind pantropische verbreitet.[16]
- Brenierea Humbert: Es gibt nur eine Art:
- Brenierea insignis Humbert: Sie kommt nur im südwestlichen bis südlichen Madagaskar vor.
- Cheniella R.Clark & Mackinder: Sie wurde 2017 aufgestellt. Die etwa zehn Arten sind vom südlichen China über Indochina bis Malesien verbreitet.[14]
- Gigasiphon Drake: Die etwa fünf Arten kommen im tropischen Ostafrika, in Madagaskar, von den Philippinen bis zu den Kleinen Sunda-Inseln und in Neuguinea vor.
- Lysiphyllum (Benth.) deWit: Die etwa neun Arten sind vom Indischen Subkontinent über Indochina und Malesien bis Australien verbreitet.
- Phanera Lour. (Syn.: Lasiobema (Korth.) Miq., Telestria Raf.): Die noch 95 Arten sind vom subtropischen bis tropischen Asien und in Malesien verbreitet.[16]
- Piliostigma Hochst. (Syn.: Pileostigma Hochst., Elayuna Raf., Locellaria Welw.): Die etwa fünf Arten sind in Afrika und vom subtropischen bis tropischen Asien und im nördlichen Australien verbreitet.
- Schnella Raddi (Syn.: Binaria Raf., Cardenasia Rusby, Caulotretus Rich. ex Spreng., Lacara Spreng.): Die etwa 47 Arten sind in der Neotropis verbreitet.
- Tournaya A.Schmitz: Sie wurde 2020 reaktiviert und enthält nur eine Art:[16]
- Tournaya gossweileri (Baker f.) A.Schmitz: Sie kommt vom tropischen westlichen-zentralen Afrika bis zum nördlichen Angola vor.
- Tylosema (Schweinf.) Torre & Hillc.: Die etwa fünf Arten sind in Afrika verbreitet.
- Barklya F.Muell.: Es gibt nur eine Art:
- Tribus Cercideae Bronn: Sie enthält etwa drei Gattungen:[16]
- Adenolobus (Harv. ex Benth. & Hook. f.) Torre & Hillc.: Die nur zwei Arten sind vom tropischen bis ins südliche Afrika verbreitet.
- Cercis L. (Syn.: Siliquastrum Duhamel): Die etwa zehn Arten sind vom gemäßigten bis subtropischen Eurasien und Nordamerika verbreitet.
- Griffonia Baill. (Syn.: Bandeiraea Welw. ex Benth. & Hook. f.): Die etwa vier Arten sind vom tropischen Westafrika bis Angola verbreitet.

.jpg.webp)




Unterfamilie Detarioideae
Unterfamilie Detarioideae Burmeist. (Syn.: Detariaceae J.Hess, Tamarindaceae Martinov): Sie wird in etwa sechs Tribus gegliedert:[1][17][18]
- Tribus Afzelieae Estrella, L.P.Queiroz & Bruneau: Sie wurde 2018 aufgestellt[18] und enthält nur etwa drei Gattungen:
- Afzelia Sm. (Syn.: Afrafzelia Pierre, Pahudia Miq.):[19] Die etwa zwölf Arten sind von tropischen bis ins südliche Afrika und in Südostasien verbreitet.
- Brodriguesia R.S.Cowan: Es gibt nur eine Art:
- Brodriguesia santosii R.S.Cowan: Sie kommt im nordöstlichen Brasilien vor.
- Intsia Thouars: Die nur zwei Arten kommen in Tansania, Madagaskar, auf den Andamanen, auf dem Indischen Subkontinent und von Südostasien über Malesien bis Australien und auf Inseln im südwestlichen Pazifik vor.
- Tribus Amherstieae Benth.: Sie enthält etwa 50 Gattungen:
- Amherstia Wall.: Es gibt nur eine Art:
- Amherstia nobilis Wall.: Sie kommt in Myanmar und Thailand vor und ist in anderen Gebieten Asiens ein Neophyt.
- Annea Mackinder & Wieringa: Sie wurde 2013 aufgestellt. Die nur zwei Arten sind vom tropischen Westafrika bis Angola verbreitet.[20]
- Anthonotha P.Beauv.: Die etwa 17 Arten sind im tropischen Afrika verbreitet.[21]
- Aphanocalyx Oliver (Syn.: Monopetalanthus Harms): Die etwa 14 Arten sind im tropischen Afrika verbreitet.
- Berlinia Sol. ex Hook. f.[22] (Syn.: Macroberlinia (Harms) Hauman, Westia Vahl): Die etwa 21 Arten sind im tropischen Afrika verbreitet.
- Bikinia Wieringa: Sie wurde 1999 aufgestellt. Die etwa 21 Arten sind im tropischen Zentralafrika verbreitet.
- Brachycylix (Harms) R.S.Cowan (Syn.: Heterostemon subg. Brachycylix Harms): Sie hat seit 1975 den Rang einer Gattung. Es gibt nur eine Art:
- Brachycylix vageleri (Harms) R.S.Cowan: Sie kommt nur in Kolumbien vor.
- Brachystegia Benth.: Die etwa 32 Arten sind vom tropischen bis ins südliche Afrika verbreitet.
- Brownea Jacq.: Die etwa 22 Arten sind in der Neotropis verbreitet und in vielen tropischen Gebieten Neophyten.
- Browneopsis Huber: Die etwa acht Arten sind von Panama über Kolumbien bis Peru und bis zum nördlichen Brasilien verbreitet.[23]
- Crudia Schreb. (Syn.: Apalatoa Aubl., Cyclas Schreb., Opalatoa Aubl., Pryona Miq., Touchiroa Aubl., Tuchiroa Kuntze, Waldschmidtia Scop.): Die etwa 32 Arten sind in vielen tropischen Ländern verbreitet.
- Cryptosepalum Benth. (Syn.: Dewindtia De Wild., Pynaertiodendron De Wild.): Die etwa zwölf Arten sind im tropischen Afrika verbreitet.
- Cynometra L. (Syn.: Iripa Adans., Maniltoa Scheff., Metrocynia Thouars, Pseudocynometra Kuntze, Schizosiphon K.Schum.):[24] Die etwa 113 Arten sind in den Tropen fast weltweit verbreitet.
- Dicymbe Spruce ex Benth. & Hook. f. (Syn.: Dicymbopsis Ducke): Die etwa 20 Arten sind im tropischen Südamerika verbreitet.
- Didelotia Baill. (Syn.: Toubaouate Aubrév. & Pellegr., Zingania A.Chev.): Die etwa 13 Arten sind vom westlichen bis ins westliche-zentrale tropische Afrika verbreitet.
- Ecuadendron D.A.Neill: Sie wurde 1998 aufgestellt mit nur einer Art:
- Ecuadendron acosta-solisianum D.A.Neill D.A.Neill: Sie kommt nur in Ecuador vor.[25]
- Englerodendron Harms (Syn.: Isomacrolobium Aubrév. & Pellegr., Leonardendron Aubrév., Pseudomacrolobium Hauman, Triplisomeris Aubrév. & Pellegr.):[26] Die etwa 17 Arten sind vom tropischen West- bis Zentral- und Ostafrika verbreitet; beispielsweise:
- Englerodendron mengei (De Wild.) Estrella & Ojeda (Syn.: Pseudomacrolobium mengei (De Wild.) Hauman, Berlinia mengei De Wild.): Sie kommt in der Demokratischen Republik Kongo vor.
- Gabonius Wieringa & Mackinder: Sie wurde 2013 aufgestellt mit nur einer Art:[27]
- Gabonius ngouniensis (Pellegr.) Mackinder & Wieringa: Sie kommt nur in Gabun vor.
- Gilbertiodendron J.Léonard (Syn.: Pellegriniodendron J.Léonard):[28][29] Die etwa 38 Arten kommen vom tropischen Westafrika bis ins westliche Zentralafrika vor, beispielsweise:
- Gilbertiodendron dewevrei (De Wild.) J.Léonard
- Heterostemon Desf.: Die etwa sieben Arten sind im nördlichen Südamerika verbreitet.
- Humboldtia Vahl (Syn.: Batschia Vahl): Die etwa sieben Arten kommen in Sri Lanka und im südlichen Indien vor.
- Hymenostegia (Benth.) Harms: Die etwa 15 Arten sind vom westlichen bis ins westliche-zentrale tropische Afrika verbreitet.[30]
- Icuria Wieringa: Sie wurde 1999 aufgestellt mit nur einer Art:
- Icuria dunensis Wieringa: Sie kommt nur in Mosambik vor.
- Isoberlinia Craib & Stapf ex Holland: Die etwa fünf Arten sind im tropischen Afrika verbreitet; beispielsweise:
- Isoberlinia doka Craib & Stapf
- Julbernardia Pellegr. (Syn.: Paraberlinia Pellegr., Pseudoberlinia P.A.Duvign., Seretoberlinia P.A.Duvign., Thylacanthus Tul.): Die etwa zehn Arten sind vom tropischen bis ins südliche Afrika verbreitet.
- Lebruniodendron J.Léonard: Sie enthält nur eine Art:
- Lebruniodendron leptanthum (Harms) J.Leonard: Sie kommt in Kamerun, Gabun, in der Republik Kongo und in der Demokratischen Republik Kongo vor.
- Leonardoxa Aubrév.: Die nur zwei Arten kommen vom tropischen West- bis westlichen Zentralafrika vor.
- Librevillea Hoyle: Sie enthält nur eine Art:
- Librevillea klainei (Harms) Hoyle: Sie kommt in Cabinda, Kamerun, Gabun und in der Republik Kongo vor.
- Loesenera Harms (Syn.: Ibadja A.Chev.): Die etwa vier Arten kommen vom tropischen West- bis westlichen Zentralafrika vor.
- Macrolobium Schreb. (Syn.: Kruegeria Scop., Outea Aubl., Pseudovouapa Britton & Killip, Utea J.St.-Hil., Vouapa Aubl.): Die etwa 75 Arten sind in der Neotropis verbreitet.[31]
- Michelsonia Hauman: Sie enthält nur eine Art:
- Michelsonia microphylla (Troupin) Hauman: Sie kommt nur in der Demokratischen Republik Kongo vor.
- Micklethwaitia G.P.Lewis & Schrire: Sie wurde 2004 aufgestellt und enthält nur eine Art:[30]
- Micklethwaitia carvalhoi (Harms) G.P.Lewis & Schrire: Von diesem Endemiten sind nur noch vier Fundorte an der Küste im nördlichen Mosambik bekannten.[30]
- Microberlinia A.Chev.: Die etwa zwei Arten kommen im tropischen westlichen Zentralafrika vor.
- Neochevalierodendron J.Léonard: Es gibt nur eine Art:
- Neochevalierodendron stephanii (A.Chev.) J.Léonard: Sie kommt in Gabun und in der Republik Kongo vor.
- Normandiodendron J.Léonard: Es gibt nur eine Art:
- Normandiodendron bequaertii (De Wild.) J.Léonard: Sie kommt im tropischen westlichen Zentralafrika vor.
- Oddoniodendron De Wild.: Die etwa sechs Arten kommen in Zentralafrika vor.
- Paloue Aubl. (Syn.: Elizabetha R.H.Schomb. ex Benth., Ginannia Scop., Palovea Aubl., Paloveopsis R.S.Cowan): Die etwa 16 Arten sind im tropischen Südamerika verbreitet.
- Plagiosiphon Harms (Syn.: Tripetalanthus A.Chev.): Die etwa fünf Arten kommen im westlichen Afrika in der Elfenbeinküste, in Liberia, in Kamerun, Gabun, Siera Leone und in der Republik Kongo vor.
- Polystemonanthus Harms: Es gibt nur eine Art:
- Polystemonanthus dinklagei Harms: Sie kommt in der Elfenbeinküste und in Liberia vor.
- Scorodophloeus Harms: Die nur drei Arten sind vom westlichen-zentralen bis ins östliche tropische Afrika und Mosambik verbreitet.[30]
- Talbotiella Baker f.: Die etwa fünf Arten kommen im westlichen Afrika in Kamerun, Nigeria, Gabun, Ghana, Guinea und in der Republik Kongo vor.
- Tamarindus L.: Es gibt nur eine Art:
- Tetraberlinia (Harms) Hauman: Die etwa fünf Arten kommen im tropischen Afrika in der nördlichen Exklave von Angola Provinz Cabinda, in Kamerun, Äquatorial-Guinea, Gabun, Liberia, in der Republik Kongo und in der Demokratischen Republik Kongo vor.
- Zenkerella Taub. (Syn.: Podogynium Taub.): Die fünf oder sechs Arten kommen von Kamerun über Gabun bis Nigeria und in Tansania vor.
- Amherstia Wall.: Es gibt nur eine Art:
- Tribus Barnebydendreae Estrella, L.P.Queiroz & Bruneau: Sie wurde 2018 aufgestellt[18] und enthält nur etwa zwei monotypische Gattungen:
- Barnebydendron J.H.Kirkbr. (Syn.: Phyllocarpus Riedel ex Tul.): Sie wurde 1999 aufgestellt und enthält nur eine Art:
- Barnebydendron riedelii (Tul.) J.H.Kirkbr.: Sie ist in der Neotropis verbreitet.
- Goniorrhachis Taub.: Es gibt nur eine Art:
- Goniorrhachis marginata Taub.: Sie kommt im östlichen Brasilien vor.
- Barnebydendron J.H.Kirkbr. (Syn.: Phyllocarpus Riedel ex Tul.): Sie wurde 1999 aufgestellt und enthält nur eine Art:
- Tribus Detarieae DC.:[32][33] Sie enthält etwa 21 Gattungen:
- Augouardia Pellegr.: Sie enthält nur eine Art:
- Augouardia letestui Pellegr.: Sie kommt in Gabun und in der Republik Kongo vor.
- Baikiaea Benth.: Die etwa sechs Arten sind hauptsächlich im tropischen Afrika verbreitet, nur eine Art kommt auch im subtropischen Afrika (in Angola, Botswana, Namibia, Sambia und Simbabwe) vor.
- Brandzeia Baill. (Syn.: Bathiaea Drake): Sie enthält nur eine Art:
- Brandzeia filicifolia Baill.: Sie kommt in Madagaskar vor.
- Colophospermum J.Kirk ex J. Léonard: Es gibt nur eine Art:
- Colophospermum mopane (J.Kirk ex Benth.) J.Léonard
- Copaifera L. (Syn.: Copaiba Mill., Copaiva Jacq., Cotylelobiopsis F.Heim, Pseudosindora Symington): Die etwa 42 Arten sind in der Neotropis, im tropischen West- bis Zentralafrika und auf Borneo verbreitet.
- Daniellia Benn. (Syn.: Cyanothyrsus Harms, Paradaniellia Rolfe): Die etwa zehn Arten sind im tropischen Afrika verbreitet.[34]
- Detarium Juss.: Die etwa drei Arten sind im tropischen Afrika verbreitet.
- Eperua Aubl. (Syn.: Adleria Neck., Dimorpha Schreb., Panzera Willd., Parivoa Aubl., Rotmannia Neck.): Die etwa 16 Arten sind im tropischen Südamerika verbreitet: beispielsweise:
- Eperua falcata Aubl.: Sie kommt Kolumbien, Venezuela, im nördlichen Brasilien, in den Guyanas und auf der Insel Trinidad vor.
- Eurypetalum Harms: Die nur zwei Arten kommen in Kamerun, Äquatorial-Guinea sowie Gabun vor.
- Gilletiodendron Vermoesen (Syn.: Cymonetra Roberty): Die etwa fünf Arten kommen in Afrika vor, beispielsweise:
- Gilletiodendron mildbraedii (Harms) Vermoesen
- Guibourtia Benn. (Syn.: Gorskia Bolle, Pseudocopaiva Britton & P.Wilson): Die etwa 16 Arten sind im Tropischen bis südlichen Afrika und im tropischen Südamerika sowie in Kuba verbreitet.
- Hardwickia Roxb.: Sie enthält nur eine Art:
- Hardwickia binata Roxb.: Sie kommt in Indien sowie Bangladesch vor.
- Hylodendron Taub.: Sie enthält nur eine Art:
- Hylodendron gabunense Taub.: Sie kommt im tropischen Afrika in Kamerun, Nigeria, Gabun, in der Demokratische Republik Kongo und in der Zentralafrikanischen Republik vor.
- Hymenaea L. (Syn.: Courbaril Mill., Tanroujou Juss., Trachylobium Hayne, Valcarcelia Lag.): Die etwa 22 Arten sind in der Neotropis und in Ostafrika verbreitet und sind in einigen tropischen Ländern Neophyten.
- Neoapaloxylon Rauschert (Syn.: Apaloxylon Drake): Die etwa drei Arten kommen in Madagaskar vor.
- Peltogyne Vogel: Die etwa 24 Arten sind im südwestlichen Mexiko, in Costa Rica, im tropischen Südamerika und in Trinidad-Tobago verbreitet. Einige Arten dieser Gattung liefern das die Holzart Amaranth; beispielsweise:
- Peltogyne venosa (Vahl) Benth.: Sie ist im tropischen Südamerika verbreitet.
- Prioria Griseb. (Syn.: Eriander H.J.P.Winkl., Gossweilerodendron Harms, Kingiodendron Harms, Oxystigma Harms, Pterygopodium Harms): Die etwa 14 Arten kommen in Zentralamerika (eine Art), auf Jamaika, in Kolumbien, im tropischen Afrika (sechs Arten), in Indien, auf den Philippinen, in Papuasien und in Fidschi vor;[35] beispielsweise:
- Prioria oxyphylla (Harms) Breteler: Sie kommt von Nigeria bis ins tropischen Zentralafrika vor.
- Sindora Miq.
- Sindoropsis J.Léonard: Sie enthält nur eine Art:
- Sindoropsis letestui (Pellegr.) J.Léonard: Sie kommt nur in Gabun vor.
- Stemonocoleus Harms: Sie enthält nur eine Art:
- Stemonocoleus micranthus Harms: Sie kommt im tropischen Westafrika bis westlichen Zentralafrika vor.
- Tessmannia Harms: Die etwa 13 Arten sind im tropischen Afrika verbreitet.
- Augouardia Pellegr.: Sie enthält nur eine Art:
- Tribus Saraceae Estrella, L.P.Queiroz & Bruneau: Sie wurde 2018 aufgestellt[18] und enthält nur etwa vier Gattungen:
- Endertia Steenis & de Wit: Es gibt nur eine Art:
- Endertia spectabilis Steenis & de Wit: Sie kommt auf Java und Borneo vor.
- Leucostegane Prain: Die nur zwei Arten kommen von der Malaiischen Halbinsel über Sumatra bis Borneo vor.
- Lysidice Hance: Die nur zwei Arten kommen vom südlichen bis südwestlichen China und in Vietnam vor.[36]
- Saraca L. (Syn.: Celebnia Noronha, Jonesia Roxb.): Die etwa elf Arten sind vom Indischen Subkontinent über China und Indochina bis Malesien weitverbreitet.
- Endertia Steenis & de Wit: Es gibt nur eine Art:
- Tribus Schotieae Estrella, L.P.Queiroz & Bruneau: Sie wurde 2018 aufgestellt[18] und enthält nur eine Gattung:
- Schotia Jacq. (Syn.: Guillandinodes Kuntze, Theodora Medik.): Die etwa vier Arten sind vom südlichen tropischen Afrika bis ins südliche Afrika verbreitet.

Unterfamilie Dialioideae
- Die Unterfamilie Dialioideae Azani et al. (Syn.: Dialiinae H.S.Irwin & Barneby, Poeppigieae Britton & Rose, Labicheinae H.S.Irwin & Barneby) wurde 2017 aufgestellt[1][37] und enthält etwa 17 Gattungen mit etwa 85 Arten.[38] Diese Arten gehörten vor 2017 zur Unterfamilie der Caesalpinioideae.[37] Die Früchte öffnen sich meist nicht und enthalten nur ein bis zwei Samen. Die Laubblätter sind meist unpaarig gefiedert. Diese verholzenden Pflanzenarten wachsen meist als Bäume und sind von warmen bis tropischen Gebieten in Afrika, Australien im südlichen China und in der Neotropis verbreitet:[38]
- Androcalymma Dwyer: Es gibt nur eine Art:[37]
- Androcalymma glabrifolium Dwyer: Sie kommt im nördlichen Brasilien vor.
- Apuleia Mart. (Syn.: Apoleya Gleason, Zenkeria Arn.): Es gibt nur eine Art:[37]
- Apuleia leiocarpa (Vogel) J.F.Macbr.: Sie ist in Südamerika weitverbreitet.
- Baudouinia Baill.: Die etwa sechs Arten kommen nur in Madagaskar vor.
- Dialium L. (Syn.: Andradia Sim, Arouna Aubl., Cleyria Neck., Codarium Sol. ex Vahl, Correa M.E.Becerra, Dansera Steenis, Rhynchocarpa Backer ex K.Heyne, Sciaplea Rauschert, Sennia Chiov.): Die etwa 36 Arten sind in den Subtropen bis Tropen verbreitet.
- Dialium guianense (Aubl.) Sandwith: Mittleres bis nördliches Südamerika, Zentralamerika, bis ins südliche Mexiko.
- Dicorynia Benth.: Die etwa zwei Arten sind im tropischen Südamerika verbreitet.
- Distemonanthus Benth.: Es gibt nur eine Art:[37]
- Distemonanthus benthamianus Baill.: Sie kommt im tropischen Westafrika bis westlichen Zentralafrika vor.
- Eligmocarpus Capuron: Es gibt nur eine Art:[37]
- Eligmocarpus cynometroides Capuron: Sie kommt nur im südöstlichen Madagaskar vor.
- Kalappia Kosterm.: Es gibt nur eine Art:[37]
- Kalappia celebica Kosterm.: Dieser Endemit kommt nur in Sulawesi vor.
- Koompassia Maingay ex Benth. (Syn.: Abauria Becc.): Die etwa drei Arten sind von Thailand über die Malaiische Halbinsel, die Philippinen, Sumatra und Borneo bis Neuguinea verbreitet.
- Labichea Gaudich. ex DC.: Die etwa 16 Arten kommen nur im nördlichen Australien vor.
- Martiodendron Gleason (Sayn.: Martia Benth., Martiusia Benth.): Die etwa fünf Arten sind im nördlichen Südamerika verbreitet.
- Mendoravia Capuron: Es gibt nur eine Art:[37]
- Mendoravia dumaziana Capuron: Sie kommt in Madagaskar vor.
- Petalostylis R.Br. (Syn.: Petalogyne F.Muell.): Die etwa zwei Arten kommen in Australien vor.
- Poeppigia C.Presl (Syn.: Ramirezia A.Rich.): Die etwa zwei Arten sind in der Neotropis verbreitet.
- Storckiella Seem (Syn.: Doga (Baill.) Baill. ex Nakai): Die etwa vier Arten kommen nur auf Fiji, Neukaledonien und in Queensland vor.
- Uittienia Steenis: Es gibt nur eine Art:[37]
- Uittienia modesta Steenis: Sie kommt auf Sumatra und Borneo vor.
- Zenia Chun: Es gibt nur eine Art:[37]
- Zenia insignis Chun: Sie kommt vom südlichen China (Guangdong, Guangxi und vielleicht Yunnan) bis Vietnam vor.[36]
- Androcalymma Dwyer: Es gibt nur eine Art:[37]
Unterfamilie Duparquetioideae
- Die Unterfamilie Duparquetioideae Azani et al. (Syn.: Duparquetiinae H.S.Irwin & Barneby) wurde 2017 aufgestellt und enthält nur eine monotypische Gattung:[1]
- Duparquetia Baill. (Syn.: Oligostemon Benth.): Es gibt nur eine Art:
- Duparquetia orchidacea Baill.: Sie ist vom tropischen West- bis Zentralafrika verbreitet.
- Duparquetia Baill. (Syn.: Oligostemon Benth.): Es gibt nur eine Art:
Evolution
Der Ursprung der Familie Fabaceae wird in der späten Kreidezeit (vor 65 bis 70 Millionen Jahren) vermutet.
Siehe auch
Quellen
- Die Familie der Fabaceae bei der APWebsite. (englisch)
- Die Familie der Fabaceae bei DELTA von L. Watson and M. J. Dallwitz. (englisch)
- Martin F. Wojciechowski, Matt Lavin, Michael J. Sanderson: A Phylogeny of Legumes (Leguminosae) Based on Analysis of the Plastid matK Gene Resolves Many Well-supported Subclades Within the Family. In: American Journal of Botany, Volume 91, Issue 11, November 2004, ISSN 0002-9122, S. 1846–1862, online.
- Martin F. Wojciechowski, Johanna Mahn, Bruce Jones: Fabaceae – Legumes: Eintrag beim Tree-of-Life-Projekt, 2006.
Einzelnachweise
- The Legume Phylogeny Working Group = LPWG: A new subfamily classification of the Leguminosae based on a taxonomically comprehensive phylogeny. In: Taxon, Volume 66, Issue 1, 2017, S. 44–77. doi:10.12705/661.3
- Scott W. Behie, Paul M. Zelisko, Michael J. Bidochka: Endophytic Insect-Parasitic Fungi Translocate Nitrogen Directly from Insects to Plants. In: Science. Band 336, 2012, S. 1576–1577, doi:10.1126/science.1222289.
- Nutritive und antinutritive Inhaltsstoffe der Leguminosen, (Memento vom 19. August 2009 im Internet Archive) zuletzt eingesehen im September 2009.
- Sofia Quaglia: Legumes research gets flexitarian pulses racing with farming guidance. 13. April 2021, abgerufen am 13. April 2021 (englisch).
- The Environmental Role of Protein Crops in the New Common Agricultural Policy - Think Tank. In: www.europarl.europa.eu. Abgerufen am 18. März 2016.
- Sara Preissel, Moritz Reckling, Nicole Schläfke, Peter Zander: Magnitude and farm-economic value of grain legume pre-crop benefits in Europe: A review. In: Field Crops Research. Band 175, 1. April 2015, S. 64–79, doi:10.1016/j.fcr.2015.01.012.
- Moritz Reckling, Jens-Martin Hecker, Göran Bergkvist, Christine A. Watson, Peter Zander: A cropping system assessment framework—Evaluating effects of introducing legumes into crop rotations. In: European Journal of Agronomy. doi:10.1016/j.eja.2015.11.005.
- Sofia Quaglia: Legumes research gets flexitarian pulses racing with farming guidance. 13. April 2021, abgerufen am 13. April 2021 (englisch).
- John Lindley: An Introduction to the Natural System of Botany, 1836, 148.
- Fabaceae im Germplasm Resources Information Network (GRIN), USDA, ARS, National Genetic Resources Program. National Germplasm Resources Laboratory, Beltsville, Maryland.
- Martin F. Wojciechowski, Johanna Mahn, Bruce Jones: Fabaceae – Legumes: Eintrag beim Tree-of-Life-Projekt, 2006. (englisch)
- R. P. Wunderlin: Reorganization of the Cercideae (Fabaceae: Caesalpinioideae). In: Phytoneuron, Volume 48, 2010, S. 1–5. PDF.
- Liam Trethowan, Ruth Clark, Barbara A. Mackinder: A synopsis of the neotropical genus Schnella (Cercideae: Caesalpinioideae: Leguminosae) including 12 new combinations. In: Phytotaxa, Volume 204, Issue 4, April 2015. doi:10.11646/phytotaxa.204.4.1
- Ruth P. Clark, Barbara A. Mackinder, Hannah Banks: Cheniella gen. nov. (Leguminosae: Cercidoideae) from southern China, Indochina and Malesia. In: European Journal of Taxonomy, Volume 360, 2017, S. 1–37. online doi:10.5852/ejt.2017.360.
- Y.-H. Wang, S. Wicke, H. Wang, J.-J. Jin, S.-Y. Chen, S.-D. Zhang, D.-Z. Li, T.-S. Yi: Plastid Genome Evolution in the Early-Diverging Legume Subfamily Cercidoideae (Fabaceae). In: Frontiers in Plant Science., Volume 138, 2018, S. 1–12. doi:10.3389/fpls.2018.00138
- Carole Sinou, Warren Cardinal-McTeague, Anne Bruneau: Testing generic limits in Cercidoideae (Leguminosae): Insights from plastid and duplicated nuclear gene sequences. In: Taxon, Volume 69, Issue 1, April 2020, S. 67–86. doi:10.1002/tax.12207
- Manuel de la Estrella, Félix Forest, Jan J. Wieringa, Marie Fougère‐Danezan, Anne Bruneau: Insights on the evolutionary origin of Detarioideae, a clade of ecologically dominant tropical African trees. In: New Phytologist, Volume 214, Issue 44, März 2017, S. 1722–1735. doi:10.1111/nph.14523
- Manuel de la Estrella, Félix Forest, B. Klitgård, Gwilym P. Lewis, Barbara A. Mackinder, L. P. de Queiroz, Jan J. Wieringa, Anne Bruneau: A new phylogeny-based tribal classification of subfamily Detarioideae, an early branching clade of florally diverse tropical arborescent legumes. In: Scientific Reports, Volume 8, Issue 1, 2018, S. 6884. doi:10.1038/s41598-018-24687-3
- A. S. L. Donkpegan et al.: Evolution in African tropical trees displaying ploidy-habitat association: the genus Afzelia (Leguminosae). In: Mol. Phylogenet. Evol. Volume 107, 2017, S. 270–281. doi:10.1016/j.ympev.2016.11.004
- Barbara A. Mackinder, Jan J. Wieringa: Annea gen. nov. (Detarieae, Caesalpinioideae, Leguminosae), a home for two species long misplaced in Hymenostegia sensu lato. In: Phytotaxa, Volume 142, Issue 1, 2013, S. 1–14 | doi:10.11646/phytotaxa.142.1.1
- Frans J. Breteler: Revision of the African genus Anthonotha (Leguminosae, Caesalpinioideae). In: Plant Ecology and Evolution. Volume 143, Issue 1, 2010, S. 70–99. DOI:10.5091/plecevo.2010.369
- B.Mackinder, R. T. Pennington: Monograph of Berlinia (Leguminosae). In: Syst. Bot. Monogr., Volume 91, 2011, S. 1–117.
- Philip A. Silverstone-Sopkin: A New Species of Browneopsis (Leguminosae, Caesalpinioideae) from the Cauca Valley, Colombia. In: Novon: A Journal for Botanical Nomenclature, Volume 20, Issue 2, 2010, S. 207–211. doi:10.3417/2008100
- A. Radosavljevic, B. A. Mackinder, P. S. Herendeen: Phylogeny of the Detarioid Legume genera Cynometra and Maniltoa (Leguminosae). In: Syst. Bot. Volume 42, 2017, S. 670–679.
- Ecuadendron acosta-solisianum in der Roten Liste gefährdeter Arten der IUCN 2011. Eingestellt von: D. Neill, N. Pitman, 2004. Abgerufen am 19.10.2011.
- Manuel de la Estrella, Jan J. Wieringa, Frans J. Breteler, Dario I. Ojeda: Re-evaluation of the genus Englerodendron (Leguminosae–Detarioideae), including Isomacrolobium and Pseudomacrolobium. In: Australian Systematic Botany, Volume 32, Oktober 2019, S. 564–571. doi:10.1071/SB18075 Volltext-PDF.
- J. J. Wieringa, Barbara A. Mackinder (A. S. J. van Proosdij): Gabonius gen. nov. (Leguminosae, Caesalpinioideae, Detarieae), a distant cousin of Hymenostegia endemic to Gabon. In: Phytotaxa, Volume 142, Issue 1, 2013, S. 15–24. doi:10.11646/phytotaxa.142.1.2 online.
- Manuel de la Estrella, Jan J. Wieringa, Barbara A. Mackinder, Xander van der Burgt, J. A. Devesa, Anne Bruneau: Phylogenetic analysis of the African genus Gilbertiodendron J. Léonard and related genera (Leguminosae-Caesalpinioideae-Detarieae). In: International Journal of Plant Sciences, Volume 175, Issue 9, 2014, S. 975–985. doi:10.1086/677648
- Xander M. van der Burgt, Barbara A. Mackinder, Jan J. Wieringa, Manuel de la Estrella: The Gilbertiodendron ogoouense species complex (Leguminosae: Caesalpinioideae), Central Africa. In: Kew Bulletin, Volume 70, Issue 22, 2015. doi:10.1007/s12225-015-9579-4
- Barbara A. Mackinder, H. Saslis-Lagoudakis, Jan J. Wieringa, D. Devey, F. Forest, Anne Bruneau: The tropical African legume Scorodophloeus clade includes two undescribed Hymenostegia segregate genera and Micklethwaitia, a rare, monospecific genus from Mozambique. In: S. Afr. J. Bot., Volume 89, 2013, S. 156–163. doi:10.1016/j.sajb.2013.07.002
- Bruce Murphy, Manuel de la Estrella, Rowan Schley, Félix Forest, Bente Klitgård: On the Monophyly of Macrolobium Schreb., an Ecologically Diverse Neotropical Tree Genus (Fabaceae-Detarioideae). In: International Journal of Plant Sciences, Volume 179, Issue 11, Dezember 2017, S. 75–86. doi:10.1086/695338
- M. Fougère-Danezan, P. S. Herendeen, S. Maumont, A. Bruneau: Morphological evolution in the variable resin-producing Detarieae (Fabaceae): do morphological characters retain a phylogenetic signal? In: Annals of Botany, Volume 105, Issue 2, 2010, S. 311–325. doi:10.1093/aob/mcp280
- A. Bruneau, B. B. Klitgård, G. Prenner, M. Fougère-Danezan, S. C. Tucker: Floral evolution in the Detarieae (Leguminosae): Phylogenetic evidence for labile floral development in an early-diverging legume lineage. In: International Journal of Plant Sciences, Volume 175, Issue 4, 2014, S. 392–417. doi:10.1086/675574 Volltext-PDF
- Manuel de la Estrella, Carlos Aedo, Barbara Mackinder, Mauricio Velayos: Taxonomic Revision of Daniellia (Leguminosae: Caesalpinioideae). In: Systematic Botany, Volume 35, Issue 2, 2010, S. 296–324, DOI:10.1600/036364410791638414, (PDF-Datei; 4,6 MB).
- F. J. Breteler: A revision of Prioria, including Gossweilerodendron, Kingiodendron, Oxystigma, and Pterygopodium (Leguminosae-Caesalpinioideae-Detarieae) with emphasis on Africa. In: Wageningen Agr. Univ. Pap. Volume 99, 1999, S. 1–61. Volltext-PDF.
- Shugang Li, Langran Xu, Dezhao Chen, Xiangyun Zhu, Puhua Huang, Zhi Wei, Ren Sa, Dianxiang Zhang, Bojian Bao, Delin Wu, Hang Sun, Xinfen Gao, Supee S. Larsen, Ivan Nielsen, Dieter Podlech, Yingxin Liu, Hiroyoshi Ohashi, Zhaoyang Chang, Kai Larsen, Jianqiang Li, Stanley L. Welsh, Michael A. Vincent, Mingli Zhang, Michael G. Gilbert, Les Pedley, Brian D. Schrire, Gennady P. Yakovlev, Mats Thulin, Ivan C. Nielsen, Byoung-Hee Choi, Nicholas J. Turland, Roger M. Polhill, Supee Saksuwan Larsen, Ding Hou, Yu Iokawa, C. Melanie Wilmot-Dear, Gregory Kenicer, Tomoyuki Nemoto, J. Michael Lock, Alfonso Delgado Salinas, Tatiana E. Kramina, Anthony R. Brach, Bruce Bartholomew, Dmitry D. Sokoloff: In Flora of China, Volume 10, 2010. Fabaceae (LEGUMINOSAE), S. 1–558 - textgleich online wie gedrucktes Werk.
- Erin Zimmerman, Patrick S. Herendeen, Gwilym P. Lewis, Anne Bruneau: Floral evolution and phylogeny of the Dialioideae, a diverse subfamily of tropical legumes. In: American Journal of Botany, Volume 104, 2017, S. 1019–1041. doi:10.3732/ajb.1600436 PDF.
- Han-Rui Bai, Oyetola Oyebanji, Rong Zhang, Ting-Shuang Yi: Plastid phylogenomic insights into the evolution of subfamily Dialioideae (Leguminosae). In: Plant Diversity, Volume 43, Issue 1, Februar 2021, S. 27–34. doi:10.1016/j.pld.2020.06.008
Weblinks
- International Legume Database (englisch)