Trichlorfluormethan
Trichlorfluormethan ist ein Fluorchlorkohlenwasserstoff (FCKW) und wird als Kältemittel R-11 oder als Treibgas verwendet. Da es wie alle FCKW als Ozonschicht-zerstörend eingestuft wird, wird es mehr und mehr durch umweltfreundlichere Stoffe ersetzt.
| Strukturformel | |||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
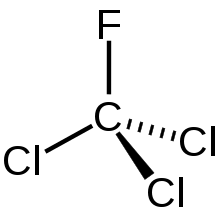 | |||||||||||||||||||
| Allgemeines | |||||||||||||||||||
| Name | Trichlorfluormethan | ||||||||||||||||||
| Andere Namen |
| ||||||||||||||||||
| Summenformel | CCl3F | ||||||||||||||||||
| Kurzbeschreibung |
nicht brennbare farblose Flüssigkeit oder Gas mit etherischem Geruch[1] | ||||||||||||||||||
| Externe Identifikatoren/Datenbanken | |||||||||||||||||||
| |||||||||||||||||||
| Eigenschaften | |||||||||||||||||||
| Molare Masse | 137,37 g·mol−1 | ||||||||||||||||||
| Aggregatzustand |
flüssig[1] | ||||||||||||||||||
| Dichte |
1,479 g·cm−3 (flüssig)[1] | ||||||||||||||||||
| Schmelzpunkt | |||||||||||||||||||
| Siedepunkt |
23,6 °C[1] | ||||||||||||||||||
| Dampfdruck | |||||||||||||||||||
| Löslichkeit | |||||||||||||||||||
| Sicherheitshinweise | |||||||||||||||||||
| |||||||||||||||||||
| MAK | |||||||||||||||||||
| Treibhauspotential |
5352 (bezogen auf 100 Jahre)[4] | ||||||||||||||||||
| Thermodynamische Eigenschaften | |||||||||||||||||||
| ΔHf0 |
−301,3 kJ/mol[5] | ||||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | |||||||||||||||||||
Gewinnung und Darstellung
Trichlorfluormethan kann durch Reaktion von Tetrachlormethan mit Fluorwasserstoff bei 435 °C und 70 atm gewonnen werden, wobei ein Gemisch von Trichlorfluormethan, Tetrachlormethan und Dichlordifluormethan in einem Verhältnis von 77:18:5 entsteht. Die Reaktion kann auch in Gegenwart von Antimon(III)-chlorid oder Antimon(V)-chlorid ausgeführt werden.[6]
Trichlorfluormethan entsteht auch als eines der Nebenprodukte bei der Reaktion von Graphit mit Chlor und Fluorwasserstoff bei 500 °C.[6]
Natriumhexafluorosilicat unter Druck bei 270 °C, Titan(IV)-fluorid, Chlortrifluorid, Cobalt(III)-fluorid, Iodpentafluorid und Bromtrifluorid sind ebenfalls als Fluorierungsmittel für Tetrachlormethan geeignet.[6][7]
Auch Antimon(III)-fluorid in Gegenwart von Antimon(V)-chlorid ist als Fluorierungsmittel geeignet.[8]
Im Labor kann auch die Hunsdiecker-Reaktion zur Synthese von Trichlorfluormethan (in 63 % Ausbeute) aus Silberdichlorfluoracetat und Chlor eingesetzt werden.[6]
Eigenschaften
Bei Kontakt mit Flammen oder heißen Gegenständen zersetzt es sich und bildet dabei sehr toxische und korrosive Dämpfe (Chlor, Chlorwasserstoff, Fluorwasserstoff). Mit Metallen wie Aluminium, Barium, Calcium, Magnesium und Natrium erfolgt eine heftige Reaktion. Beim Erhitzen auf hohe Temperaturen beim Löten, durch Funken oder Zigaretten zerfällt das Gas zu toxischen Verbindungen wie Chlor- (HCl) oder Fluorwasserstoff (HF).[9]
Verwendung
Bis in die 1990er-Jahre wurde Trichlorfluormethan als R-11 in Kühlschränken oder als Treibgas, etwa zum Schäumen von Polyurethan, eingesetzt.[8]
Die Verbindung wird auch als Lösungsmittel in vielen Reaktionen und als interner Standard in der 19F-NMR-Spektroskopie verwendet.[2]
Umwelteinfluss
Herstellung und Verwendung vieler halogenierter Kohlenwasserstoffe, die wie Trichlorfluormethan die schützende Ozonschicht der Erdatmosphäre zerstören, wurden über das Montreal-Protokoll ab 1987 verboten. Ab 1. August 1991 traten in Deutschland je nach Einsatzzweck unterschiedliche Herstellungs-, Verwendungs- und Verkehrsverbote sowie diverse Kennzeichnungs-, Instandhaltungs-, Dokumentations- und Rücknahmeverpflichtungen in Kraft; das Inverkehrbringen von R-11 und von Erzeugnissen, die mit R-11 befüllt waren, wurde unzulässig, das Nachfüllen in vorher hergestellte Klimaanlagen und das Inverkehrbringen dazu blieben aber übergangsweise zulässig, so lange keine Ersatzstoffe mit niedrigerem Ozonabbaupotential verfügbar waren[10]. Inzwischen sind Produktion und Verwendung von Trichlorfluormethan, seiner Gemische und Recyclate sowie das Inverkehrbringen von Erzeugnissen, die so etwas enthalten oder zum Betrieb brauchen, durch direkt geltendes EU-Recht verboten[11].
Trichlorfluormethan hat ein hohes Ozonabbaupotential und zugleich ein 5352-fach höheres Treibhauspotential als Kohlendioxid.[4] In der Londoner Konferenz von 1990 war beschlossen worden, bis zum Jahr 2000 weltweit die Herstellung von Trichlorfluormethan und anderen FCKW einzustellen.
Nach einer 2018 veröffentlichten Studie nahm der Gehalt an Trichlorfluormethan in der Atmosphäre seit dem Jahr 2012 langsamer ab als in den Jahren zuvor, wobei der Gehalt auf der Nordhalbkugel höher war als auf der Südhalbkugel.[12] Gemäß der in London ansässigen gemeinnützigen Environmental Investigation Agency sei dafür die andauernde Verwendung von Trichlorfluormethan (= CFC-11) in China zur Aufschäumung von Polyurethan verantwortlich, das zu Isolierungszwecken verwendet wird. Das seit 2010 auch für China geltende Verbot von Trichlorfluormethan werde von den dortigen Behörden nicht überwacht. Ein chinesischer Verkäufer von CFC-11 schätzte, dass rund 70 % des hergestellten Polyurethans trotz Verbots weiterhin mit Trichlorfluormethan aufgeschäumt wird (Stand 2018).[13] Anfang 2021 wurde aufgezeigt, dass die Emissionen aus China stark zurückgegangen sind.[14]
 Konzentration in der Atmosphäre über die Zeit
Konzentration in der Atmosphäre über die Zeit Konzentration an der Meeresoberfläche Ende der 1990er-Jahre
Konzentration an der Meeresoberfläche Ende der 1990er-Jahre
Weblinks
Einzelnachweise
- Eintrag zu Trichlorfluormethan in der GESTIS-Stoffdatenbank des IFA, abgerufen am 20. Januar 2022. (JavaScript erforderlich)
- Donald J. Burton, Vinod Jairaj: Trichlorofluoromethane. In: Encyclopedia of Reagents for Organic Synthesis. DOI:10.1002/047084289X.rn00550.
- Schweizerische Unfallversicherungsanstalt (Suva): Grenzwerte – Aktuelle MAK- und BAT-Werte (Suche nach 75-69-4 bzw. Trichlorfluormethan), abgerufen am 2. November 2015.
- G. Myhre, D. Shindell, F.-M. Bréon, W. Collins, J. Fuglestvedt, J. Huang, D. Koch, J.-F. Lamarque, D. Lee, B. Mendoza, T. Nalajima, A. Robock, G. Stephens, T. Takemura, H. Zhang et al.: Climate Change 2013: The Physical Science Basis. Working Group I contribution to the IPCC Fifth Assessment Report. Hrsg.: Intergovernmental Panel on Climate Change. 2013, Chapter 8: Anthropogenic and Natural Radiative Forcing, S. 24–39; Table 8.SM.16 (PDF).
- David R. Lide (Hrsg.): CRC Handbook of Chemistry and Physics. 90. Auflage. (Internet-Version: 2010), CRC Press/Taylor and Francis, Boca Raton, FL, Standard Thermodynamic Properties of Chemical Substances, S. 5-19.
- Alan R. Katritzky, Thomas L. Gilchrist, Otto Meth-Cohn, Charles Wayne Rees: Comprehensive Organic Functional Group Transformations. Elsevier, 1995, ISBN 978-0-08-042704-1, S. 220 (eingeschränkte Vorschau in der Google-Buchsuche).
- A. A. Banks, H. J. Emeléus u. a.: 443. The reaction of bromine trifluoride and iodine pentafluoride with carbon tetrachloride, tetrabromide, and tetraiodide and with tetraiodoethylene. In: J. Chem. Soc., 1948, S. 2188, doi:10.1039/JR9480002188.
- Jennifer Orme-Zavaleta, Jan Connery: Drinking Water Health Advisory Volatile Organic Compounds. CRC Press, 1990, ISBN 978-0-87371-436-5, S. 21 (eingeschränkte Vorschau in der Google-Buchsuche).
- Datenblatt R-11 (PDF; 71 kB) bei National Refrigerants, abgerufen am 14. Juni 2016.
- § 1 Abs. 1 Ziff. 1, § 2 ff. der Verordnung zum Verbot von bestimmten die Ozonschicht abbauenden Halogenkohlenwasserstoffen (FCKW-Halon-Verbots-Verordnung), Übergangsregelung für Kältemittel § 10 Abs. 2; laut bauweise.net: Schwerpunkt Wärmepumpe – Kältemittel Verbot ab 1995
- Artikel 4–6 der Verordnung (EG) Nr. 1005/2009 des Europäischen Rates und des Parlaments vom 16. September 2009 über Stoffe, die zum Abbau der Ozonschicht führen; Listung als darin geregelter Stoff in Anhang I Gruppe I; vorher VO (EG) Nr. 2037/2000. Ein Verstoß gegen die Verbote ist in Deutschland nach 27 Abs. 1 Ziff. 3 ChemG in Verbindung mit § 12 Nr. 4 ChemSanktionsV strafbar
- Someone, somewhere, is making a banned chemical that destroys the ozone layer, scientists suspect. In: Washington Post, 16. Mai 2018. Abgerufen am 17. Mai 2018.
- Matt McGrath: Ozone hole mystery: China insulating chemical said to be source of rise. In: BBC News. 9. Juli 2018, abgerufen am 9. Juli 2018 (englisch).
- Jeff Tollefson: Illegal CFC emissions have stopped since scientists raised alarm. In: Nature. 10. Februar 2021, doi:10.1038/d41586-021-00360-0.
