Dichlordifluormethan
Dichlordifluormethan, auch als R-12 oder Freon-12 bezeichnet, ist ein ungiftiges, farbloses und verflüssigbares Gas. Es ist schwerer als Luft. In hohen Konzentrationen wirkt es erstickend. Es ist reaktionsträge und unbrennbar; bei sehr hohen Temperaturen kann es mit bestimmten Materialien mit großer Oberfläche (wie Aluminiumspänen, Kalium, Zink oder Magnesium) zur Explosion kommen.
| Strukturformel | |||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
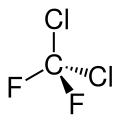 | |||||||||||||||||||
| Keilstrichformel zur Verdeutlichung der Geometrie | |||||||||||||||||||
| Allgemeines | |||||||||||||||||||
| Name | Dichlordifluormethan | ||||||||||||||||||
| Andere Namen |
| ||||||||||||||||||
| Summenformel | CCl2F2 | ||||||||||||||||||
| Kurzbeschreibung |
farbloses, unbrennbares Gas mit ätherischem Geruch[1] | ||||||||||||||||||
| Externe Identifikatoren/Datenbanken | |||||||||||||||||||
| |||||||||||||||||||
| Eigenschaften | |||||||||||||||||||
| Molare Masse | 120,91 g·mol−1 | ||||||||||||||||||
| Aggregatzustand |
gasförmig | ||||||||||||||||||
| Dichte | |||||||||||||||||||
| Schmelzpunkt | |||||||||||||||||||
| Siedepunkt |
−29,8 °C[1] | ||||||||||||||||||
| Dampfdruck | |||||||||||||||||||
| Löslichkeit |
schlecht in Wasser (300 mg·l−1)[1] | ||||||||||||||||||
| Sicherheitshinweise | |||||||||||||||||||
| |||||||||||||||||||
| MAK | |||||||||||||||||||
| Treibhauspotential |
11547 (bezogen auf 100 Jahre)[3] | ||||||||||||||||||
| Thermodynamische Eigenschaften | |||||||||||||||||||
| ΔHf0 |
−477,4 kJ/mol[4] | ||||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | |||||||||||||||||||
Chemisch gehört es zu den Halogenkohlenwasserstoffen und dort zur Gruppe der FCKW (Fluorchlorkohlenwasserstoffe) oder Freone. Bis zum weltweiten Verbot wurde es als Kältemittel und in Druckgaspackungen (Sprühdosen) als Treibgas verwendet. Es schädigt die Ozonschicht, falls es in die höhere Erdatmosphäre gelangt. R-12 wurde als Bezugssubstanz für das Ozonabbaupotential (ODP) festgelegt und hat daher ein ODP von 1.[5]
Gewinnung und Darstellung
Dichlordifluormethan kann durch Reaktion von Tetrachlormethan mit Fluorwasserstoff bei 490 °C und 70 atm gewonnen werden, wobei ein Gemisch von Trichlorfluormethan und Dichlordifluormethan in einem Verhältnis von 21:79 entsteht. Das Verhältnis kann durch Gegenwart von Antimon(III)-chlorid und Chlor noch verbessert werden.[6]
Natriumhexafluorosilicat unter Druck bei 270 °C, Titan(IV)-fluorid, Chlortrifluorid, Cobalt(III)-fluorid, Iodpentafluorid und Bromtrifluorid sind ebenfalls als Fluorierungsmittel für Tetrachlormethan geeignet.[6][7]
Auch Antimon(III)-fluorid in Gegenwart von Antimon(V)-chlorid ist als Fluorierungsmittel geeignet.[8]
Zu den Abbaureaktionen, die Dichlordifluormethan bilden, gehört die Chlorinolyse bei 550 °C von 1,1-Difluorethan, das durch Reaktion von Acetylen mit Fluorwasserstoff entsteht, oder Erhitzen von Silberchlordifluoracetat mit Chlor.[6]
Verbote
Herstellung und Verwendung vieler halogenierter Kohlenwasserstoffe, die wie Dichlordifluormethan die schützende Ozonschicht der Erde zerstören, wurden über das Montreal-Protokoll ab 1987 verboten. Die Europäische Union wurde 1988 Vertragspartei[9]. Ab 1. August 1991 traten in Deutschland je nach Einsatzzweck unterschiedliche Herstellungs-, Verwendungs- und Verkehrsverbote sowie diverse Kennzeichnungs-, Instandhaltungs-, Dokumentations- und Rücknahmeverpflichtungen in Kraft; das Inverkehrbringen von Erzeugnissen, die mit R-12 befüllt waren, wurde unzulässig, das Nachfüllen von R-12 etwa in vorher hergestellte Klimaanlagen und das Inverkehrbringen dazu blieben aber übergangsweise zulässig, so lange keine Ersatzstoffe mit niedrigerem Ozonabbaupotential verfügbar waren[10]. Inzwischen sind Produktion und Verwendung von Dichlordifluormethan, seiner Gemische und Recyclate sowie das Inverkehrbringen von Erzeugnissen, die so etwas enthalten oder zum Betrieb brauchen, durch direkt geltendes EU-Recht verboten; also außer zur geordneten Abfallentsorgung etwa der Verkauf oder die sonstige Weitergabe von gebrauchten Kühlschränken, die R-12 benötigen, selbst wenn dieses abgelassen oder entwichen ist[11].
Lediglich Schwellenländern (z. B. auch China) wurde der Einsatz für den Eigenbedarf bis 2010 völkerrechtlich gestattet. Die Produktionsmengen von R-12 in China übertrafen den Eigenbedarf deutlich. Es wurde auch in die EU importiert. Einfuhrverbote wurden dazu durch falsche Deklarationen umgangen.[12]
Umwelteinfluss
 Konzentration in der Atmosphäre über die Zeit
Konzentration in der Atmosphäre über die Zeit Konzentration (nmol/m³) im Meeresspiegel von R-12 (gemessen in den 1990er-Jahren)
Konzentration (nmol/m³) im Meeresspiegel von R-12 (gemessen in den 1990er-Jahren)
Weblinks
Einzelnachweise
- Eintrag zu Dichlordifluormethan in der GESTIS-Stoffdatenbank des IFA, abgerufen am 8. Januar 2021. (JavaScript erforderlich)
- Schweizerische Unfallversicherungsanstalt (Suva): Grenzwerte – Aktuelle MAK- und BAT-Werte (Suche nach 75-71-8 bzw. Dichlordifluormethan), abgerufen am 5. Mai 2020.
- G. Myhre, D. Shindell et al.: Climate Change 2013: The Physical Science Basis. Working Group I contribution to the IPCC Fifth Assessment Report. Hrsg.: Intergovernmental Panel on Climate Change. 2013, Chapter 8: Anthropogenic and Natural Radiative Forcing, S. 24–39; Table 8.SM.16 (ipcc.ch [PDF]).
- David R. Lide (Hrsg.): CRC Handbook of Chemistry and Physics. 90. Auflage. (Internet-Version: 2010), CRC Press/Taylor and Francis, Boca Raton, FL, Standard Thermodynamic Properties of Chemical Substances, S. 5-19.
- Eintrag zu Ozon-Abbaupotential. In: Römpp Online. Georg Thieme Verlag, abgerufen am 20. April 2011.
- Alan R. Katritzky, Thomas L. Gilchrist, Otto Meth-Cohn, Charles Wayne Rees: Comprehensive Organic Functional Group Transformations. Elsevier, 1995, ISBN 978-0-08-042704-1, S. 220–225 (eingeschränkte Vorschau in der Google-Buchsuche).
- A. A. Banks, H. J. Emeléus u. a.: 443. The reaction of bromine trifluoride and iodine pentafluoride with carbon tetrachloride, tetrabromide, and tetraiodide and with tetraiodoethylene. In: J. Chem. Soc.. 0, 1948, S. 2188, doi:10.1039/JR9480002188.
- Jennifer Orme-Zavaleta, Jan Connery: Drinking Water Health Advisory Volatile Organic Compounds. CRC Press, 1990, ISBN 978-0-87371-436-5, S. 21 (eingeschränkte Vorschau in der Google-Buchsuche).
- Entscheidung 88/540/EWG des Rates
- § 1 Abs. 1 Ziff.2, § 2 ff. der Verordnung zum Verbot von bestimmten die Ozonschicht abbauenden Halogenkohlenwasserstoffen (FCKW-Halon-Verbots-Verordnung), Übergangsregelung für Kältemittel § 10 Abs. 2
- Artikel 4–6 der Verordnung (EG) Nr. 1005/2009 des Europäischen Rates und des Parlaments vom 16. September 2009 über Stoffe, die zum Abbau der Ozonschicht führen; Listung als darin geregelter Stoff in Anhang I Gruppe I; vorher VO (EG) Nr. 2037/2000. Ein Verstoß gegen die Verbote ist in Deutschland nach 27 Abs. 1 Ziff. 3 ChemG in Verbindung mit § 12 Nr. 4 ChemSanktionsV strafbar
- Eco-Crimes – Verbrechen gegen die Natur, ARD, 2008.

