Thioaldehyde
Thioaldehyde (Thiale) sind organische, chemische Verbindungen. Sie stellen die Schwefel-Analoga von Aldehyden dar und gehören zu den Thiocarbonylverbindungen.[1]
| Thioaldehyde |
|---|
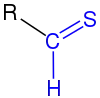 |
| Die Thioarbonylgruppe ist blau markiert. R = H, organischer Rest (Alkyl, Aryl o. ä.). |
Ihre funktionelle Gruppe besteht aus einem Thiocarbonylkohlenstoffatom, an welches ein Schwefelatom mit einer Doppel- und ein Wasserstoffatom mit einer Einfachbindung gebunden ist. Thioaldehyde sind wesentlich reaktiver als Aldehyde. Ihre Monomere bilden häufig Trimere, oligo- und polymere Produkte. Sie können jedoch thermodynamisch oder kinetisch stabilisiert werden.[2] Die technische Bedeutung von Thioaldehyden ist gering, allerdings kommen sie in der Natur vor. Beispielsweise entsteht Thioacrolein durch die Zersetzung von Allicin in Knoblauch.[1][3]
Eigenschaften
Thioaldehyde trimerisieren leicht zu Trithianen. Das Trimer von Thioacetaldehyd kann z. B. in der α-Form oder in der β-Form auftreten:[4]
| Isomerie von Trithianen (hier 2,4,6-Trimethyl-1,3,5-trithian) | |
|---|---|
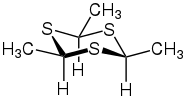 α-Form | 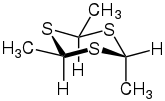 β-Form |
Die Umlagerung der α-Form in die β-Form – und umgekehrt – kann durch Katalysatoren wie Iod, Schwefelsäure, Salzsäure oder Säurechloride begünstigt werden. Bei aromatischen Thioaldehyden ist die Trimerisierungstendenz geringer.[5]
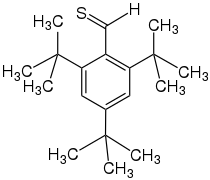
Die Stabilisierung von Thioaldehyden kann entweder sterisch durch räumlich große Reste erfolgen (kinetische Stabilisierung), wie z. B. im Fall von 2,4,6-Tri-tert-butylthiobenzaldehyd. Es trimerisiert und polymerisiert aufgrund der sterisch anspruchsvollen Reste nicht. Eine weitere Möglichkeit besteht in der thermodynamischen Stabilisierung, wobei mittels geeigneter Substituenten wie Aminen, Alkoholaten, Thiolaten oder Vinylgruppen (Vinylogie-Prinzip) die mesomere Stabilität erhöht und dadurch die Instabilität der Verbindung gesenkt wird. Thermodynamisch stabilisierte Thioaldehyde gelten als besonders stabil und isolierbar. Stabile aliphatische Thioaldehyde sind gewöhnlicherweise rosa und können kristallin oder als Öle auftreten. Stabile aromatische Thioaldehyde können lila, dunkelblau oder grün erscheinen und sind meistens kristallin.[6]
Synthese
Die Synthese von Thioaldehyden ist aufgrund des am Thiocarbonylkohlenstoffatom gebundenen Wasserstoffatoms schwierig.[6] Dennoch werden in der Literatur einige Synthesewege formuliert. Eine gängige Methode besteht in der Pyrolyse von Trithianen. Wenn hierfür z. B. 1,3,5-Trithian verwendet wird, entsteht Thioformaldehyd:[7][8]

Die dabei gebildeten Thioaldehyde werden zu neuen Trithianen rekombiniert. Dementsprechend liefern unterschiedlich substituierte Trithiane unterschiedlich substituierte Produkte. Eine Alternative ist die Umsetzung von Acetaldehyd (oder anderen Aldehyden) mit durch Trimethylsilyl substituiertem Schwefel und Butyllithium, welche zu Thioacetaldehyd führt.[6] Eine ähnliche Reaktion kann mit Cobalt(II)-chlorid durchgeführt werden.[6]
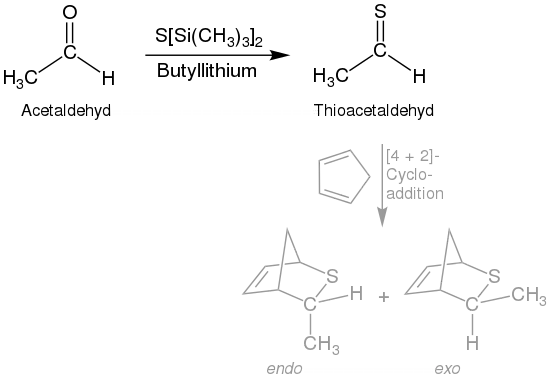
Die dabei entstehenden Thioaldehyde sind instabil. Ihre Existenz wird durch die anschließende Diels-Alder-Reaktion mit Cyclopentadien nachgewiesen. Das Überführen von Thioaldehyden in Diels-Alder-Addukte gehört zu den gängigen Verfahren, weil es sich bei dieser Cycloadditionen häufig um eine reversible Reaktion handelt.[9] Thioaldehyde sind allgemein reaktionfreudige Dienophile mit 1,3-Dienen in Diels-Alder-Reaktionen.[5][10] Diese können auch intramolekular erfolgen.[11] Die Diels-Alder-Reaktion ist mit photometrisch generierten Thioaldehyden an polymeren Oberflächen ebenfalls möglich.[12][13] Thioaldehyde können außerdem durch die Pyrolyse von Allylsulfiden effektiv gewonnen werden.[2][7]

Reaktionen
Thioaldehyde reagieren mit Nucleophilen weitestgehend analog zu Aldehyden.[2] Die durch ihre Unbeständigkeit bedingte Reaktivität führt häufig zu Trimeren, Oligo- und Polymeren.[7][14]

Die Oxidation von Thioaldehyden wird mit meta-Chlorperbenzoesäure durchgeführt und führt zu Sulfinen. Durch Reduktion mit Natriumborhydrid oder Lithiumaluminiumhydrid werden Thiole erhalten.[6][15] Darüber hinaus werden in der Literatur weitere Reaktionen beschrieben.[16][17]
Siehe auch
Einzelnachweise
- Eintrag zu Thioaldehyde. In: Römpp Online. Georg Thieme Verlag, abgerufen am 3. Juni 2020.
- R. Kracher u. a.: Lexikon der Chemie. Band 3: Perf bis Zy. Jokers edition. Spektrum Verlag, Heidelberg 2007, ISBN 978-3-8274-1909-5, S. 338.
- H. W. Kroto u. a.: The photoelectron and microwave spectra of the unstable species thioacetaldehyde, CH3CHS, and thioacetone,(CH3)2CS. In: Chemical Physics Letters. Band 29, Nr. 2, 1994, S. 265–269, doi:10.1016/0009-2614(74)85029-3.
- A. Schönberg, A. Wagner: Methoden zur Herstellung und Umwandlung von Thioaldehyden und Thioketonen. In: E. Müller (Hrsg.): Methoden der Organischen Chemie. Band IX: Schwefel-, Selen-, Tellurverbindungen. Thieme Verlag, Stuttgart 1955, S. 699–703.
- J. Voss: Thioaldehyde bzw. Thioketone. In: D. Klamann (Hrsg.): Methoden der Organischen Chemie. Band E11: Organische Schwefel-Verbindungen. Thieme Verlag, Stuttgart 1985, ISBN 3-13-218104-8, S. 188–194.
- R. Okazaki: Chemistry of Thioaldehydes. In: P. Page (Hrsg.): Organosulfur Chemistry. Band 1, Academic, San Diego 1995, S. 225–258.
- Siegfried Hauptmann: Organische Chemie. 2., durchgesehene Auflage. VEB Deutscher Verlag für Grundstoffindustrie, Leipzig 1985, ISBN 3-342-00280-8, S. 389.
- H. Morita: Formation of thioaldehyde intermediates by thermolysis of sulfoxides bearing some heteroaromatics. In: The Journal of Organic Chemistry. Band 62, Nr. 26, 1997, S. 9018–9023, doi:10.1021/jo9700181.
- G. W. Kirby: Thioaldehydes in synthesis. In: Phosphorus, Sulfur, and Silicon and the Related Elements. Band 74, Nr. 1-4, 1993, S. 17–29, doi:10.1080/10426509308038098.
- W. M. McGregor, D. C. Sherrington: Some Recent Synthetic Routes th Thioketones and Thioaldehydes. In: Chemical Society Reviews. Band 22, Nr. 3, 1993, S. 199–204, doi:10.1039/CS9932200199.
- M. Segi u. a.: Intramolecular Diels-Alder Reaction of Thioaldehydes. In: Synthetic Communications. Band 19, Nr. 13-14, 1989, S. 2431–2439, doi:10.1080/00397918908052644.
- M. Glassner u. a.: Polymer surface patterning via Diels-Alder trapping of photo-generated thioaldehydes. In: Chemical Communications. Band 49, Nr. 6, 2013, S. 633–635, doi:10.1039/C2CC37651B.
- T. Pauloehrl u. a.: Spatially controlled surface immobilization of nucleophiles via trapping of photo-generated thioaldehydes. In: Chemical Science. Band 4, Nr. 9, 2013, S. 3503–3507, doi:10.1039/C3SC50815C.
- V. A. E. Usov, L. V. Timokhina, M. G. Voronkov: The synthesis and properties of thioaldehydes. In: Russian Chemical Reviews. Band 59, Nr. 4, 1990, S. 378–395, doi:10.1070/RC1990v059n04ABEH003531.
- G. Opitz: Sulfine und Sulfene - die S-Oxide und S,S-Dioxide der Thioaldehyde und Thioketone. In: Angewandte Chemie. Band 79, Nr. 4, 1967, S. 161–177, doi:10.1002/ange.19670790402.
- K. Okuma: Recent Studies on the Reactions of Thioaldehydes and Thioketones. In: Sulfur reports. Band 23, Nr. 2, 1990, S. 209–241, doi:10.1080/01961770208047971.
- G. Li u. a.: On the behavior of α,β-unsaturated thioaldehydes and thioketones in the diels− alder reaction. In: The Journal of Organic Chemistry. Band 65, Nr. 20, 2000, S. 6601–6612, doi:10.1021/jo000740q.