Stromatolith
Stromatolithen (von altgriechisch στρῶμα stroma, deutsch ‚Decke‘ und λίθος lithos ‚Stein‘) sind biogene Sedimentgesteine, die durch Einfangen und Bindung von Sedimentpartikeln oder Fällung gelöster Stoffe infolge des Wachstums und Stoffwechsels von Mikroorganismen in einem Gewässer entstanden sind. Sie sind meistens geschichtet und bestehen oft aus sehr fein geschichtetem Kalkstein. Die innere Struktur der Stromatolithen ist verschieden: flache, ebene Schichten, nach oben gewölbte Schichten, mehrere gewölbte Schichtpakete nebeneinander (Säulenform). Einige erinnern mit ihrem schaligen Aufbau aus Knollen, Säulen oder welligen Lagen äußerlich an einen Blumenkohl.



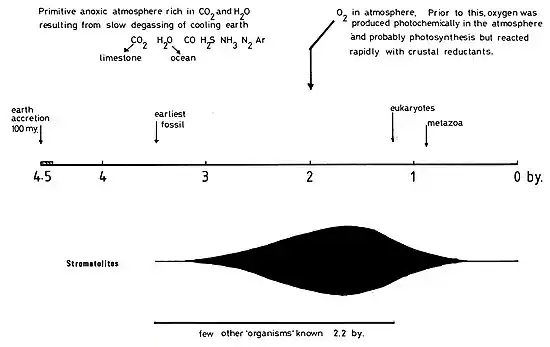
Die ältesten bekannten Fossilien sind größtenteils Stromatolithen, und sie könnten demnach Hinweise darauf liefern, wie sich Leben von sehr einfachen zu komplexeren Formen entwickelt hat.[2]
Der Begriff und die Bezeichnung Stromatolith wurden 1908 von Ernst Kalkowsky mit Bezug auf Vorkommen im norddeutschen Buntsandstein eingeführt.[1] Der von Kalkowsky bei der Erstbestimmung des Gesteins verwendete Holotypus befindet sich im Museum für Mineralogie und Geologie Dresden, dessen Direktor er war.
Bildung
Voraussetzung für die Bildung von Stromatolithen sind Biofilme, die aus Mikroorganismen bestehen (Mikrobenmatten). Bei rezenten Stromatolithen bestehen die 1–10 mm dicken Biofilme meistens aus einer Basislage von heterotrophen Bakterien, eingebettet in einer von den Mikroorganismen gebildeten Matrix aus Schleim (Polysaccharide und anderen Biopolymeren), und aus einer oberen Lage von überwiegend phototrophen Mikroorganismen, vergesellschaftet mit einem geringeren Anteil heterotropher. Die Biopolymere sind an der Bindung der Sedimentpartikel wesentlich beteiligt.
Die meisten Stromatolithen bestehen aus Kalkstein. Dieser wird durch Fällung gebildet. Voraussetzung ist ein in der Regel marines Gewässer mit hoher Konzentration an Calcium- und Hydrogencarbonat-Ionen. Durch intensive mikrobielle Assimilation von Kohlenstoffdioxid (CO2) wird das Milieu alkalisiert und somit das Dissoziationsgleichgewicht der Kohlensäure zugunsten von Carbonat-Ionen verschoben. Infolgedessen wird die Löslichkeit von Calciumcarbonat verringert, so dass Kalk ausfällt. Bestimmte Biopolymere der Biofilme stellen mit anionischen (negativ geladenen) Atomgruppen, an denen sich die positiv geladenen Calcium-Ionen binden, Kristallisationskeime dar. Bei rezenten Stromatolithen bewirken vor allem marine, benthonische Cyanobakterien (früher auch als „Blaualgen“ oder „Blaugrünalgen“ bezeichnet) die Kalkfällung durch intensive CO2-Assimilation im Zusammenhang mit ihrer Photosynthese. Vorwiegend handelt es sich um oxygene Photosynthese mit Wasser als Mittel für die Reduktion des CO2 und mit Bildung von Sauerstoff (O2), teils jedoch auch um anoxygene Photosynthese mit Schwefelwasserstoff (H2S) als Reduktionsmittel und Bildung von Schwefel (S) oder Sulfat (SO42−).[3]
Durch die Anhäufung gebundenen Sediments und/oder ausgefällten Kalks werden die Mikroorganismen des Biofilms eingeschlossen und bedeckt. Sie wachsen jedoch ständig durch Längenwachstum bzw. Vermehrung in die Höhe, so dass der Biofilm an der Basis zwar inaktiv wird und abstirbt, jedoch nach oben immer weiter wächst. Dies hat ein Höhenwachstum des Stromatolithen zur Folge. Die Gründe für die Schichtung sind vermutlich vielfältig und noch nicht vollständig bekannt. Als Ursache kommen unter anderem in Frage: täglicher Sonnenrhythmus, episodischer Sedimenteintrag, saisonaler Wechsel der chemischen Beschaffenheit des Wassers, Veränderungen der Biofilm-Biozönose. Über Wachstumsgeschwindigkeiten ist kaum etwas bekannt. Die rezenten Stromatolithen im Hamelin Pool (s. u.) wachsen etwa 0,3 mm je Jahr.
Stromatolithen können nur entstehen, wenn der für ihre Entstehung notwendige Biofilm nicht von anderen Organismen abgefressen wird. Bei Stromatolithen des Präkambriums war das gegeben, weil es noch keine derartigen Lebewesen gab. Aus dem Präkambrium gibt es deshalb viele Stromatolithen; bei jüngeren fossilen und rezenten war bzw. ist dies nur in Milieus der Fall, die für andere Lebewesen ungünstig sind, beispielsweise bei hohem Salzgehalt.
Fossilien


Stromatolithen werden als die ersten erkennbar durch Organismen aufgebauten Gebilde angesehen. Sie entstanden schon im Präkambrium, vor bis zu 3,5 Milliarden Jahren.[4] 3,45 Milliarden Jahre alt ist die Warrawoona-Serie,[5] gefunden bei dem Ort North Pole im Pilbara-Gebiet in Western Australia.[6] Etwa 3,4 Milliarden Jahre alt sind Stromatolithen der Fig-Tree-Gruppe, Swaziland Supergruppe, im Barberton Mountain Land, Südafrika.[7] Sogar 3,7 Milliarden Jahre alt ist laut einer 2016 publizierten Studie ein Fund in Grönland im Isua-Gneis.[8]
In manchen Zeitabschnitten der Erdgeschichte – lange bevor es Korallen gab – waren die Stromatolithenbildner wichtige Riffbildner. Bis vor einer Milliarde Jahren waren Stromatolithen in fast allen Küstengewässern stark verbreitet. Vor 700 Millionen Jahren gingen die Vielfalt und die Verbreitung der Stromatolithen zurück. Sehr selten werden Stromatolithen ab 450 Millionen Jahren vor der Gegenwart.[9] Man nimmt an, dass die Biofilme von den aufkommenden mehrzelligen Eukaryoten abgeweidet wurden.
Heutige Vorkommen
Allgemeines
Rezente, in Bildung begriffene Stromatolithen findet man nur noch in wenigen ökologischen Nischen, die meist durch erhöhte Salzgehalte gekennzeichnet sind: Lagunen, kontinentale Salz- und Sodaseen. Ein Rückschluss auf die Umweltbedingungen fossiler Stromatolithe beziehungsweise ihrer Erzeuger ist damit allerdings nicht unbedingt gegeben.
Sich bildende Stromatolithen kommen in Australien in der Shark Bay, im Pink Lake (früher Spencer Lake genannt, 33,8453° S, 121,8278° O) in Western Australia, im Solar Lake in Ägypten (Sinai), bei Chongyang (Provinz Hubei),[10] bei Sanya (auf der Insel Hainan)[11] und im Wutaishan Gebirge (Provinz Shanxi)[12] in China, im Persischen Golf, in Brasilien im Lagoa Salgada bei Rio de Janeiro, im Green Lake in Texas, im Mono Lake im Mono County (Kalifornien), im Yellowstone National Park in den USA, auf den Bermudas, in der Lagune von Bacalar auf der mexikanischen Halbinsel Yucatán, am Lake Untersee in der Antarktis, im größten Soda-See der Erde, dem Vansee in der Türkei, sowie in den alkalischen Kraterseen von Satonda in Indonesien, von Niuafo'ou in Tonga, Kauhako auf Molokai (Hawai) und von Alchichica (19,4167° N, 97,4° W) in Puebla (Mexiko), und in den Auswürflingen der minoischen Eruption von Santorin, Griechenland sowie an wenigen anderen Orten vor.
Hamelin Pool Marine Nature Reserve


Ein Beispiel für noch wachsende Stromatolithen sind die im Hamelin Pool Marine Nature Reserve an der Shark Bay in Western Australia. Sie wurden im Juni 1956 entdeckt und zählen zum UNESCO-Weltnaturerbe. Die Biofilme, durch die diese Stromatolithen gebildet werden, können wegen des extremen Salzgehalts des Wassers, der etwa doppelt so hoch ist wie im offenen Ozean, überdauern, weil die den Biofilm abweidenden Tiere (beispielsweise Schnecken) durch die hohe Salzkonzentration ferngehalten werden. Die Stromatolithen-Biofilme haben unter diesen extremen Bedingungen keine natürlichen Feinde. Die Stromatolithen des Hamelin Pools wachsen sehr langsam, maximal 1 cm in etwa 30 Jahren. Gebilde von etwa 1 m Höhe sind somit knapp 3000 Jahre alt.
Die Primärproduktion organischer Stoffe durch Cyanobakterien in den Biofilmen auf diesen Stromatolithen entspricht einer Assimilation von Kohlenstoff aus Kohlenstoffdioxid in organische Verbindungen von etwa 17–113 mg·m−2·h−1.[13]
Im Hamelin Pool Marine Nature Reserve kommen folgende Gebilde vor:
- Die „Blumenkohl“-Strukturen (cauliflower) sind lebende ältere Stromatolithen unter Wasser; die ältesten sind etwa 1–1,5 m groß.
- Die so genannten „Kuppeln mit roter Kappe“ (red-capped domes) sind flache Strukturen am Strand und grauschwarz mit rostroter „Haube“. Sie hörten vor etwa 500–1000 Jahren auf zu wachsen, als der Wasserspiegel fiel. Die Ursache der roten Farbe ist umstritten, möglicherweise ist sie durch Berührung mit eisenhaltigem Wasser oder durch Bakterien entstanden.
- Die jungen „buschigen Matten“ (tufted mats) bilden flache schwarze Teppiche unter Wasser, die von Weitem wie Filzmatten aussehen. Hier handelt es sich um noch sehr junge, kaum 1 cm hohe Strukturen.
Lake Thetis

Ein zweites Vorkommen von Stromatolithen in Australien findet sich im Lake Thetis nahe dem kleinen Ort Cervantes in Westaustralien. Es ist ein leicht hypersalinarer (53 g/l Salz), alkalischer (pH 8,5–9) Salzsee mit einer Tiefe von etwa 2–3 m. Hierin befinden sich domförmige Stromatolithen mit Durchmessern von 30–40 cm und einer Höhe von etwa 1 m überwiegend aus Aragonit. Die obere Schicht der darauf befindlichen Biofilme enthält an Cyanobakterien hauptsächlich Vertreter der Entophysalis-Gruppe; die untere Schicht der Biofilme wird aus heterotrophen Bakterien gebildet.[14]
Stromatolithen als Indikatoren für Sauerstoff-Bildung

Oberer Malm, Jura, Fundort: Thüste, Niedersachsen
Das Auftreten von Stromatolithen wird – zusammen mit dem Auftreten von Bändereisenerzen – als ein Anzeichen für das Auftreten von molekularem Sauerstoff (Disauerstoff, O2) durch oxygene Photosynthese angesehen, also durch lichtgetriebene Reduktion von Kohlenstoffdioxid zu organischen Stoffen mit Wasser als Reduktionsmittel, das dabei zu Disauerstoff oxidiert wird. (Schidlowski, S. 528)[15][16] Man nimmt in dem Zusammenhang an, dass Cyanobakterien als oxygene Phototrophe die Stromatolithe dominierend besiedelt haben. Begründet wird diese Auffassung durch folgende Argumente:
- Das zu Beginn der Erdentwicklung in den Gewässern ausschließlich zweiwertig (als Fe2+-Ionen) vorliegende Eisen wurde durch Disauerstoff zu dreiwertigem Eisen oxidiert. Sedimente mit dreiwertigem Eisen, wie die Hämatit- und Magnetit-haltigen Bändereisenerze, setzen voraus, dass bei ihrer Bildung Disauerstoff vorhanden war. (Schidlowski, S. 531)[15]
- Disauerstoff war zu Beginn der Erdentwicklung allenfalls in geringen Konzentrationen vorhanden (durch Photolyse aus Wasser gebildet), die für eine Oxidation zweiwertigen Eisens nicht ausreichten (Schidlowski, S. 531).[15]
- Stromatolithen werden biotisch gebildet. Analog zu den rezent gebildeten Stromatolithen werden auch die fossilen Stromatolithen von Biozönosen besiedelt gewesen sein, die oxygen phototrophe Cyanobakterien als charakteristische Komponenten enthielten. Stromatolithen zeigen also biotische Disauerstoff-Bildung an.[17]
- Man hat in alten, fossilen Stromatolithen Reste von Mikroorganismen gefunden, die von Organismen stammen können, die heutigen Cyanobakterien ähnlich sind.[18][19]
Diese Auffassung wurde allerdings schon frühzeitig in Frage gestellt, es wurden etliche Unklarheiten aufgezeigt.[20] Im weiteren Verlauf der Untersuchungen wurden konkretere Einwände vorgebracht.[21] Mehrere Befunde lassen die zwingende Notwendigkeit des Modells fraglich erscheinen:
- Zweiwertige Eisen-Ionen können bei Belichtung mit Ultraviolettstrahlung und Blaulicht auch ohne Disauerstoff zu dreiwertigem Eisen oxidiert werden (2 Fe2+ + 2 H+ → 2 Fe3+ + H2). Bändereisenerze könnten also auch durch Belichtung von Fe2+-Ionen ohne Disauerstoff entstanden sein. Disauerstoff muss zu der Zeit nicht vorhanden gewesen sein.[22]
- Stromatolithen können auch abiotisch gebildet werden. (Walter, S. 290)[23]
- Die in sehr alten stromatolithähnlichen Gesteinen (Apex Chert, W-Australien, etwa 3,465 Ga alt, und Isua, W-Grönland, etwa 3,8 Ga alt) gefundenen und als Mikroorganismenreste gedeuteten Strukturen werden von einigen Untersuchern für abiotisch gehalten.[24][25] Die in Stromatolithen jünger als 3,0 Ga gefundenen Strukturen sind wahrscheinlich Reste von Mikroorganismen, die in älteren Stromatolithen gefundenen möglicherweise abiogen. (Walter, S. 291 f.)[23]
- In jüngeren Stromatolithen gefundene Mikroorganismenreste können nach ihrer Form auch von anderen Mikroorganismen als Cyanobakterien stammen. Sollte es sich aber um Reste von Cyanobakterien handeln, so ist damit dennoch nicht sicher, ob sie damals oxygene Photosynthese betrieben haben, weil sogar einige rezente Cyanobakterien eine Photosynthese mit Schwefelwasserstoff als Reduktionsmittel betreiben können, dabei also keinen Disauerstoff bilden.[26][27] Diese Möglichkeit scheint sogar bei relativ jungen Stromatolithen verwirklicht gewesen zu sein, nämlich bei solchen aus dem oberen Malm, vorkommend bei Thüste (SW Hildesheim). Diese Stromatolithen sind wahrscheinlich in einem anoxischen Milieu mit Schwefelwasserstoff-Bildung entstanden und enthalten Eisen(II)-disulfid.[14]
Der Stand des Wissens kann wohl zur Zeit so zusammengefasst werden: Es ist möglich, dass das erste Auftreten von Stromatolithen und Bändereisenerzen die Anwesenheit von Disauerstoff anzeigt. Die Indizien dafür sind jedoch kein eindeutiger Nachweis; Disauerstoff könnte auch später durch oxygene Photosynthese erstmals gebildet worden sein.
Weblinks
- Stromatolith im Mineralienatlas
- Abigail C. Allwood, Malcolm R. Walter, Balz S. Kamber, Craig P. Marshall, Ian W. Burch: Stromatolite reef from the Early Archaean era of Australia, Nature 441, 8. Juni 2006 (englisch)
- NASA: What are stromatolites? (englisch)
- Stromatolite Fossils - The Oldest Fossils (englisch)
- Cyanobacteria and Stromatolites Links (englisch)
Literatur
- M. Walter und A. Allwood: Life on Earth, Primitive Organisms and Microfossils, Biosediments and Biofilms. In: Encyclopaedia of Geology, Vol. 1. Elsevier, London 2004. S. 279–294.
- A. Allwood und A. Brown: Seeking the oldest evidence of life on Earth. In: Microbiology Australia, Vol. 25 (1), 2004, S. 26–27.
- A. Knoll: Life on a Young Planet: The First Three Billion Years of Evolution on Earth. Princeton University Press, Princeton, New Jersey, U.S.A. 2003, ISBN 0-691-12029-3.
- A. Olcott, F. Corsetti und A. Stanley: A New Look at Stromatolite Form Diversity, 2002 Geological Annual Meeting, Denver, Oktober 2002.
Einzelnachweise
- Ernst Kalkowsky: Über Oolith und Stromatolith im norddeutschen Buntsandstein. In: Zeitschrift der Deutschen Geologischen Gesellschaft. Band 60, 1908, S. 68–125.
- Stepping Stones through Time. Astrobiology Magazin, 4. Oktober 2010, abgerufen am 21. Oktober 2014 (englisch).
- W. E. Krumbein, H. Buchholz, P. Franke, D. Giani, C. Giele, K. Wonneberger: O2 and H2S Coexistence in Stromatolites - A Model for the Origin of Mineralogical Lamination in Stromatolites and Banded Iron Formations In: Naturwissenschaften. Band 66, 1979, S. 381–389.
- Bacteria: Fossil Record. Webseite des University of California Paleontological Museum (UCPM).
- H. J. Hofmann, K. Grey, A. H. Hickman, R. I. Thorpe: Origin of 3.45 Ga coniform stromatolites in Warrawoona Group, Western Australia. In: Geo Science World GSA Bulletin. 111, Nr. 8, 1999, S. 1256–1262. doi:10.1130/0016-7606(1999)111<1256:OOGCSI>2.3.CO;2
- Abigail C. Allwood, Malcolm R. Walter, Ian W. Burch, Balz S. Kamber: 3.43 billion-year-old stromatolite reef from the Pilbara Craton of Western Australia: Ecosystem-scale insights to early life on Earth. In: Precambrian Research. 158, 2007, S. 198–227. doi:10.1016/j.precamres.2007.04.013
- Gary R. Byerly, Donald R. Lower, Maud M. Walsh: Stromatolites from the 3,300-3,500-Myr Swaziland Supergroup, Barberton Mountain Land, South Africa. In: Nature. Band 319, 1986, S. 489–491. doi:10.1038/319489a0
- Allen P. Nutman et al.: Rapid emergence of life shown by discovery of 3,700-million-year-old microbial structures. In: Nature. Band 537, 2016, S. 535–538, doi:10.1038/nature19355
- UCMP: Life of the Proterozoic Era
- Natsuko Adachi, Yuya Asada, Yoichi Ezaki, Jianbo Liu: Stromatolites near the Permian–Triassic boundary in Chongyang, Hubei Province, South China: A geobiological window into palaeo-oceanic fluctuations following the end-Permian extinction, in: Palaeogeography, Palaeoclimatology, Palaeoecology Band 475, 1. Juni 2017, S. 55–69, doi:10.1016/j.palaeo.2017.01.030
- Yun Zhang, Lucien Hoffmann: Blue-green algal mats of the salinas in San-ya, Hai-nan Island (China): structure, taxonomic composition, and implications for the interpretation of Precambrian stromatolites, in: Precambrian Research, Band 56, Nr. 3–4, 1992, S. 275–290, ISSN 0301-9268, doi:10.1016/0301-9268(92)90105-W
- CRI: Largest stromatolite discovered in Shanxi und Maverick Chen: 2.3 billon year-old Stromatolite found in Shanxi Province, auf China.org.cn vom 26. August 2008
- J. Bauld, L. A. Chambers, G. W. Skyring: Primary productivity, sulfate reduction and sulfur isotope fractionation in algal mats and sediments of Hamelin Pool, Shark Bay, W. A. In: Australian journal of marine and freshwater research. Band 60, Nr. 6, 1979, S. 753–764.
- Joachim Reitner: Stromatolithe und andere Mikrobialithe. In: Fritz F. Steininger, Dietrich Maronde (Hrsg.): Städte unter Wasser – 2 Milliarden Jahre. Kleine Senckenbergreihe Nr. 24, Senckenbergische Naturforschende Gesellschaft, Frankfurt am Main 1997, S. 19–37, S. 31.
- Manfred Schidlowski: Archean atmosphere and evolution of the terrestrial oxygen budget. In: Brian F. Windley (Hrsg.): The early history of the earth. John Wiley, Chichester u. a. O. 1976.
- Manfred Schidlowski, Rudolf Eichmann, Christian E. Junge: Evolution des irdischen Sauerstoff-Budgets und Entwicklung der Erdatmosphäre. In: Umschau. Band 74, Nr. 22, 1974, S. 703–707.
- J. William Schopf: Cradle of Life: The discovery of earth's earliest fossils. Princeton University Press, Princeton 1999, ISBN 0-691-00230-4.
- J. W. Schopf, B. M. Packer: Early archean (3.3 billion to 3.5 billion year old) microfossils from Warrawoona Group, Australia In: Science. Band 237, 1987, S. 70–73.
- S. J. Mojzsis, G. Arrhenius, K. D. McKeegan, T. M. Harrison, A. P. Nutman, C. R. L. Friend: Evidence for life on earth before 3,800 million years ago. In: Nature. Band 384, 1996, S. 55–59
- S. M. Awramik, P. Cloud, C. D. Curtis, R. E. Folinsbee, H. D. Holland, H. C. Jenkyns, J. Langridge, A. Lerman, S. L. Miller, A. Nissenbaum, J. Veizer: Biochemical evolution of the ocean-atmosphere system – State of the art report. In: H. D. Holland, M. Schidlowski (Hrsg.): Mineral deposits and the evolution of the biosphere. Dahlem Konferenzen, Springer-Verlag, Berlin u. a. O. 1982.
- Sarah Simpson: Questioning the oldest signs of life. In: Scientific American. April 2003, S. 52–59.
- P. S. Braterman, A. G. Cairns-Smith, R. W. Sloper: Photo-oxidation of hydrated Fe2+ - Significance for banded iron formations. In: Nature. Band 303, 1983, S. 163 f.
- M. R. Walter, A. C. Allwood: Biosediments and biofilms. In: Richard C. Selley, L. Robin M. Cocks, Ian R. Plimer (Hrsg.): Encyclopedia of geology. Elsevier Academic Press, Amsterdam u. a. O. 2005, ISBN 0-12-636380-3, Band 1, S. 279–294.
- Christopher M. Fedo, Martin J. Whitehouse: Metasomatic origin of quartz-pyroxene rock, Akilia, Greenland, and implications for earths earliest life. In: Science. Band 296, 2002, S. 1448–1452.
- Martin D. Brasier, Owen R. Green, Andrew P. Jephcoat, Annette K. Kleppe, Martin J. Van Kranendonk, John F. Lindsay, Andrew Steele, Nathalie V. Grassineau: Questioning the evidence for earth's oldest fossils. In: Nature. Band 416, 2002, S. 76–81.
- Y. Cohen, B. B. Jörgensen, E. Padan, M. Shilo: Sulphide-dependent anoxygenic photosynthesis in the cyanobacterium Oscillatoria limnetica. In: Nature. Band 257, 1975, S. 489–492
- Etana Padan: Facultative anoxygenic photosynthesis in cyanobacteria. In: Annual Review of Plant Physiology. Band 30, 1979, S. 27–40