Technischer Kalkkreislauf
Der Technische Kalkkreislauf ist die technische Umwandlung von natürlichem Kalkstein in drei Schritten.
- Brennen
- Zuerst wird Calciumcarbonat (CaCO3), der Hauptbestandteil des Kalksteins, stark erhitzt (gebrannt), dabei entweicht Kohlenstoffdioxid (CO2) und es entsteht Calciumoxid (CaO), Branntkalk.
- Löschen
- Versetzt man Branntkalk mit Wasser (H2O), bildet sich Calciumhydroxid (Ca(OH)2), Löschkalk.
- Abbinden (Carbonatisierung)
- Löschkalk reagiert durch Wasserabgabe und Kohlenstoffdioxidaufnahme wieder zurück zu Calciumcarbonat (CaCO3), also Kalkstein.
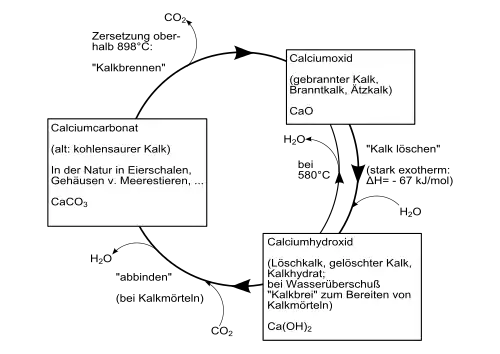
Ziel ist in der Regel die Bereitstellung von Kalk als Baustoff. Theoretisch ließe sich die exotherme Umwandlung von Branntkalk und Wasser zu Löschkalk und die endotherme Rückwandlung von Löschkalk zu Branntkalk und Wasser jedoch auch für chemische Wärmespeicher verwenden.[1]
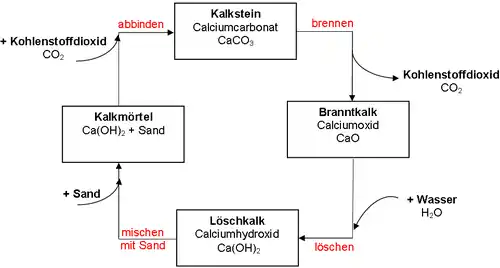
Brennen des Kalks

Calciumcarbonat ist eine einfache chemische Verbindung mit der Summenformel CaCO3. In der Natur findet sich dieses Mineral, neben Eier- und Muschelschalen, Kalkschwämmen und Korallen, vor allem als Kalkstein, der teils großflächig vorkommt. Typische Kalksteine sind Kreide, Marmor, Dachsteinkalk, Gesteine des Muschelkalk oder Travertin.
In einem Kalkofen findet, nach der Rohstoffgewinnung im Kalkwerk, der erste Umwandlungsschritt statt, das Kalkbrennen. Ab einer Temperatur von etwa 1000 °C wird kalkiges Gestein entsäuert, das heißt, Kohlenstoffdioxid CO2 wird ausgetrieben, es entsteht Branntkalk, chemisch Calciumoxid CaO.
- Calciumcarbonat reagiert unter Wärmezufuhr zu Calciumoxid und Kohlenstoffdioxid.
Dieser Vorgang ist für vergleichbare Prozesse namensgebend: Kalzination.
Bei der Verwendung relativ reiner Kalkgesteine entsteht der Weißkalk (Fettkalk) mit 90–95 % CaO. Anderenfalls spricht man von Magerkalken. Magnesiumhaltige Kalke mit höheren Anteilen von weißer Magnesia (MgO) ergeben Magnesiumkalk, Magnesiakalk. Kieselkalke, wie Korallenkalk oder Muschelkalk, ergeben Kalke in technischer Nähe zum Zement, beides härtere und deutlich wasserresistentere Baustoffe. Kalke minderer Qualität entstehen bei Verwendung von Kalksandsteinen, die tonige Anteile enthalten (im Wesentlichen Magnesium, Aluminium, Silicium). Durch das Ausgangsmaterial oder die Verarbeitung verbliebene höhere Anteile organischer Bestandteile (Kohlenstoff) ergeben Graukalk oder Schwarzkalk. Eine Ausnahme bilden die aus Dolomit gebrannten Kalke, die zwar magnesiumhaltig sind, aber aufgrund der Kristallstruktur dem hochreinen Weißkalk vergleichbarer Qualität entsprechen.[2] Noch komplexer wird das Verhalten der Kalke bei Anteilen an Salzen im Gestein, insbesondere Steinsalz (was bei frostabbindenen Werkstoffen ausgenutzt wird).
Ungünstig ist das Brennen von Kalk mit schwefelhaltigen Brennstoffen, der Kalk „verschwefelt“ dann teilweise zu Gips. Als Brennstoff kommen eine Vielzahl von festen (Kohle, Koks, Knochenmehl), flüssigen (Heizöl, Lösemittelabfälle, Klärschlamm) und gasförmigen Stoffen (Erdgas, Schwachgas) zum Einsatz.[3] Es werden Drehrohröfen und Schachtöfen verwendet. Feste Brennstoffe werden dem Kalk vor der Beschickung des Schachtofens beigemischt.[4]
Löschen des Kalks
Der zweite Schritt wird meist im Kalkwerk vollzogen, kann aber auch direkt vom Verbraucher durchgeführt werden. Wird gebrannter Kalk mit Wasser versetzt, entsteht unter Volumenvergrößerung und starker Wärmeentwicklung gelöschter Kalk, chemisch Calciumhydroxid Ca(OH)2.
- Calciumoxid und Wasser reagieren zu Calciumhydroxid.
Je nach Menge der Wasserzugabe spricht man von Sumpfkalk, Kalkfarbe oder Kalkmilch. Alle diese Formen werden als weiße Farbe zum Kalken von Wänden und als Bindemittel für Kalkmörtel oder hydraulischen Mörtel verwendet.
| Sicherheitshinweise | ||||||||
|---|---|---|---|---|---|---|---|---|
| CAS-Nummer | ||||||||
| ||||||||
Eine Zwischenstufe bildet dabei der unvollständig gelöschte Kalk, der ein trockenes Pulver ergibt, das trotzdem abbindefähig ist und unter dem Namen Kalkhydrat gehandelt wird. Dieses bildet die Grundlage aller Fertig-Kalkmörtel und -putze und Anmachfarben, die als Sackware vertrieben werden. Natürliche Vorkommen von Kalkhydraten mit freier Kieselsäure nennt man Puzzolane (Trass).
Gelöschter Kalk (Calciumhydroxid) ist ein stark ätzender, alkalischer Stoff; Kontakt mit den Augen kann zur Erblindung führen, Einatmen von Kalkhydratstäuben zu Atemproblemen, und auch ungeschützte Haut wird angegriffen. Erst der abgebundene Kalk ist wie Kalkstein diesbezüglich harmlos.
Im Hinblick auf Wärmespeicher käme die Rückwandlung von Löschkalk zu Branntkalk und Wasser(-dampf) bei Temperaturen ab 450 ° in Frage.[1]
Abbinden des Kalks
An der Luft bindet gelöschter Kalk mit Hilfe von Kohlenstoffdioxid CO2 wieder zu Calciumcarbonat ab, womit sich der Kreislauf schließt. Der Vorgang des Abbindens kann durch den geringen CO2-Gehalt der Luft, die Materialfeuchte sowie die entstehende Sinterschicht jahrelang dauern.
- Wasser und Kohlendioxid reagieren zu Kohlensäure. Calciumhydroxid und Kohlensäure reagieren zu Calciumcarbonat und Wasser.
Dabei karbonatisieren Grau- und Schwarzkalke mit ihrem hohen Eigengehalt an Kohlenstoff deutlich schneller. Hydraulkalke (die oben erwähnten Puzzolane, zementähnliche Kalke, sowie Kalke, die mit porösen Anteilen angereichert sind, die Luft speichern oder Wasser aufsaugen) binden dabei auch im feuchten Milieu, manche sogar unter Wasser.
Gibt man zum Baukalk noch Sand (siehe Gesteinskörnung), erhält man Kalkmörtel, einen der ältesten Baustoffe überhaupt. Der Löschkalk bindet dabei zwischen den Sandkörnern ab und festigt die Masse, der billige Sand sorgt für die nötige Druckfestigkeit und hält den Verbrauch an Kalk niedrig. Optimalerweise ist der Sand auch kalkreich, dann ist die Verbindung nicht nur mechanisch, sondern der Kalk kristallisiert direkt an der Zuschlagoberfläche aus.
Mit den technischen Bezeichnungen der Materialien zeigt sich der Kalkkreislauf in folgender Form:
Siehe auch
- Carbonat-Silicat-Zyklus, der „natürliche“ Kalkkreislauf, der sich mit dem der Silikatgesteine vermengt
- Fresko, die Technik der Wandmalerei, die direkt innerhalb des Kalkkreislaufs stattfindet
Literatur
- Rudolf Biehler: Kalk. Skriptum Philipps-Universität Marburg, 25. Juni 1998. (Webdokument, pdf)
- Eberhart Schiele, Leo. W. Berens: Kalk. Herstellung – Eigenschaften – Verwendung. Verlag Stahleisen, Düsseldorf 1972, ISBN 3-514-00115-4.
- Hartmut Kainer: Kopplung von Wärme- und Stoffaustausch mit chemischer Kinetik bei der Zersetzung von natürlichen Karbonaten. Dissertation. Technische Universität Clausthal, 1982.
- Kalktaschenbuch. Bundesverlag der deutschen Kalkindustrie e. V., 2001.
Weblinks
- Literaturliste (pdf), Lehrstuhl für Gesteinshüttenkunde, Montanuniversität Leoben (62 kB)
Einzelnachweise
- Energiewende - Kalk als Wärmespeicher. In: deutschlandfunk.de. Abgerufen am 9. Januar 2022.
- Kurt Wehlte: Werkstoffe und Techniken der Malerei, Kap. Freskomalerei, Werkstoffe und Arbeitsweisen. S. 276ff.
- https://www.atec-ltd.com/de/produkte-prozesse/produkte/flexiflame-rotary-kiln-burner.html Brenner für Drehrohrofen
- https://www.kalk.de/rohstoff/gewinnung/brennen/ Brennen von Kalk, Veröffentlichung des Bundesverbandes der Deutschen Kalkindustrie e. V., abgerufen am 4. Feb. 2019
- Eintrag zu Calciumoxid in der GESTIS-Stoffdatenbank des IFA, abgerufen am 29. Juli 2017. (JavaScript erforderlich)

