Crassulaceen-Säurestoffwechsel
Der Crassulaceen-Säurestoffwechsel (kurz CAM von Crassulacean Acid Metabolism) ist ein besonderer Stoffwechsel verschiedener Pflanzen. Während die meisten Pflanzen die Aufnahme und die Fixierung von Kohlenstoffdioxid am Tag durchführen, sind diese Vorgänge in Pflanzen mit CAM zeitlich voneinander getrennt. Das für die Photosynthese benötigte Kohlenstoffdioxid wird hierbei in der Nacht aufgenommen und chemisch in Form von Äpfelsäure in den Vakuolen der Zelle gespeichert. Am darauf folgenden Tag wird das Kohlenstoffdioxid aus der Äpfelsäure wieder freigesetzt und dem Aufbau von Kohlenhydraten im Calvin-Zyklus zugeführt. Wegen des täglichen Auf- und Abbaus dieser Dicarbonsäure und der damit verbundenen Protonenmenge im Wechsel von Tag und Nacht wird dieser Stoffwechsel auch als diurnaler Säurerhythmus bezeichnet (lateinisch diurnus = „täglich“).[1][2]
Der Vorteil des CAM-Mechanismus ist, dass die Pflanze während der (heißen) Tagesstunden ihre Spaltöffnungen geschlossen lassen kann, wodurch sie bedeutend weniger Wasser durch Transpiration verliert und trotzdem Kohlenstoffdioxid immer in ausreichender Menge im Calvin-Zyklus zur Verfügung hat. Darüber hinaus ist CAM eine vorteilhafte Antwort auf niedrige Kohlenstoffdioxidkonzentrationen, da er beispielsweise auch bei getauchten Süßwasserpflanzen zu beobachten ist. Dieser Stoffwechseltyp wurde bisher nur in chlorophyllhaltigem Gewebe nachgewiesen.
Benannt ist der Crassulaceen-Säurestoffwechsel nach der Familie der Dickblattgewächse (Crassulaceae), in der er erstmals entdeckt wurde.
Geschichte
Bereits Anfang des 19. Jahrhunderts wurden gewisse Aspekte des Crassulaceen-Säurestoffwechsels bemerkt. So beobachtete der Schweizer Naturforscher de Saussure 1804, dass die Zweige der Opuntien im Licht auch dann Sauerstoff produzieren, wenn gar kein Kohlenstoffdioxid in der Luft vorhanden ist; dies ist bei C3-Pflanzen nicht der Fall. Er schloss daraus, dass die Pflanze eigene Substanzen unter CO2-Freisetzung verbrauche.[3] 1813 entdeckte Benjamin Heyne den diurnalen Säurerhythmus bei der Goethe-Pflanze durch einen Eigenversuch: Er bemerkte, dass die Blätter am Morgen extrem sauer schmeckten, aber am Nachmittag einen Kräutergeschmack hatten. Heyne meldete diese Beobachtung der Linné-Gesellschaft und veröffentlichte später diese Befunde.[4]
Die Bezeichnung Crassulacean Acid Metabolism wurde das erste Mal im Januar 1947 von Meirion Thomas (1894–1977) bei einem Vortrag vor der Society for Experimental Biology verwendet. 1949 wurde der Begriff Bestandteil der vierten Auflage seines Standardwerkes Plant Physiology.[5] Mitte des 20. Jahrhunderts wurde die Aufklärung des Crassulaceen-Säurestoffwechsels vor allem durch die Arbeiten von Walter Daniel Bonner (1878–1956) und seines Sohnes James Frederick Bonner (1910–1996), Meirion Thomas, Thomas Archibald Bennet-Clark (1903–1975) und anderen Forschern vorangetrieben.
Mechanismus
Abgrenzung zu C3- und C4-Pflanzen
Zum Aufbau von Kohlenhydraten betreiben alle grünen Pflanzen Photosynthese. Dabei wird in der „Dunkelreaktion“ Kohlenstoffdioxid (CO2) fixiert und zu Kohlenhydraten aufgebaut. Die meisten Pflanzen (C3-Pflanzen) betreiben einen als C3-Stoffwechsel beschriebenen Mechanismus, bei dem Kohlenstoffdioxid passiv durch die Stomata in die Zellen gelangt und während des Tages im Calvin-Zyklus als Substrat fixiert wird. Eine Anpassung dieses Mechanismus findet man in C4-Pflanzen, die aktiv und damit unter Energieverbrauch die CO2-Konzentration für die Fixierung erhöhen. Hierbei findet eine räumliche Trennung (zwei Zelltypen, Mesophyllzellen und Leitbündelscheidenzellen) für die Vorfixierung und Metabolisierung von Kohlenstoffdioxid statt. Dies erlaubt den Pflanzen, ihre Spaltöffnungen teilweise zu schließen, da sie im Gegensatz zu C3-Pflanzen nicht durch die einfache Diffusion von Kohlenstoffdioxid in die Zellen eingeschränkt werden. Wenn die Stomata teilweise geschlossen werden, reduziert dies auch den Ausstrom an Wasser aus der Pflanze. Daher findet man C4-Pflanzen bevorzugt an trockenen und sonnenreichen Orten. Die CO2-Fixierung im Calvin-Zyklus entspricht jedoch derjenigen von C3-Pflanzen.
Um in ariden Regionen überleben zu können, verfügen CAM-Pflanzen über Mechanismen, die Schritte der CO2-Fixierung von jenen des Calvin-Zyklus zeitlich zu trennen. Dadurch können die Stomata während der Tageshitze geschlossen bleiben, um den Wasserverlust zu minimieren. In der kühleren Nacht werden sie dann zur CO2-Aufnahme geöffnet. Während in der Nacht Kohlenstoffdioxid in Malat fixiert und in den Vakuolen gespeichert wird, wird es am darauffolgenden Tag freigesetzt und durch RuBisCO, das Schlüsselenzym der „Dunkelreaktion“, analog einer C3-Pflanze umgesetzt. Diese biochemischen Reaktionen laufen in einer Zelle ab.
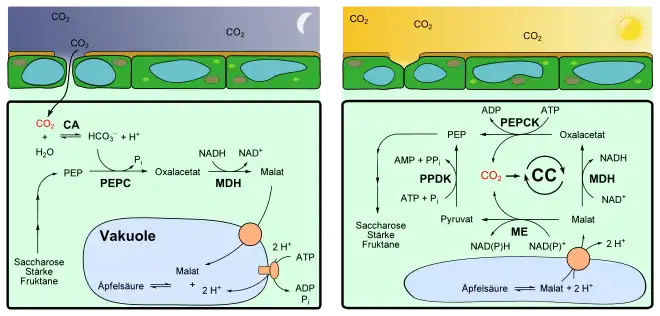
CA α-Carboanhydrase
CC Calvin-Zyklus
PEP Phosphoenolpyruvat
PEPC Phosphoenolpyruvatcarboxylase
PEPCK Phosphoenolpyruvat-Carboxykinase
MDH Malat-Dehydrogenase
ME Malat-Dehydrogenase (decarboxylierend) = Malatenzym
PPDK Pyruvat-Phosphat-Dikinase
Kohlenstoffdioxidfixierung in der Nacht
In der Nacht erfolgt die CO2-Fixierung an Phosphoenolpyruvat (PEP) durch eine cytosolische PEP-Carboxylase (PEPC, EC 4.1.1.31) ähnlich wie bei C4-Pflanzen. Das Enzym kondensiert Hydrogencarbonat (HCO3−) an PEP. Das benötigte PEP wird meist durch Abbau von Stärke bereitgestellt, andere Pflanzenarten verwenden dafür lösliche Zucker wie Glucose,[6] Saccharose oder Fructane.[7] CAM-Pflanzen müssen große Mengen an PEP bereitstellen können – so viel, dass eine Nachtration an Kohlenstoffdioxid fixiert werden kann. Zu diesem Zweck wird tagsüber der Stärke-Speicher oder/und der Vorrat an löslichen Zuckern (in der Vakuole) aufgefüllt, die dann nachts PEP zu liefern vermögen. Daher ist PEP ein limitierender Faktor für CAM, da es nachts die Menge an zu fixierenden CO2 begrenzt. Der Stärkeabbau in Chloroplasten endet im Gegensatz zu C3-Pflanzen auf der Stufe von Glucose-6-phosphat, das ins Cytosol transportiert und unter ATP-Gewinn zu PEP abgebaut wird.[6] Neben der zusätzlichen Energiebereitstellung aktiviert Glucose-6-phosphat auch PEPC.
In wässrigen Lösungen steht zwar CO2 im Gleichgewicht zu HCO3−, jedoch erfolgt diese Umsetzung nur langsam. Eine Carboanhydrase (CA, EC 4.2.1.1) beschleunigt die Einstellung des Gleichgewichts zu Gunsten von HCO3−, das dann durch die PEPC zu Oxalacetat (OA) umgesetzt wird. Das bei der Reaktion gebildete OA wird von der ebenfalls cytosolischen NAD-Malatdehydrogenase (MDH, EC 1.1.1.37) zu L-Malat reduziert. Dabei wird NADH zu NAD+ oxidiert.
Das Malat wird in die Vakuole transportiert und dort gespeichert. Die Vakuolen von CAM-Pflanzen sind im Vergleich mit anderen Arten sehr groß und können eine vergleichsweise hohe Konzentration von Malat (bis zu 0,2 M) aufbauen, was insgesamt zu einem hohen Speichervermögen beiträgt. Das Deponieren von Malat in den Vakuolen hält überdies den pH-Wert im Cytosol konstant.[8]
Um Malat gegen das Konzentrationsgefälle in die Vakuole zu transportieren, werden unter ATP-Verbrauch jeweils zwei Protonen pro Malat in die Vakuole gebracht. Dies katalysiert eine am Tonoplasten membranständige ATPase des Types V.[9] Durch einen sekundären, aktiven Transport folgt Malat den Protonen durch einen Dicarboxylattransporter.[10] Die Speicherung erfolgt daher in der protonierten Form des Malats, der Äpfelsäure, da bei den sehr sauren Bedingungen die Äpfelsäure überwiegend in undissoziierter Form vorliegt. Dies hat auch den Vorteil des dadurch geringeren osmotischen Wertes. Bei den Vakuolen der Schließzellen wird beispielsweise Kaliummalat in der Vakuole gespeichert, was einen vergleichsweise höheren osmotischen Druck verursacht. Während der pH-Wert der Vakuole vieler C3- und C4-Pflanzen bei 5,5[11] liegt, kann der bei CAM-Pflanzen ob der erhöhten Säurekonzentration nachts pH-Werte von 3,0 erreichen. Daher schmecken die Blätter dieser Pflanzen am Morgen sehr sauer.
Freisetzung von Kohlenstoffdioxid am Tag
Am Tag wird dieser Weg formal umgekehrt und das Kohlenstoffdioxid wieder freigesetzt. Das gespeicherte Malat wird wahrscheinlich über einen Carrier-vermittelten Transport aus der Vakuole ins Cytosol transportiert, bei dem zwei Protonen mittransportiert werden.[12] Möglicherweise kann Äpfelsäure als ungeladenes Teilchen auch direkt durch die Membran diffundieren.[13] Während des Tages steigt daher der pH-Wert in der Vakoule wieder an, er erreicht Werte von 7,5–8,0.[2] Diesen Prozess bezeichnet man auch als Absäuerung.
Der Abbau des Malats und die Freisetzung des Kohlenstoffdioxids erfolgt wie bei C4-Pflanzen je nach Art auf verschiedene Weise, worin sich die unabhängige Ausbildung des CAM in verschiedenen Taxa widerspiegelt. Die üblichen Wege sind das NADP-abhängige Malatenzym (bei Kakteengewächsen, Agavengewächsen), das NAD-abhängige Malatenzym (bei Dickblattgewächsen) und die Phosphoenolpyruvat-Carboxykinase (z. B. bei Bromeliengewächsen, Liliengewächsen, Asclepiadaceae).[14]
- In Pflanzen mit dem NADP-abhängigen Malatenzym (NADP-ME, EC 1.1.1.40) wird das aus der Vakuole transportierte L-Malat zu Pyruvat decarboxyliert. Diese Reaktionen finden im Chloroplasten statt. Dabei wird NADP+ zu NADPH reduziert.
- Manche Pflanzen besitzen ein mitochondrielles, NAD-abhängiges Malatenzym (NAD-ME, EC 1.1.1.39), welches NAD+ anstatt NADP+ als Cofaktor verwendet. Die Reaktionen erfolgen analog zum oben geschilderten NADP-ME. Jedoch wird Pyruvat im Mitochondrium nicht direkt ins Zytosol zurückgebracht, sondern zunächst über die Zwischenstufe L-Alanin in den Chloroplasten transportiert. Dort wird es zu PEP aufgebaut und später ins Zytosol gebracht. Die Aminierung zu Alanin und dessen Rückreaktion katalysiert eine Alanin-Transaminase (EC 2.6.1.2).
- CAM-Pflanzen des PEP-Carboxykinase-Types besitzen zwei Zyklen. Neben dem einen NAD-ME-Kreislauf haben diese auch eine cytosolische PEP-Carboxykinase (PEPCK; EC 4.1.1.49). L-Malat wird hierzu zunächst durch eine NAD-Malat-DH (MDH, EC 1.1.1.37) zu Oxalacetat unter Verbrauch von NAD+ oxidiert. Oxalacetat wird dann direkt zu PEP durch die PEPCK decarboxyliert, dies geschieht unter Verbrauch von ATP.
Das durch die oben genannten Reaktionen freigesetzte Kohlenstoffdioxid wird in den Calvin-Zyklus eingeschleust und zu 3-Phosphoglycerat aufgebaut, was die weitere Bildung von Monosacchariden (D-Glucose, D-Fructose) bzw. Polysacchariden (Saccharose) nach sich zieht. Das bei den Decarboxylierungsreaktionen entstandene Pyruvat wird durch eine Pyruvat-Phosphat-Dikinase (PPDK, EC 2.7.9.1) unter ATP-Verbrauch zu PEP umgesetzt. PEP wird schließlich im Zuge der Gluconeogenese zu Stärke, Saccharose oder Fructan aufgebaut.
Da der Großteil der gebildeten Kohlenhydrate dem Auffüllen der in der Nacht zuvor verbrauchten Stärkevorräte/lösliche Zucker dient, ist der Gewinn der CAM-Photosynthese gering. Zusätzlich ist das Ausmaß der Malat-Speicherung durch die Größe der Vakuole beschränkt. Infolgedessen ist der Zuwachs an Biomasse limitiert.
Durch den Auf- und Abbau des Malats ergeben sich starke Änderungen des pH-Wertes von pH 7,5 am Tag zu pH 3 in der Nacht. Wegen dieses Wechsels von Tag und Nacht spricht man daher von einem diurnalen Säurerhythmus. Dieser Rhythmus wurde erstmals 1984 im Brutblatt Kalanchoe daigremontiana nachgewiesen.[15]
Formen des CAM
CAM kann man in verschiedene Typen klassifizieren. Hierbei unterscheidet man, wann die Stomata geöffnet werden. Außerdem kann man die Menge an gebildeter Äpfelsäure während der Nacht und die CO2-Aufnahme zur Einteilung hinzuziehen.[16]
Obligater bzw. konstitutiver CAM

Der Stoffwechselmechanismus obligater CAM-Pflanzen wurde weiter oben ausführlich dargestellt. Diese öffnen ihre Stomata immer während der Nacht, während der auch 99 % der CO2-Fixierung erfolgt. Je nach Stärke der CO2-Aufnahme und anschließender Äpfelsäurebildung unterscheidet man noch in stark bzw. schwach obligaten CAM. Typische Vertreter des obligaten CAM finden sich beispielsweise bei den Dickblattgewächsen (Kalanchoe daigremontiana) und den Kakteengewächsen (Opuntia basilaris sowie Opuntia ficus-indica).[17] Im Gegensatz zu den anderen CAM-Typen verbleiben diese Pflanzen immer in jenem CAM-Modus, unabhängig von der Art und der Stärke abiotischen Stresses. Man hat jedoch beobachtet, dass sehr junge Sämlinge obligater CAM-Pflanzen, wie beispielsweise bei der Goethe-Pflanze, dem Opuntia ficus-indica und Kalanchoe daigremontiana, noch einen C3-Stoffwechsel betreiben können.[17]
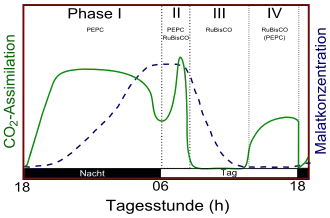
CAM bei diesen Pflanzen wird in vier Phasen eingeteilt. In Phase I zu Beginn der Nacht werden die Stomata geöffnet und Kohlenstoffdioxid durch PEPC fixiert (vgl. oben). Am Ende der Phase I schließen die Stomata. Manche Pflanzen treten dann in Phase II ein, bei dem sich in den frühen, nicht dunklen Morgenstunden die Stomata wieder öffnen. So gelangt atmosphärisches Kohlenstoffdioxid in die Pflanze, welches insbesondere durch die PEPC und zusätzlich durch RuBisCO fixiert wird. Licht und niedrige cytosolische CO2-Level sind dabei ein Signal zum erneuten Öffnen der Stomata. Später gelangt die CAM-Pflanze in Phase III, die Stomata bleiben verschlossen (vgl. oben). Hierbei wird Malat durch die oben beschriebenen Wege decarboxyliert, so dass die cytosolische CO2-Konzentration stark ansteigt. Dies ist ein Signal zum Schließen der Stomata. Im Laufe des Nachmittags wird Malat verbraucht, so dass die cytosolische CO2-Konzentration wieder sinkt. Da noch Licht vorhanden ist, werden die Stomata analog zu Phase II wieder geöffnet. Dies ist Phase IV. In dieser Phase ist die Photorespiration am höchsten. Schließlich gelangt mit Einbruch der Nacht die Pflanze wieder in Phase I.
Phase II und IV verschaffen der CAM-Pflanze eine zusätzliche CO2-Aufnahme, was mit einem schnelleren Wachstum einhergeht. Jedoch ist dies von der Wasserverfügbarkeit abhängig, so dass bei vielen obligaten CAM-Pflanzen Phase I und III dominieren.
Fakultativer bzw. induzierbarer CAM (C3-CAM)
Man hat beobachtet, dass manche Pflanzen sowohl eine CO2-Fixierung im Sinne einer C3-Pflanze als auch einer CAM-Pflanze aufweisen können. Vertreter finden sich häufig bei den Mittagsblumengewächsen, Dickblattgewächsen (Fetthennen), Portulakgewächsen (Calandrinia-Arten), Weinrebengewächsen und vielen Arten der Gattung Clusia. Die am besten untersuchte Pflanze mit fakultativem CAM ist das Eiskraut.[18] Weitere Vertreter sind Speckbaum oder Agave deserti.[19] Diese Pflanzen findet man in semi-ariden Regionen, auf felsigem Grund, auf Baumästen und allgemein in Habitaten mit Wasserknappheit.
Im nicht induzierten Status verläuft die CO2-Aufnahme analog einer normalen C3-Pflanze am Tage bei geöffneten Stomata. Es wird auch während der Nacht keine Äpfelsäure gebildet. Nach Induktion erfolgt aber eine nächtliche CO2-Fixierung und Äpfelsäurebildung analog einer schwachen obligaten CAM-Pflanze. Die Induktion wird dabei durch Trockenheit (während Dürreperioden), Salinität, hohe Lichtmengen, Stickstoff- und Phosphatmangel ausgelöst. Manchmal hängt sie auch vom Alter der Pflanze ab. Wenn manche Setzlinge noch unzureichend große Vakuolen haben, wird die Photosynthese im Sinne einer C3-Pflanze durchgeführt.[20] Erst im fortschreitenden Alter schaltet die Pflanze auf CAM um. Photoperiodismus induziert bei Kalanchoe blossfeldiana den Wechsel zwischen C3 und CAM.
Der Wechsel zwischen CAM und C3-CO2-Fixierung ist schnell und in der Regel reversibel. So kann innerhalb eines Tages bei steigenden Temperaturen und schlechterer Wasserversorgung zu CAM gewechselt werden. Manchmal betreibt auch ein Teil der Pflanze CAM, während – zumindest unter guter Wasserversorgung – ein anderer C3-Photosynthese betreibt. Dies ist beispielsweise der Fall bei Frerea indica, bei der der sukkulente Stamm CAM aufweist, die Blätter hingegen einen C3-Stoffwechsel. Bei tropischen Clusia-Arten kann es sogar vorkommen, dass ein Blatt C3-Stoffwechsel, ein gegenüberliegendes aber CAM durchführt.[21] Manche fakultativen CAM-Pflanzen können ihr Leben lang auch einen C3-Stoffwechsel betreiben, ohne je zum CAM zu schalten. So ist bei Clusia cylindrica der C3-Stoffwechsel der Hauptweg für die CO2-Fixierung.[22]
Beim Eiskraut, einer einjährigen Salzpflanze, ist der Wechsel von C3 zum CAM unter natürlichen Bedingungen irreversibel.[23] Die Pflanze wächst u. a. im Mittelmeerraum, und wechselt bei Wasserknappheit und Salzstress zum CAM. Letzteres ist eine Antwort auf damit verbundene Wasserknappheit, weniger wegen der erhöhten Anzahl an Ionen. Man hat auch festgestellt, dass der Wechsel zum CAM selbst ohne diese beiden Stressfaktoren in älteren Pflanzen erfolgt. Salz bzw. Wasserstress beschleunigen nur eine programmierte Entwicklung in Eiskraut, die zwangsläufig zum CAM führt. Auch die Lichtintensität und -qualität kann CAM im Eiskraut induzieren.[18] Unter kontrollierten Versuchsbedingungen konnte bei jüngeren Pflanzen jedoch ein Wechsel von CAM zurück zum C3-Stoffwechsel beobachtet werden.
In der Familie der Portulakgewächse ist auch ein Wechsel der CO2-Fixierung von C4 zum CAM beobachtet worden. So stellen Portulakröschen, Sommer-Portulak, Portulaca mundula, aber auch Peperomia camptotricha bei Wasserknappheit ihren Stoffwechsel auf CAM um.[19] Jedoch erfolgen der C4-Stoffwechsel und CAM nicht in ein und derselben Zelle.
Pflanzen, die fakultativen CAM zeigen 



Speckbaum Boucerosia frerea Eiskraut Portulakröschen
CAM-Leerlauf (idling)

Bei unter äußerster Wasserknappheit leidenden Pflanzen sind sowohl während des Tages als auch in der Nacht die Stomata geschlossen, um den Wasserverlust so gering wie möglich zu halten. Es wird das während der Atmung freiwerdende Kohlenstoffdioxid refixiert, so dass die nächtliche Äpfelsäurebildung gering ist. Während dieser Stresssituation verbleiben die Photosysteme intakt, die Pflanze „wartet“ auf bessere Bedingungen und befindet sich damit in einer Art „Leerlauf“.[19] Dennoch findet auch hier ein diurnaler Säurerhythmus statt. Dies wurde bei Opuntia basilaris zum ersten Mal beobachtet.
Es erfolgt keine Netto-Kohlenstoffaufnahme, so dass Pflanzen in diesem Zustand nicht wachsen, aber überleben können.
CAM-„Wechsel“ (cycling)


Bei diesem auch als „fast C3“ bezeichneten[18] Modus verbleiben die Stomata in der Nacht geschlossen. Das durch die Atmung freiwerdende Kohlenstoffdioxid wird fixiert, wodurch geringe Mengen an Äpfelsäure in den Vakuolen gelagert werden. Am Tag erfolgt die CO2-Fixierung im Sinne einer C3-Photosynthese.[19] Außerdem wird das in der Nacht gebildete Malat decarboxyliert. Daher zeigen die Pflanzen trotz offener Stomata während des Tages einen diurnalen Säurerhythmus. Man findet Pflanzen mit solch einem CAM-Typus an Standorten, wo auch fakultative CAM-Pflanzen wachsen. Vertreter dieses CAM-Types sind Peperomia camptotricha oder Talinum calycinum, Letztere wächst auf trocken, felsigen Boden. Bei Isoetes howellii, einer Wasserpflanze, ist CAM-cycling besonders ausgeprägt.[20] Der Epiphyt Codonanthe crassifolia betreibt CAM-cycling bei guter Wasserversorgung, schaltet aber bei Trockenheit in den CAM-Leerlauf um.[24]
Regulation
Eine Fixierung des Kohlenstoffdioxids durch die PEP-Carboxylase (PEPC) während des Tages wird durch eine allosterische Hemmung des Enzyms verhindert: Durch das aus der Vakuole strömende Malat und einen niedrigen pH-Wert – Bedingungen am Tag – wird die PEPC effektiv gehemmt. Dies soll verhindern, dass Kohlenstoffdioxid als Substrat unnötigerweise für eine andere Reaktion als für RuBisCO verbraucht wird. Auch L-Aspartat hemmt die PEPC, wohingegen Glucose-6-phosphat und Triosephosphate das Enzym aktivieren.[12] Beim Eiskraut kodieren zwei Gene für die PEPC, Pepc1 und Pepc2. Dessen Expression wird durch Trockenheit, Abscisinsäure und hohe Salinität beeinflusst.[12]
Die Enzymaktivität wird jedoch – wie bei C4-Pflanzen – zusätzlich durch reversible Phosphorylierung an einem Serinrest reguliert.[14] So ist die dephosphorylierte Form der PEPC 10-fach sensitiver gegenüber Malat als die phosphorylierte und aktive Form in der Nacht. Vermittelt wird die Phosphorylierung durch eine Kinase, die PEP-Carboxylase-Kinase (PPCK1). Diese unterliegt einer strikten, circadianen Rhythmik ihrer Genexpression und, bedingt durch einen raschen Auf- bzw. Abbau, auch ihrer Gesamtaktivität.[25] Die Expression erreicht einen Höhepunkt mitten in der Nacht und fällt dann während des Tages auf ein Minimalniveau herab. Diese hängt nicht vom Licht ab.[14]
Die für die Dephosphorylierung zuständige Phosphatase (Typ 2A) zeigt hingegen keine solche Rhythmik in ihrer Aktivität.[12]
Während der Phase II des CAM (vgl. oben) ist PEPC noch phosphoryliert und aktiv, da Malat in der Vakuole gespeichert vorliegt. Während Phase IV ist Malat größtenteils verbraucht und kann PEPC nicht mehr inhibieren.
Vorkommen

Der CAM-Mechanismus wurde in mindestens 35 Pflanzenfamilien und 343 Gattungen nachgewiesen.[26] Es wird geschätzt, dass der Stoffwechselweg in über 16.000 Arten vorkommt, das entspricht 6–8 % aller Gefäßpflanzen. Neben der namensgebenden Familie der Dickblattgewächse (z. B. die Goethe-Pflanze) sind weitere Familien mit CAM-Arten:[14]
- Affodillgewächse, z. B. die Echte Aloe
- Agavengewächse
- Bromeliengewächse, z. B. die Ananas
- Clusiaceae
- Didiereaceae
- einige epiphytische Farne, wie Pyrrosia piloselloides und Pyrrosia longifolia, sind CAM-Pflanzen.
- Hundsgiftgewächse
- Kakteengewächse, z. B. Echinocactus grusonii
- Korbblütler
- Liliengewächse
- Mittagsblumengewächse, z. B. die Lebenden Steine
- Orchideen, z. B. die Vanille und Phalaenopsis
- Portulakgewächse
- Weinrebengewächse
- Wolfsmilchgewächse.
Bekannte Vertreter sind die Ananas, Kalanchoe, aber auch die mitteleuropäischen Fetthennen- und Hauswurz-Arten (Sedum und Sempervivum). Im Pflanzenreich ist zwar CAM nicht phylogenetisch so gruppiert wie bei der C4-Photosynthese, in manchen Abstammungslinien lässt sich aber ein wiederholter Ursprung von CAM zeigen.[27] In Kakteengewächsen, Wolfsmilchgewächsen sowie Dickblattgewächsen (Eudikotyledonen) bzw. Bromeliengewächsen, Orchideen und Spargelgewächse/Agavengewächse (Monokotyledonen) ist CAM besonders stark vertreten.
Viele Arten kommen in periodisch trockenen Gebieten vor, besonders in Wüsten und Savannen der Tropen und Subtropen.[24] Jedoch sind Savannen nicht typische Habitate dieser Pflanzen. Dort werden CAM-Pflanzen häufig durch C3- bzw. C4-Gräser überwachsen. Man findet CAM-Pflanzen häufig auch in küstennahen Regionen bzw. in der Nähe von Salzseen, obwohl sie in der Regel Salz vermeiden und nicht wirklich zu den Salzpflanzen zählen. CAM-Pflanzen wachsen auch in Restingas. Dies sind küstennahe subtropische oder tropische Feuchtregenwälder mit sandigem und nährstoffarmen Boden, welche man in Brasilien findet. Wassermangel ist auch kennzeichnend für die Standorte von Epiphyten in Regenwäldern. Daher sind viele Epiphyten CAM-Pflanzen, nach Schätzungen zwischen 50 und 60 % aller epiphytischen Orchideen und Bromelien. Auch einige Süßwasserpflanzen zeigen CAM, so beim Wasser-Dickblatt und dem Europäischen Strandling, und bei einigen Arten der Gattung Brachsenkräuter (Isoëtes) wie dem See-Brachsenkraut.[28] Schließlich findet man CAM-Pflanzen auch auf Inselbergen und in großen Höhen, z. B. in den Alpen (Berg-Hauswurz) oder in den Anden (Echeveria quitensis, Oroya peruviana). Manche Kakteen wie Opuntia streptacantha oder Opuntia humifusa können zwar Temperaturen unter dem Gefrierpunkt tolerieren.[29] Allgemein behindern aber niedrige Tagestemperaturen die Freisetzung von Malat aus der Vakuole (herabgesetzte Viskosität und Membranpermeabilität) und damit den CAM-Stoffwechsel.
Erwähnenswert ist der Umstand, dass in Australiens natürlicher Flora verhältnismäßig wenig CAM-Pflanzen beheimatet sind.[30] 2016 wurden 120 CAM-Pflanzen gezählt, wovon darüber hinaus die meisten zu den Epiphyten gehören, sieben sind terrestrische Landpflanzen. Große Stamm-Sukkulente fehlen komplett.
Morphologie
Es gibt kein typisches Aussehen einer CAM-Pflanze, da sie morphologisch sehr unterschiedlich sind.[24] Alle CAM-Pflanzen sind jedoch durch eine mehr oder weniger stark ausgeprägte Sukkulenz gekennzeichnet und besitzen besonders große Vakuolen. Letzteres wird auch als „Sukkulenz auf Zellebene“ bezeichnet.[14] Die Vakuolen können bis zu 98 % der Zelle ausfüllen. Dadurch wird allgemein die Speicherung von Wasser und insbesondere von Malat für den CAM-Zyklus ermöglicht. Je sukkulenter eine CAM-Pflanze ist, desto stärker ist die CO2-Aufnahme in der Nacht.[31] In Bezug auf die Wassereinsparung besitzen diese Pflanzen auch eine dicke Kutikula, kleinere Stomata und ein kleines Oberfläche/Volumen-Verhältnis.[18] Durch die großen Zellen ist der interzelluläre Luftraum sehr klein, was die Diffusion von freigesetztem Kohlenstoffdioxid während des Tages begrenzt.[27]
Morphotypen von CAM-Pflanzen kann man unterschiedlich einteilen. Es gibt Blattsukkulenten wie beispielsweise bei Kalanchoearten. Manchmal verfügen diese über ein nicht grünes, wasserspeicherndes Gewebe, das um, unter oder mitten im Mesophyll liegt. Neben Blattsukkulenten findet man auch Stammsukkulenten, die besonders in ariden Regionen und Wüsten charakteristisch sind. Diese verfügen über ein zentrales, wasserspeicherndes Gewebe mitten im Stamm. Epiphyten bilden eine eigene Physiognomie. Neben Würge- und Kletterpflanzen gibt es auch noch epiphytische, dornenlose Kakteen. Häufig sind CAM-Pflanzen auch Rosettenpflanzen mit Spezialisierungen wie z. B. die Phytotelmata mancher Bromeliengewächse.
Eine Besonderheit stellt die Gattung Clusia dar, dikotyle baumbildende Arten, die CAM betreiben können. Dies sind zurzeit die einzigen bekannten Bäume mit CAM. Durch die photosynthetische Plastizität hat sich die Gattung Clusia in verschiedenen Ökosystem etabliert. Clusia-Arten selbst unterscheiden sich vielfältig in der Ausprägung von CAM (vgl. auch Abschnitt Formen des CAM). Manche Clusia-Arten, wie Clusia multiflora und Clusia cretosa, sind dagegen reine C3-Pflanzen.
Die Josua-Palmlilie bildet zwar auch einen „Baum“, dies ist aber ein Beispiel für sekundäres Dickenwachstum bei Einkeimblättrigen und sollte nicht mit sekundärem Dickenwachstum bei Zweikeimblättrigen verwechselt werden.
Bedeutung des CAM
Der ökologische Vorteil des CAM ist, dass die CO2-Aufnahme und damit die Öffnung der Stomata in der Nacht erfolgt, während sie am Tag geschlossen bleiben und somit der Wasserverlust stark reduziert wird. Daraus ergibt sich am Tage ein äußerst geringer Wasserbedarf pro Trockengewicht von 18–100 ml·g−1 im Gegensatz zu 450–950 ml·g−1 bei C3-Pflanzen.[32] Damit liegt der Wasserbedarf nur bei 5 bis 10 % im Vergleich zu dem bei C3-Pflanzen.[7] CAM ist demnach eine erfolgreiche Strategie, um trotz großen Wassermangels Photosynthese betreiben zu können.[33] Dies wird auch durch die Wassernutzungseffizienz (water-use efficiency, WUE) zum Ausdruck gebracht. Je höher diese Effizienz ist, desto niedriger ist der Kohlenstoffgewinn (vgl. Tabelle unten). Bei besonders starker Austrocknung bleiben die Stomata auch nachts geschlossen und es wird nur das durch die Atmung freigesetzte Kohlenstoffdioxid refixiert (CAM-Leerlauf). Dies ermöglicht es den Pflanzen, auch lange Perioden extremer Trockenheit zu überdauern. Neben der Einsparung von Wasserverlusten während des Tages erfährt eine CAM-Pflanze einen zusätzlichen Wassergewinn in der Nacht. Durch die Lagerung an Äpfelsäure entsteht ein hoher osmotischer Druck in den Vakuolen. Infolgedessen wird dadurch Wasser aus der Umgebungsluft aufgenommen, insbesondere nach dem Taufall in der Nacht.[34]
Der erhöhte Energiebedarf für die Kohlenstoffdioxidassimilation im Vergleich zu den C3-Pflanzen fällt angesichts der hohen Sonneneinstrahlung an den meisten Standorten der CAM-Pflanzen kaum ins Gewicht. Zudem wird die Lichtsättigung der Photosynthese meist erst bei höheren Lichtintensitäten erreicht als bei C3-Pflanzen. Pro fixiertes Molekül Kohlenstoffdioxid werden im C3-Stoffwechsel drei Moleküle ATP und zwei Moleküle NADPH benötigt (ohne Verluste der Photorespiration). Beim CAM liegen diese Werte bei 4,8 bis 5,9 ATP und 3,2 bis 3,9 Mol NADPH. Während Licht normalerweise nie ein limitierender Faktor ist, könnte dies jedoch bei Epiphyten ein Problem sein. Während der Regenperiode in Regenwäldern kann durch die hohe Luftfeuchtigkeit und Verdunstung die auftreffende Lichtmenge ein Problem werden. Individuen des Bromeliengewächses Bromelia humilis zeigten beispielsweise im Schatten ein geringeres Wachstum als artgleiche Pflanzen, die an vergleichsweise helleren Standorten wachsen.[35]
CAM-Pflanzen besitzen zum Schutze des Photosystems alle Mechanismen aus C3-Pflanzen (Zeaxanthin, Xanthophyllzyklus, D1-Protein-Umsatz, ggf. Photorespiration). CAM-Pflanzen zeigen normalerweise kaum Photorespiration, da durch die Freisetzung des Kohlenstoffdioxids aus gespeichertem Malat die cytosolische CO2-Konzentration sehr hoch ist.[8] Gegenüber C3-Pflanzen reagieren CAM-Pflanzen auch geringer auf oxidativen Stress, der durch Ozon (O3) und Schwefeldioxid (SO2) verursacht wird.[35]
Schließlich ist CAM eine CO2-Anreicherungspumpe. Dies ermöglicht aquatischen CAM-Pflanzen einen CO2-Gewinn in der Nacht. Damit können sie sich gegenüber anderen, nicht-CAM Wasserpflanzen behaupten, die dem Wasser während des Tages viel Kohlenstoffdioxid entziehen. Manchmal ist auch ohne Konkurrenz anderer Pflanzen der CO2-Gehalt im Wasser niedrig, wenn das Gewässer einen niedrigen pH-Wert aufweist. So hat beispielsweise Isoetes howellii in dieser Umgebung Vorteile durch CAM.[20] Während der Nacht ziehen aquatische CAM-Pflanzen auch einen Vorteil daraus, dass sich Kohlenstoffdioxid durch die Atmung von Mikroben, Tieren und anderen (C3-)Pflanzen im Wasser anreichert.[29] In vielen Brachsenkräutern nehmen zudem die Wurzeln anorganischen Kohlenstoff auf und transferieren diesen als CO2 in den Spross. Auch Bromeliengewächse in extrem feuchten tropischen Nebelwäldern profitieren von der CO2-Anreicherung.[24] Während der Regenzeit oder bei starkem Nebel ist der Gasaustausch an Blattoberflächen stark eingeschränkt. Dadurch haben CAM-Bromeliengewächse einen Vorteil gegenüber C3-Bromeliengewächse, zumal während der Trockenzeit wiederum die wassersparenden CAM-Mechanismen vorteilhaft sind.
Ein weiterer Vorteil dieser ATP-getriebenen CO2-Pumpe ist die erhöhte Konzentration von Kohlenstoffdioxid während des Tages. Dadurch wird weniger RuBisCO benötigt, während das Enzym in C3-Pflanzen ca. 50 % der löslichen Gesamtproteinmenge im Blatt ausmacht. Es wurde diskutiert, dass damit CAM-Pflanzen gegenüber C3-Pflanzen bei stickstoffarmen Böden im Vorteil seien, da sie eine bessere Stickstoffnutzungseffizienz (nitrogen-use efficiency, NUE) aufweisen.[24] Dennoch muss man dagegenhalten, dass auch C3-Pflanzen bei stickstoffarmen Böden über entsprechende Anpassungen verfügen, so dass CAM-Pflanzen nicht automatisch im Vorteil sind.
CAM-Pflanzen zeigen immer eine geringere Wachstumsrate als C4- oder C3-Pflanzen bedingt durch die begrenzte Speichermöglichkeit der Vakuolen.[9] Jedoch wachsen CAM-Pflanzen in Habitaten, in denen primär das Überleben wichtiger ist als der Gewinn an Biomasse.[32]
Isotopendiskriminierung
Wie bei Isotopendiskriminierung der C4-Pflanzen, diskriminiert die PEP-Carboxylase in CAM-Pflanzen nicht so stark gegen 13C wie RuBisCO. Daher entspricht ihr Isotopenverhältnis (δ-13C) bei CO2-Dunkelfixierung dem von C4-Pflanzen, bei Lichtfixierung von externem CO2 jedoch dem von C3-Pflanzen. Bei zunehmendem Trockenstress nimmt der Anteil der Dunkelfixierung zu, die CAM-Pflanze wird reicher an 13C. Der δ-13C-Wert einer CAM-Pflanze ist daher ein gutes Maß für die Dürrebelastung an ihrem Wuchsort, da er eine Aussage über das Ausmaß des CAM-Stoffwechsels im Verhältnis zum normalen C3-Stoffwechsel erlaubt. Bei guter Wasserversorgung zeigen fakultative CAM-Pflanzen und welche mit CAM-cycling δ-13C-Werte, die denen von C3-Pflanzen entsprechen.
Vergleich zwischen C3-, C4- und CAM-Pflanzen
| Merkmal | C3 | C4 | CAM |
|---|---|---|---|
| Transpirationsquotient [ml (H2O) pro g (C)] | 450–900 | 250–350 | 18–100 (während der Nacht) bzw. 150–600 (während des Tages) |
| Wassernutzungseffizienz (erzeugtes Trockengewicht in g pro g Wasserverlust) | 1,05–2,22 | 2,85–4,00 | 8,0–55,0 |
| maximale Photosyntheserate [µmol fixiertes CO2 / Blattfläche m2 · Sekunde] | 20–40 | 30–60 | 5–12 (im Licht) bzw. 6–10 (im Dunkeln) |
| Temperaturoptimum | 15–25 °C | 30–47 °C | 35 °C |
| Zugewinn an Trockenmasse ([Tonnen / Hektar · Jahr]) | 10–25 | 40–80 | 6–10 |
| δ-13C-Werte | −33 bis −22 ‰[37] | −17 bis −9 ‰ | −17 bis −9 ‰ (Trockenheit) bzw. −32 bis −20 ‰ (gut versorgt mit H2O); konstitutiver CAM: −18 bis −12 ‰[37] |
Evolution
Als Triebfeder für den Crassulaceen-Säurestoffwechsel werden allgemein sinkende CO2-Werte in der Atmosphäre betrachtet.[29] Der mögliche frühste Zeitpunkt für die ersten evolutionären Ursprünge liegt beim Übergang vom späten Karbon zum frühen Perm vor etwa 300–250 Millionen Jahren. Möglicherweise evoluierte CAM zunächst in aquatischen Pflanzen. Der Ursprung jüngerer CAM-Linien wird größtenteils in einer Periode ca. 35 Millionen Jahre vor unserer Zeit betrachtet.[38][37] CAM ist zwar eine vorteilhafte „Antwort“ auf Wasserknappheit; jedoch gehen Evolutionsbiologen davon aus, dass es bereits vor CAM Mechanismen zur Wassereinsparung und auch zur Wasserspeicherung gab, beispielsweise Schutz vor Verdunstung und Sukkulenz oder eine Verdickung der Epidermis bzw. der Wachsschicht (Photoprotektion), Haare (Verringerung der Austrocknung).[37] Durch diese Anpassungen ist aber die CO2-Aufnahme erschwert (geschlossene Stomata, geringe Diffusion von CO2 in sukkulenten Geweben). Daher wird CAM primär als eine Antwort auf niedrige CO2-Level betrachtet, jedoch sind sinkende Kohlenstoffdioxidwerte nicht ein alleiniges Selektionskriterium für CAM.[29]
Wie sich heutige CAM-Pflanzen aus ihren C3-Vorfahren entwickelt haben, ist noch Gegenstand der Forschung. In C3-Pflanzen liegen grundlegende Funktionen für einen CAM-Stoffwechsel in den Schließzellen des Stoma vor. Daher wurde vorgeschlagen, dass im Laufe der Evolution in Richtung CAM diese in die Mesophyllzellen transferiert wurden.[27] Als ein wichtiger Zwischenschritt in Richtung konstitutiver CAM werden Pflanzen betrachtet, die CAM-cycling betreiben. Man nimmt daher an, dass einer der ersten evolutionären Schritte Richtung CAM die Fähigkeit war, während der Nacht das Kohlenstoffdioxid aus der Atmung zu refixieren.[39] Dies geschieht heutzutage vor allem bei sukkulenten Pflanzen. Vermutlich haben die C3-Vorfahren diese Sukkulenz bereits gezeigt.[27] Ein zweiter wichtiger Schritt ist das Auftreten spezieller Translokatoren in der Vakuole. Sie verhindern, dass C4-Säuren unkontrolliert in das Cytosol diffundieren und damit den pH-Wert nachteilig ändern. Die für den CAM-Stoffwechsel benötigten Enzyme kommen auch bei C3-Pflanzen vor. Dies hat es ermöglicht, dass sich CAM-Pflanzen in unterschiedlichen, nicht miteinander verwandten Familien bei Einkeimblättrigen und Zweikeimblättrigen unterschiedlicher Habitate herausgebildet haben. Durch die mit CAM verbundenen Selektionsvorteile bei Trockenheit, Salzgehalt und insbesondere niedrigen CO2-Konzentrationen[40] haben sich CAM-Pflanzen (wie C4-Pflanzen) im Laufe der Evolution mehrmals und unabhängig voneinander aus C3-Vorläuferpflanzen „entwickelt“.[39]
Nutzung

CAM-Pflanzen werden nur in geringem Umfang landwirtschaftlich genutzt. Sie werden vor allem in Gebieten kultiviert, in denen sich aufgrund der hohen Evapotranspiration und des unzureichenden Niederschlags der Anbau von C3- und C4-Pflanzen nicht lohnt. Die Ananas, die Feigenkaktus-Art Opuntia ficus-indica, die Sisal-Agave und die Blaue Agave sind CAM-Pflanzen, die landwirtschaftliche Bedeutung erlangt haben.[41]
Ananas hat seine günstigsten Anbaugebiete in den Tropen, vor allem in Südafrika und Australien. Pro Jahr und Hektar werden beim Anbau der Ananas etwa 86 Tonnen Fruchtertrag gewonnen. 2003 belief sich der internationale Handelswert der Ananas auf 1,9 Milliarden US-Dollar.
Der Feigenkaktus wurde vor allem Anfang des 20. Jahrhunderts kommerziell genutzt. Heutzutage wird dieser hauptsächlich als Nahrung und Viehfutter in vielen Teilen der Welt angebaut. Der Ertrag pro Jahr beziffert sich auf 47–50 Tonnen pro Hektar.
Agaven werden weltweit angebaut, größtenteils um Fasern zu gewinnen oder Alkoholische Getränke herzustellen. So gewinnt man aus der Sisal-Agave die namensgebenden Sisalfasern. Die Produktion war in den 1960er Jahren am höchsten. Danach sank sie kontinuierlich, da die Sisalfaser durch synthetische Fasern aus Polypropylen immer mehr ersetzt wurde. 2006 wurden 246.000 Tonnen produziert.
Eine weitere wichtige Agaven-Art ist die Blaue Agave, von der pro Jahr und Hektar 50 Tonnen Trockenmasse geerntet werden können. Nach dem Abschlagen der Blätter wird der aus dem Stamm (der „Cabeza“) durch Kochen gewonnene Zuckersirup vergoren und zu Tequila weiterverarbeitet.[42] Auch der Zuckersirup anderer Agavearten wird destilliert, beispielsweise zu Mezcal.
Durch den gegenüber C3- und C4-Pflanzen um etwa den Faktor zehn geringeren Wasserverbrauch kommen CAM-Pflanzen darüber hinaus auch für die Bioenergienutzung in halbtrockenen (semiariden) Gebieten in Frage, in denen kaum oder gar keine Nahrungspflanzen angebaut werden und somit nur eine geringe Flächenkonkurrenz zum Nahrungspflanzenanbau besteht. Es wird geschätzt, dass auf 4 bis 15 % der in Frage kommenden semiariden Fläche etwa ein Bioenergiepotential von 5 Petawattstunden besteht, was der weltweiten jährlichen Stromerzeugung aus Gaskraftwerken entspricht.[43]
Bereits heute wird unter anderem der hohe Zuckeranteil der Blauen Agave für die Produktion von Bioethanol genutzt. Insbesondere Mexiko und große Teile der Karoo in Südostafrika sind für einen Anbau in nähere Betrachtung gerückt, da diese Standorte für die meisten anderen Nutzpflanzen ungeeignet sind. Die jährliche Produktion von Ethanol aus der Blauen Agave beträgt 14.000 Liter pro Hektar, möglicherweise kann diese auf 34.000 Liter Ethanol pro Hektar gesteigert werden.[41]
Speicherung von Citrat und Isocitrat
In Eiskraut[2] und anderen CAM-Pflanzen der Gattung Clusia[44] wird neben Äpfelsäure auch Citronensäure in den Vakuolen gespeichert. Citrat ist ein in den Mitochondrien gebildetes Stoffwechselintermediat des Citratzyklus'. In der Nacht wird dieses analog Malat in die Vakuole unter ATP-Verbrauch gespeichert (dort als Zitronensäure). Während des Tages wird es im Cytoplasma durch eine NADP-abhängige Isocitrat-Dehydrogenase (IDH) zu α-Ketoglutarat decarboxyliert. Alternativ wird Citrat direkt in die Mitochondrien gebracht und dort von einer NAD-abhängigen IDH umgesetzt. In beiden Fällen wird α-Ketoglutarat in weiteren Teilschritten des Citratzyklus zu Pyruvat verstoffwechselt. Im CAM-Baum Clusia alata geschieht dies nachdem Malat decarboxyliert wurde, womit beide Prozesse unabhängig voneinander ablaufen.[45]
Die biologische Bedeutung ist nicht gänzlich verstanden, zumal die nächtliche Speicherung von Citrat im Gegensatz zu der von Malat mit keinem Nettogewinn an Kohlenstoff verbunden ist, jedoch energetisch etwas günstiger ist.[46] Es wurde eine Reihe von Funktionen vorgeschlagen. So könnte die Decarboxylierung von Citrat als Schutzmaßnahme gegen die bei hohen Belichtungsstärken auftretende Photoinhibition dienen. Gerade CAM-Pflanzen sind häufig sehr hohen Lichtstärken ausgesetzt. Ferner kann der Vorgang zum Redoxgleichgewicht in der Zelle beitragen. Außerdem wurde diskutiert, dass der durch ROS ausgelöste Stress begegnet werde könne. ROS bilden sich aufgrund der hohen und langen Belichtungsstärke.
Während des CAM-Leerlaufs (siehe Abschnitt oben) wurde schließlich vorgeschlagen, dass das Einlagern von Citronensäure in die Vakuolen der Pflanze einen Vorteil verschaffe.[47] Citrat dient als Puffersubstanz und reduziert damit den elektrochemischen Protonengradienten am Tonoplasten. Damit erlaubt Citrat, dass mehr Malat während der Nacht gespeichert werden kann.
Neben Citrat kann auch Isocitrat in den Vakuolen gespeichert werden.[45]
Literatur
- Andreas Bresinsky, Christian Körner, Joachim W. Kadereit, G. Neuhaus, Uwe Sonnewald: Strasburger – Lehrbuch der Botanik. 36. Auflage. Spektrum Akademischer Verlag, Heidelberg 2008, ISBN 978-3-8274-1455-7.
- Hans W. Heldt, Birgit Piechulla: Pflanzenbiochemie. 4. Auflage. Spektrum Akademischer Verlag, Heidelberg 2008, ISBN 978-3-8274-1961-3.
- Caroline Bowsher, Martin W. Steer, Alyson K. Tobin: Plant Biochemistry. Garland Pub, New York, NY 2008, ISBN 978-0-8153-4121-5.
- Ulrich Lüttge, Manfred Kluge, Gabriela Bauer: Botanik. 5., vollständig überarbeitete Auflage. Wiley-VCH, Weinheim 2005, ISBN 3-527-31179-3.
- Ulrich Lüttge: Ecophysiology of Crassulacean Acid Metabolism (CAM). In: Annals of Botany. Band 93, Nummer 6, 2004, S. 629–652. PMID 15150072.PDF (freier Volltextzugriff, engl.)
- Peter H. Raven, Ray F. Evert, Susan E. Eichhorn: Biologie der Pflanzen. 4. Auflage. Gruyter, Berlin, New York 2006, ISBN 3-11-018531-8.
- Katia Silvera, Kurt M. Neubig, W. Mark Whitten, Norris H. Williams, Klaus Winter, John C. Cushman: Evolution along the crassulacean acid metabolism continuum. In: Functional Plant Biology. Band 37, Nummer 11, 2010, S. 995–1010, doi:10.1071/FP10084.
Einzelnachweise
- Neil A. Campbell, Jane B. Reece, Jürgen Markl: Biologie. 6. Auflage. Spektrum Akademischer Verlag, 2003, ISBN 3-8274-1352-4, S. 227.
- Gerhard Richter: Stoffwechselphysiologie der Pflanzen: Physiologie und Biochemie des Primär- und Sekundärstoffwechsels. 6., völlig neubearb. Auflage. Thieme, Stuttgart 1998, ISBN 3-13-442006-6, S. 187.
- T. de Saussure: Recherches chimiques sur la végétation. Chez la V. Nyon, Paris 1804.
- B. Heyne: On the deoxidation of the leaves of Cotyledon calycina. In: Trans Linn Soc Lond. 11, 1815, S. 213–215.
- J. T. Beatty Govindjee, H. Gest: Discoveries in photosynthesis. Springer, 2005, ISBN 1-4020-3323-0, S. 883.
- A. M. Borland et al.: Orchestration of carbohydrate processing for crassulacean acid metabolism. In: Curr Opin Plant Biol. Band 31, 2016, S. 118–124, doi:10.1016/j.pbi.2016.04.001, PMID 27101569.
- Hans W. Heldt, Birgit Piechulla: Pflanzenbiochemie. 4. Auflage. Spektrum Akademischer Verlag, Heidelberg 2008, ISBN 978-3-8274-1961-3, S. 227.
- H. Robert Horton, Laurence A. Moran, K. Gray Scrimgeour, Marc D. Perry, J. David Rawn: Biochemie. 4., aktualisierte Auflage. Pearson Studium, 2008, ISBN 978-3-8273-7312-0, S. 637.
- Hans W. Heldt, Birgit Piechulla: Pflanzenbiochemie. 4. Auflage. Spektrum Akademischer Verlag, Heidelberg 2008, ISBN 978-3-8274-1961-3, S. 229.
- Ernst-Detlef Schulze, Erwin Beck, Klaus Muller-Hohenstein: Plant Ecology. Springer, Berlin 2005, ISBN 3-540-20833-X, S. 138.
- Peter Karlson, Detlef Doenecke, Jan Koolman, Georg Fuchs, Wolfgang Gerok: Karlsons Biochemie und Pathobiochemie. 15. Auflage. Georg Thieme, 2005, ISBN 3-13-357815-4, S. 423.
- Ernst-Detlef Schulze, Erwin Beck, Klaus Muller-Hohenstein: Plant Ecology. Springer, Berlin 2005, ISBN 3-540-20833-X, S. 139.
- Ulrich Lüttge, Manfred Kluge, Gabriela Bauer: Botanik. 5., vollst. überarb. Auflage. Wiley-VCH, Weinheim 2005, ISBN 3-527-31179-3, S. 483.
- Andreas Bresinsky, Christian Körner, Joachim W. Kadereit, Gunther Neuhaus, Uwe Sonnewald: Strasburger – Lehrbuch der Botanik. Begründet von E. Strasburger. 36. Auflage. Spektrum Akademischer Verlag, Heidelberg 2008, ISBN 978-3-8274-1455-7, S. 314.
- I. C. Buchanan-Bollig, J. A. C. Smith: Circadian rhythms in crassulacean acid metabolism: phase relationships between gas exchange, leaf water relations and malate metabolism in Kalanchoë daigremontiana. In: Planta. 161(4), 1984, S. 314–319. doi:10.1007/BF00398721
- A. Herrera: Crassulacean acid metabolism and fitness under water deficit stress: if not for carbon gain, what is facultative CAM good for? In: Ann Bot. 103(4), 2009, S. 645–653. PMID 18708641. doi:10.1093/aob/mcn145
- K. Winter et al.: On the nature of facultative and constitutive CAM: environmental and developmental control of CAM expression during early growth of Clusia, Kalanchöe, and Opuntia. In: J Exp Bot. 59(7), 2008, S. 1829–1840. PMID 18440928; PDF (freier Volltextzugriff, engl.)
- J. C. Cushman: Crassulacean acid metabolism. A plastic photosynthetic adaptation to arid environments. In: Plant Physiol. 127(4), 2001, S. 1439–1448. PMID 11743087; PDF (freier Volltextzugriff, engl.)
- Hans Lambers, F. Stuart Chapin, Thijs L. Pons: Plant Physiological Ecology. 2. Auflage. Springer, Berlin 2008, ISBN 978-0-387-78340-6, S. 80.
- Ernst-Detlef Schulze, Erwin Beck, Klaus Muller-Hohenstein: Plant Ecology. Springer, Berlin 2005, ISBN 3-540-20833-X, S. 137.
- U. Lüttge: Carbon dioxide and water demand: Crassulacean acid metabolism (CAM), a versatile ecological adaptation exemplifying the need for integration in ecophysiological work. In: New Phytologist. 106(4), 1987, S. 593–629. PDF (freier Volltextzugriff, engl.)
- K. Winter et al.: Canopy CO2 exchange of two neotropical tree species exhibiting constitutive and facultative CAM photosynthesis, Clusia rosea and Clusia cylindrica. In: J Exp Bot. 60(11), 2009, S. 3167–3177. PMID 19487388. PMC 2718218 (freier Volltext)
- K. Winter, J. A. Holtum: Environment or development? Lifetime net CO2 exchange and control of the expression of Crassulacean acid metabolism in Mesembryanthemum crystallinum. In: Plant Physiol. 143(1), 2007, S. 98–107. PMID 17056756. PMC 1761986 (freier Volltext)
- U. Lüttge: Ecophysiology of Crassulacean Acid Metabolism (CAM). In: Annals of Botany. 93(6), 2004, S. 629–652. PMID 15150072; PDF (freier Volltextzugriff, engl.)
- H. G. Nimmo: How to tell the time: the regulation of phosphoenolpyruvate carboxylase in Crassulacean acid metabolism (CAM) plants. In: Biochem Soc Trans. 31(Pt 3), 2003, S. 728–730. PMID 12773193. PDF (freier Volltextzugriff, engl.)
- K. Silvera et al.: Multiple isoforms of phosphoenolpyruvate carboxylase in the Orchidaceae (subtribe Oncidiinae): implications for the evolution of crassulacean acid metabolism. In: J Exp Bot. Band 65, Nr. 13, 2014, S. 3623–3636, doi:10.1093/jxb/eru234, PMID 24913627.
- K. Heyduk et al.: Evolution of a CAM anatomy predates the origins of Crassulacean acid metabolism in the Agavoideae (Asparagaceae). In: Mol Phylogenet Evol. Band 105, 2016, S. 102–113, doi:10.1016/j.ympev.2016.08.018, PMID 27591171.
- Caroline Bowsher, Martin W. Steer, Alyson K. Tobin: Plant Biochemistry. Garland Pub, New York, NY 2008, ISBN 978-0-8153-4121-5, S. 134.
- U. Lüttge: Ecophysiology of CAM photosynthesis. In: Jaume Flexas, Francesco Loreto, Hipólito Medrano (Hrsg.): Terrestrial Photosynthesis in a Changing Environment: A Molecular, Physiological, and Ecological Approach. Cambridge University Press, 2012, ISBN 978-0-521-89941-3, S. 71–84.
- J. A. Holtum et al.: Australia lacks stem succulents but is it depauperate in plants with crassulacean acid metabolism (CAM)? In: Curr Opin Plant Biol. 31, 2016, S. 109–117. doi:10.1016/j.pbi.2016.03.018. PMID 27088716
- A. N. Dodd et al.: Crassulacean acid metabolism: plastic, fantastic. In: J Exp Bot. 53(369), 2002, S. 569–580. PMID 11886877; PDF (freier Volltextzugriff, engl.)
- Ulrich Lüttge, Manfred Kluge, Gabriela Bauer: Botanik. 5., vollst. überarb. Auflage. Wiley-VCH, Weinheim 2005, ISBN 3-527-31179-3, S. 485.
- Hans W. Heldt, Birgit Piechulla: Pflanzenbiochemie. 4. Auflage. Spektrum Akademischer Verlag, Heidelberg 2008, ISBN 978-3-8274-1961-3, S. 226.
- Ulrich Lüttge, Manfred Kluge, Gabriela Bauer: Botanik. 5., vollst. überarb. Auflage. Wiley-VCH, Weinheim 2005, ISBN 3-527-31179-3, S. 484.
- U. Lüttge: CO2-concentrating: consequences in crassulacean acid metabolism. In: J Exp Bot. 53(378), 2002, S. 2131–2142. PMID 12379779; PDF (freier Volltextzugriff, engl.)
- Caroline Bowsher, Martin W. Steer, Alyson K. Tobin: Plant Biochemistry. Garland Pub, New York, NY 2008, ISBN 978-0-8153-4121-5, S. 136.
- R. E. Bone et al.: A macro-ecological perspective on crassulacean acid metabolism (CAM) photosynthesis evolution in Afro-Madagascan drylands: Eulophiinae orchids as a case study. In: New Phytologist. Band 208, Nr. 2, 2015, S. 469–481, doi:10.1111/nph.13572, PMID 26192467.
- J. E. Keeley, R. K. Monson, P. W. Rundel: Evolution of photosynthesis II: evolution and expansion of CAM and C4 photosynthetic types. In: J. Flexas, F. Loreto, H. Medrano (Hrsg.): Terrestrial photosynthesis in a changing environment: a molecular, physiological and ecological approach. Cambridge University Press, Cambridge, UK 2012, S. 386–397.
- Caroline Bowsher, Martin W. Steer, Alyson K. Tobin: Plant Biochemistry. Garland Pub, New York, NY 2008, ISBN 978-0-8153-4121-5, S. 133f.
- Mary J. West-Eberhard: Developmental Plasticity And Evolution. Oxford University Press 2003, ISBN 0-19-512235-6, S. 512.
- A. M. Borland et al.: Exploiting the potential of plants with crassulacean acid metabolism for bioenergy production on marginal lands. In: J Exp Bot. 60(10), 2009, S. 2879–2896. PMID 19395392; PDF (freier Volltextzugriff, engl.)
- Thomas Heller: Agaven. Natur und Tier-Verlag, Stuttgart 2003, ISBN 3-931587-89-4, S. 33.
- P. M. Mason et al.: The potential of CAM crops as a globally significant bioenergy resource: moving from ‘fuel or food’ to ‘fuel and more food’. In: Energy and Environmental Science. 8, 2015, S. 2320–2329, doi:10.1039/c5ee00242g
- Ulrich Lüttge, Manfred Kluge, Gerhard Thiel: Botanik – Die umfassende Biologie der Pflanzen. Wiley-VCH Verlag, 2010, ISBN 978-3-527-32030-1, S. 792f.
- A. Kornas et al.: Adaptation of the obligate CAM plant Clusia alata to light stress: Metabolic responses. In: J Plant Physiol. 166(17), 2008, S. 1914–1922. PMID 19592134. doi:10.1016/j.jplph.2009.06.005
- L. Freschi et al.: Correlation between citric acid and nitrate metabolisms during CAM cycle in the atmospheric bromeliad Tillandsia pohliana. In: J Plant Physiol. 167(18), 2010, S. 1577–1583. PMID 20594612. doi:10.1016/j.jplph.2010.06.002
- Ulrich Lüttge, Manfred Kluge, Gerhard Thiel: Botanik – Die umfassende Biologie der Pflanzen. Wiley-VCH Verlag, 2010, ISBN 978-3-527-32030-1, S. 796.