Moose
Moose (regional auch Moor, Mies und Miesch; von mittelhochdeutsch mos/mies[1][2]) sind grüne Landpflanzen, die in der Regel kein Stütz- und Leitgewebe ausbilden. Nach heutiger Auffassung haben sie sich vor etwa 400 bis 450 Millionen Jahren aus Grünalgen der Gezeitenzone entwickelt. Die Moose sind durch einen Generationswechsel gekennzeichnet, bei dem die geschlechtliche Generation (Gametophyt) gegenüber der ungeschlechtlichen (Sporophyt) dominiert. Der haploide Gametophyt ist die eigentliche Moospflanze, er kann lappig (thallos) oder beblättert (folios) sein. Kennzeichen der Moose sind die Photosynthesepigmente Chlorophyll a und b, Stärke als Speichersubstanz und Zellwände aus Zellulose, aber ohne Lignin. Es gibt rund 16.000 bekannte Arten. Die Wissenschaft von den Moosen heißt Bryologie. Die drei klassischen Sippen Hornmoose, Lebermoose und Laubmoose bilden einzeln jeweils Abstammungslinien, die Moose insgesamt sind jedoch keine natürliche Verwandtschaftsgruppe.

Entwicklungskreislauf
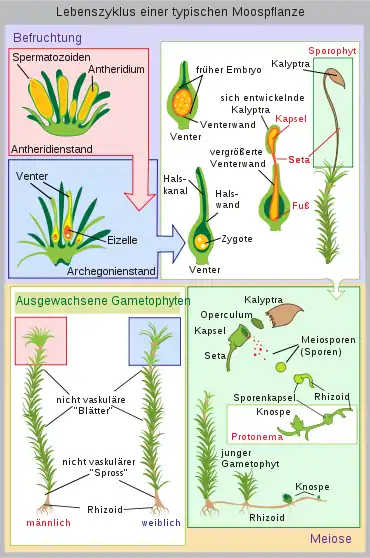
Moose sind Diplohaplonten und besitzen einen heteromorphen, heterophasischen Generationswechsel: Die beiden Generationen haben einen unterschiedlichen Aufbau (heteromorph) und sie besitzen unterschiedliche Kernphasen (heterophasisch). Diese Art des Generationswechsels teilen die Moose mit den Farnen und Samenpflanzen. Der Gametophyt ist dabei die eigentliche Moospflanze und ist photoautotroph und haploid (hat einen einfachen Chromosomensatz). Der Sporophyt ist in Entwicklung und Ernährung vom Gametophyten abhängig und ist diploid (hat einen doppelten Chromosomensatz).
Geschlechtliche Generation
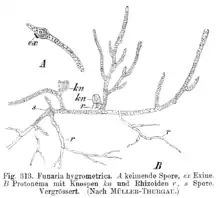
Aus der haploiden Meiospore entwickelt sich ein fädiges, selten lappiges Protonema (Vorkeim bzw. juveniler Gametophyt). An diesem bilden sich aus Knospen die eigentlichen Moospflanzen. In der Regel stirbt das Protonema danach ab. Das Protonema dient also der vegetativen Vermehrung, da aus einer Spore ein ganzer Klon entstehen kann. Der Gametophyt ist meist beblättert, seltener thallos. Auf ihm entstehen die Geschlechtsorgane (Gametangien): die männlichen Antheridien und die weiblichen Archegonien. Moose sind je nach Art diözisch (zweihäusig), das heißt, es gibt weibliche und männliche Pflanzen, oder monözisch (einhäusig). Bei den Letzteren können die Antheridien und Archegonien in einem Gametangienstand (synözisch) oder getrennt (parözisch) vorkommen.
In den Geschlechtsorganen entstehen die haploiden Keimzellen (Gameten). Für die Befruchtung ist Wasser notwendig: Die männlichen beweglichen Spermatozoiden müssen zu den Archegonien schwimmen. Dabei können sie aktiv bis zu 1,5 Zentimeter zurücklegen und werden chemotaktisch durch Saccharose angelockt. Bei größeren Distanzen sind die Spermatozoiden auf die passive Verbreitung etwa durch Regenwasserspritzer angewiesen. Die Befruchtung der Eizelle erfolgt im Archegonium.
Ungeschlechtliche Generation
Die befruchtete Eizelle (Zygote) ist diploid und entwickelt sich ohne Ruhestadium zu einem Embryo und weiter zum Sporophyten. Der Sporophyt ist je nach Moosgruppe sehr unterschiedlich gebaut, bleibt aber bei allen mit dem Gametophyten verbunden, von dem er Wasser und Nährstoffe erhält. Dazu dient ihm ein Haustorium (Fuß). Nach oben wächst der Embryo durch das Archegonium hindurch und bildet ein Sporogon, an dessen Spitze die Sporenkapsel (Sporangium) sitzt. Das Gewebe im Inneren des Sporangiums ist das Archespor, dessen Zellen sich durch Reduktionsteilung (Meiose) zu haploiden Sporen teilen. Nach der Reife werden die Sporen aus der Sporenkapsel entlassen. Zur Keimung quellen die Sporen, sprengen das Exospor und entwickeln sich zum Protonema.
Bau und Entwicklung
Gametophyt


Bei den Hornmoosen und einem Teil der Lebermoose ist der Gametophyt lappig (thallos), bei den Laubmoosen und den meisten Lebermoosen beblättert (folios). Bei den beblätterten Moosen ist der Gametophyt in Blättchen (Phylloide), Stämmchen (Cauloide) und wurzelartige Strukturen (Rhizoide) gegliedert. Diese Strukturen sind zwar denen der Farne und Samenpflanzen ähnlich; da sie jedoch beim Gametophyten und nicht wie bei diesen am Sporophyten auftreten, sind sie nicht homolog, weshalb sie mit eigenen Begriffen versehen wurden. Durchgesetzt hat sich jedoch nur das Rhizoid, während Phylloide und Cauloide meist als Blatt und Stamm bezeichnet werden. Die Gametophyten der Moose sind die am höchsten differenzierten unter den Pflanzen.
Die Thalli wachsen mit zwei-, drei- oder vierschneidigen Scheitelzellen, beblätterte Pflanzen mit dreischneidigen Zellen. Als Ausnahme wächst Takakia mit einem Gipfelmeristem. Beide Formen, thallöse und foliose, können Leitgewebe erhalten, das jedoch vielfach funktionslos ist. Hornmoose besitzen Leitgewebe nur in den Sporophyten. Lebermoose besitzen selten Hydroide im Gametophyten: diese Zellen besitzen schräg gestellte Querwände und Tüpfel ähnlich den Tracheiden der Farne, sind jedoch nicht verholzt. Laubmoose besitzen oft Zentralstränge mit wasserleitenden Hydroiden und zwar im Gametophyten wie im Sporophyten. Zellen, die Assimilate leiten (Leptoide), treten nur bei den Polytrichidae auf. Der Besitz von wasser- und assimilatleitenden Geweben wird als Indiz gedeutet, dass sich die Moose aus frühen tracheophytischen Landpflanzen entwickelt haben.
Die Blättchen wachsen mittels zweischneidiger Scheitelzellen. Bei Lebermoosen stehen die Blättchen in drei Reihen und haben keine Rippen. Die Blättchen der Laubmoose stehen meist schraubig, selten drei- oder zweizeilig. Ursprüngliche Sippen besitzen Blättchen mit Rippen.
Gametangien und Gameten
Die Bildung der Geschlechtszellen (Gameten) in sterilen Hüllen (Gametangien) ist eine Anpassung an das Landleben. Entstehung und Aufbau der Gametangien ist bei Moosen und Farnen recht ähnlich, weshalb beide Gruppen als Archegoniaten zusammengefasst werden.
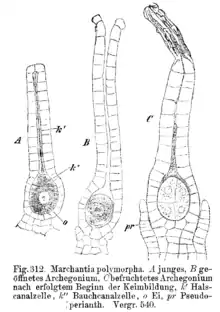
Die weiblichen Gametangien, die Archegonien, sind flaschenförmig. Sie haben einen verdickten Bauchteil aus zwei bis drei Zellschichten und einen einzelligen Halsteil. Im unteren Teil liegt die Eizelle, über ihr die Bauchkanalzelle, darüber noch einige Halskanalzellen. Reift das Archegonium, dann trennen sich die beiden Deckelzellen an der Spitze des Archegoniums, Bauch- und Halskanalzellen verschleimen. Dadurch wird der Weg zur Eizelle frei.
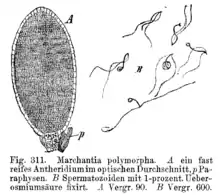
Die männlichen Antheridien entstehen aus einer Epidermiszelle, also exogen. Lediglich bei den Hornmoosen entstehen sie endogen. Eine einzellschichtige, sterile Hülle umgibt die spermatogenen Zellen. Letztere teilen sich in zwei Zellen, die sich vom Zellverband lösen und in die begeißelten Spermatozoiden verwandeln. An der Spitze des Antheridiums verschleimen einige Wandzellen. Durch diese Öffnung werden die Spermatozoiden entlassen. Diese besitzen die Form eines Korkenziehers. Das Vorderende ist besonders gestaltet und wird Blepharoplast genannt. Hier setzen zwei lange glatte Geißeln an, die nach hinten gerichtet sind. Die Geißeln der Laub- und Lebermoose sind linksschraubig, die der Hornmoose rechtsschraubig. Die Geißeln setzen an einem Basalkörper an. Unter diesem liegt eine vielschichtige Struktur (multi layered structure, MLS) aus parallel liegenden Mikrotubuli, einem Lamellarstreifen und einem Mitochondrium. Hinter dem Zellkern, am hinteren Ende des Spermatozoiden, liegen die Ribosomen, eine Plastide, endoplasmatisches Reticulum und ein weiteres Mitochondrium. Diese Ultrastrukturen sind von hoher Bedeutung für die Systematik, da sie keinem funktionellen Anpassungsdruck unterliegen und daher als sehr konservative Merkmale gelten.
Embryoentwicklung
Bei den Laub- und Lebermoosen teilt sich die befruchtete Eizelle (Zygote) zunächst quer. Aus der oberen Zelle entsteht der eigentliche Embryo, der sich weiter in Fuß, Seta und Sporangium differenziert. Die untere Zelle stirbt meist ab. Bei den Hornmoosen verläuft die erste Zellteilung längs, worauf sich die beiden Zellen dann quer teilen. Die beiden oberen Zellen werden zum Sporogon, die beiden unteren entwickeln sich zum Fuß.
Der Fuß dringt in das Gametophytengewebe ein und ist mit dem Gametophyten über eine Plazenta verbunden. Über die Plazenta werden Wasser und Nährstoffe vom Gametophyten an den Sporophyten geleitet. Typisch für die Plazenta sind Transferzellen mit Wandprotuberanzen, das sind Einstülpungen der Zellwand zur Oberflächenvergrößerung. Bei Laub- und Lebermoosen sind Fuß und Gametophyt durch einen plazentalen Spalt getrennt. Transferzellen kommen auf beiden Seiten vor, nur beim Sporophyten, oder fehlen ganz. Bei den Hornmoosen fehlt der plazentale Spalt, hier dringt der Fuß als Haustorium in die gametophytischen Transferzellen ein.
Sporophyt

Der Sporophyt stellt die diploide Generation der Moose dar. Bei den Hornmoosen und etlichen Laubmoosen besitzt der Sporophyt Spaltöffnungen vom Mnium-Typ, wie er auch für die Farne typisch ist. Außerdem ist die Epidermis kutinisiert. Zumindest bei den Polytrichales entspricht Struktur und chemische Zusammensetzung der Cuticula derjenigen der Gymnospermen. Die Sporophyten der Horn- und Laubmoose besitzen zudem im Zentrum ein Leitgewebe, besitzen also eine Protostele.
Bei den Hornmoosen ist der Sporophyt schotenförmig. Bei Laub- und Lebermoosen ist er in einen Stiel (Seta) und eine Sporenkapsel (Sporangium) gegliedert. Der Bau des Sporangiums ist je nach Großgruppe sehr unterschiedlich. Alle besitzen jedoch im Inneren ein sporenbildendes (sporogenes) Gewebe (das Archespor). In diesem entwickeln sich aus diploiden Sporenmutterzellen durch die Meiose die Sporen (Meiosporen), typischerweise in Tetraden (zu viert). Die Sporen besitzen ein dünnwandiges Endospor und ein dickwandiges Exospor. Eine mit Sporopollenin imprägnierte Sporenwand ist charakteristisch für die Embryophyten. Durch unterschiedliche, wiederum taxonspezifische Mechanismen gelangen die Sporen ins Freie, wo sie wiederum zu einem Protonema keimen.
Ausbreitungsbiologie
Bei Moosen gibt es zwei Arten von Ausbreitungsorganen (Diasporen): Sporen bei der sexuellen Vermehrung und Brutkörper bei der vegetativen Vermehrung.
Sexuelle Vermehrung
Die Rolle der sexuellen Vermehrung zur Erhöhung der genetischen Vielfalt ist bei den Moosen erheblich eingeschränkt. Rund die Hälfte der Moose ist monözisch und überwiegend selbstbefruchtend (keine Selbstinkompatibilität). Zudem kommen viele diözische Arten nur in rein weiblichen oder rein männlichen Populationen vor und können sich nicht sexuell vermehren.
Die relativ geringe Wahrscheinlichkeit, dass für die Befruchtung die Spermatozoiden im Wasser zu den Archegonien gelangen, wird dadurch kompensiert, dass in so einem Fall meist sehr große Sporenzahlen produziert werden. Den Rekord hält Dawsonia mit fünf Millionen Sporen in einem Sporangium. Mehrere Hunderttausend sind auch bei anderen Arten nicht selten. Die Sporen werden sehr weit verbreitet, meist wesentlich weiter als das eigentliche Artareal. Daher können viele Moose sehr rasch auf klimatische Änderungen reagieren und neue, passende Standorte besiedeln.

Die Größe der Sporen beträgt bei Laubmoosen meist sieben bis 35 Mikrometer, bei jungermannialen Lebermoosen 10 bis 40 und bei marchantialen Lebermoosen 40 bis 90 Mikrometer. Die Dauer der Keimfähigkeit der Sporen dauert von wenigen Stunden (bei manchen epiphyllen Moosen) bis zu vielen Jahren, was eher die Regel ist. In Versuchen keimten noch Sporen aus 16 Jahre altem Herbarmaterial. Manche diözischen Lebermoose bilden bei der Meiose zusammenhängende Sporentetraden, sodass immer männliche und weibliche Gametophyten zusammen sind.
Die Ausbreitung der Sporen erfolgt in der überwiegenden Mehrheit über den Wind (Anemochorie). Manche Faktoren schließen jedoch den Wind bei der Ausbreitung aus: sehr große Sporen; wenn Sporen im Thallus gebildet werden (zum Beispiel Riccia) oder die Kapseln sich nicht öffnen (kleistokarpe Laubmoose). Dies weist auf eine mögliche Verbreitung durch Tiere (Zoochorie) hin, die bei einigen Arten auch experimentell nachgewiesen wurde: so wird Riella americana im Darm von Enten verbreitet. Ein Sonderfall sind die Splachnaceae, die durch Insekten verbreitet werden: Die Arten wachsen auf Dung und Tierleichen. Sie bilden geklumpte Sporenmassen und locken mit ihrem Duft kleine Dungfliegen (Sphaeroceridae) an, die die Sporen wieder zu neuen Standorten bringen.[3] Moose in Gewässern werden durch das Wasser verbreitet (Hydrochorie). Sporen von kleistokarpen Moosen werden erst nach dem Verwesen der Kapsel frei.
Die Stellung der Kapsel spielt eine Rolle bei der Ausbreitung: Bei xerophytischen Moosen steht die Kapsel vielfach aufrecht und öffnet sich bei trockenem Wetter. Dies ermöglicht eine sehr weite Verbreitung. Waldmoose besitzen häufig nach unten gerichtete Kapseln und entlassen die Sporen bei feuchtem Wetter. Daher werden sie nicht so weit verbreitet, können dafür aber unter den feuchten Bedingungen rasch keimen. Für die Ausbreitung spielt auch das Peristom der Kapsel vieler Laubmoose eine wichtige Rolle. Durch hygroskopische Bewegungen öffnen und verschließen die Peristomzähne die Kapsel. Je nach Art ist das Peristom unterschiedlich aufgebaut, sodass es sich entweder bei trockenem oder bei feuchtem Wetter öffnet.[4]
Vegetative Vermehrung
Vegetative Vermehrung spielt bei Moosen eine wesentlich stärkere Rolle als bei allen anderen Pflanzengruppen.
Sie gleicht den Nachteil aus, dass an einem Standort oft nur ein Geschlecht vorhanden und somit keine sexuelle Vermehrung möglich ist. Außerdem werden Brutkörper häufig unter suboptimalen Standortbedingungen wie etwa Trockenperioden gebildet. Ebenso kommen Brutkörper häufiger in Randbereichen des Artareals oder der Höhenverbreitung einer Art vor. Der Induktionsmechanismus für die Bildung von Brutkörpern ist unbekannt, es wird jedoch vermutet, dass das Pflanzenhormon Auxin eine Rolle spielt.[5] Von etlichen Arten sind überhaupt keine Sporophyten bekannt. Solche Arten besiedeln meist sehr kleine Areale. Aber auch manche häufige Waldmoose bilden sehr selten Sporophyten, wie etwa Pleurozium schreberi, Hylocomium splendens und Dicranum scoparium.
Vegetative Vermehrung kann prinzipiell durch alle Teile der Moospflanze erfolgen. Wird ein Gametophyt durch ein Sieb passiert, entstehen aus allen Teilen wieder vollständige Gametophyten. Meist werden jedoch spezielle Verbreitungsmittel gebildet: Flagellenäste, abfällige, das heißt leicht abfallende, Blätter, Stämmchenspitzen, Blattspitzen, spezielle Brutkörper an Blättern, Rippen, Rhizoiden, blattachselständige Brutknospen. Bei Lebermoosen sind spezielle Brutkörper selten, meist werden leicht abbrechende Blätter oder Äste gebildet. Die Marchantiales bilden jedoch Brutkörper in speziellen Brutbechern (Marchantia polymorpha). Die Brutkörper werden durch Wassertropfen aus dem Becher geschleudert (splash-cup-Mechanismus).
Ökologie
Moose sind in der Regel klein und wachsen relativ langsam. Daher sind sie im Vergleich zu den Höheren Pflanzen konkurrenzschwach. Sie weichen daher vielfach auf Standorte aus, die von diesen nicht besiedelt werden können: Felsen, Borke und Blätter als fast nährstofffreie Standorte, Waldböden als sehr dunkle Standorte sowie offene und gestörte Standorte.
Wasserhaushalt
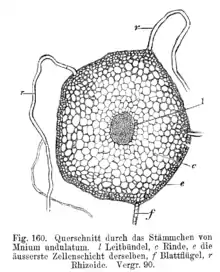
Moose können ihren Wassergehalt nur in sehr beschränktem Ausmaß regulieren, sie sind wechselfeuchte (poikilohydre) Pflanzen.
Nach dem Mechanismus der Wasseraufnahme und -leitung werden zwei Gruppen von Moosen unterschieden:
- Ektohydrische Arten nehmen Wasser über die ganze Oberfläche auf. Wasserleitung erfolgt nur äußerlich, etwa kapillar zwischen Rhizoiden oder Blättchen und Stamm. Diese Arten nutzen auch die Luftfeuchtigkeit. Nach Austrocknung benetzen sie sich sekundenschnell mit Wasser.
- Endohydrische Arten besitzen wasserleitende Elemente und eine Cuticula. Sie nehmen Wasser über die Rhizoiden auf und leiten es im Stämmchen nach oben. Dieser Mechanismus reicht allerdings nicht für die Wasserversorgung aus, sodass bei diesen Arten immer auch äußere Wasseraufnahme vorkommt.
Für die Wasseraufnahme und Speicherung gibt es verschiedene Strukturen: Besitz eines Zentralstranges, äußere Wasserleitung, papillöse Blattoberflächen (erleichtern Benetzung), Wassersäcke (bei manchen Lebermoosen), Blattflügelzellen (wasserspeichernde Zellen an den unteren Blattecken mancher Laubmoose), Zilien (lange Blattzipfel bei manchen Lebermoosen), Hyalozyten (großlumige, tote Zellen bei Torfmoosen und anderen Familien), Lamellen und Filamente an Blattrippen (speichern Wasser in Zwischenräumen).
Verdunstungsschutz
Zur Reduktion des Wasserverlusts durch Verdunstung bilden manche Moose spezielle verdunstungshemmende Strukturen aus: Cuticula (besonders bei marchantialen Lebermoosen). Rollblätter verringern in eingerolltem Zustand die verdunstende Oberfläche. Glashaare reduzieren die Sonneneinstrahlung. Papillen streuen auftreffendes Licht. Die jungen Sporogone sind besonders empfindlich gegen Austrocknung, ihrem Schutz dient die Kalyptra.
Austrocknungsresistenz
Die Resistenz gegen Austrocknung ist je nach Art sehr unterschiedlich ausgeprägt. Die molekularen Ursachen für die Resistenz sind nicht erforscht. Es werden drei Gruppen unterschieden (deren Bezeichnungen denen bei höheren Pflanzen gleichen, aber eine andere Bedeutung haben):
- Hygrophyten werden bereits durch kurzzeitige und geringfügige Austrocknung geschädigt. Hierzu zählen Wasser- und Sumpfmoose.
- Mesophyten ertragen Austrocknung für kürzere Zeit.
- Xerophyten überstehen auch längeres Austrocknen. Selbst nach mehreren Jahren im Herbar können wiederbefeuchtete Moose problemlos reaktiviert werden. Hierzu zählen die Fels- und Baumbewohner unter den Moosen.
Temperatur
Das Temperaturoptimum für das Wachstum beträgt für die temperaten Arten 15 bis 20 °C, bei tropischen bis 25 °C. Der obere Kompensationspunkt für die Fotosynthese liegt bei allen Arten zwischen 25 und 30 °C, bei langfristig höheren Temperaturen sterben sie daher aufgrund zu hoher Atmungsverluste.
Die Frostresistenz ist artspezifisch und unabhängig von Standort und Jahreszeit. Sie korreliert mit der Austrocknungsresistenz einer Art. Zudem sind Moose in ausgetrocknetem Zustand wesentlich frosthärter. Sie können das Einfrieren in flüssigem Stickstoff (−196 °C) überleben.
Die Temperaturobergrenze für kurzzeitige Exposition liegt bei vielen Moosen in feuchtem Zustand bei 42 bis 51 °C, in trockenem Zustand bei 85 bis 110 °C, bei Xerophyten noch höher.
Nährstoffe
Nährstoffe werden von den Moosen über den Niederschlag aufgenommen. Nur Arten mit gut ausgebildetem Leitsystem nehmen Nährstoffe über den Boden auf. Die Quelle sind dabei Staub und im Wasser gelöste Stoffe, im Wald zum Beispiel besonders der Stammablauf und der Kronendurchlass. Moose bringen daher Nährstoffe aus der Atmosphäre ins Ökosystem. Die Aufnahme aus dem Wasser wird durch folgende Anpassungen ermöglicht:
- Die Moose besitzen ein hohes Oberflächen-zu-Volumen-Verhältnis.
- Die Ionenaufnahme ist meist nicht durch eine Cuticula behindert.
- Die Zellwand besitzt eine sehr hohe Kationenaustauschkapazität.
Wie bei den höheren Pflanzen sind die Elemente Kalium, Kalzium, Magnesium, Stickstoff, Phosphor und Schwefel für die Moose essenziell, jedoch benötigen sie sie in wesentlich geringeren Konzentrationen. Darüber hinaus akkumulieren Moose jedoch auch Elemente, die bei höheren Pflanzen nicht vorkommen. Die Ursache liegt darin, dass Moose die Aufnahme von Ionen nicht kontrollieren können. So nehmen sie auch Metalle wie Niob oder Scandium auf.
Die Aufnahme erfolgt in drei Schritten:
- Kationenaustausch an der Zellwand
- Die Ionen gelangen über die semipermeable Zellmembran in das Cytoplasma. Über die Aufnahmemechanismen gibt es keine Untersuchungen.
- Partikel können auch über Pinozytose aufgenommen werden, zum Beispiel Blei.
Für viele Moosarten ist ein ausgewogenes Verhältnis zwischen Kalium, Kalzium und Magnesium notwendig, weshalb viele Arten nur auf sauren Standorten vorkommen. Manche Arten wie Silbermoos (Bryum argenteum) und Brunnenlebermoos (Marchantia polymorpha) bevorzugen stickstoffreiche Standorte, sie sind nitrophil. Sie werden durch die hohen anthropogenen Stickstoffimmissionen in Europa stark gefördert.
Spezielle Standorte



Eine dominierende Stellung haben Moose in Karstgebieten, wo sie nach vielen, meist kleineren, Karstquellen am Ausfällen von Kalktuff beteiligt sind und in Hochmooren, wo Torfmoose (Sphagnum) an der Entstehung, am Aufbau und der Funktion dieser Ökosysteme maßgeblich beteiligt sind. Hier sollen jedoch einige weitere Standorte besprochen werden.
Tundra und Polargebiete
In den Tundren spielen Moose eine große Rolle in Bezug auf die Artenzahl, Bedeckung, Phytomasse und Biomasseproduktion. Dabei erreicht ihr Phytomasseanteil jedoch außer an nassen Standorten nie mehr als 30 %. Die Ursache ist, dass die Photosyntheserate der Moose schon bei geringen Lichtstärken gesättigt ist und sie daher bei vollem Licht eine wesentlich geringere Photosyntheseleistung als Höhere Pflanzen erreichen. Im Ausgleich können Moose bei tiefen Temperaturen noch effektive Photosynthese betreiben, sogar bei Temperaturen unter 0 °C. Gegen allzu tiefe Temperaturen sind die Moose allerdings empfindlich, so dass sie an allzu kalten Standorten nicht mehr vorkommen. In den Tundren bilden die Moose vor allem Polster, Matten und dichte Rasen.
Wüsten
In Wüsten kommen Moose nur stellenweise vor und sind nur in feuchten Perioden erkennbar. In Sandwüsten wachsen sie teilweise von Sand überdeckt, wo sie kühlere und feuchtere Bedingungen haben. In Geröllwüsten können sie unter durchsichtigem Quarzgeröll wachsen (zum Beispiel Aschisma carniolicum). In Salzwassertümpeln wachsen Arten der Lebermoosgattung Riella, die einzigen salztoleranten Moose. Spezielle Anpassungen an Trockenstandorte sind bei marchantialen Lebermoosen: eine Cuticula, Atemporen zur Gasstoffwechselregelung, ein wasserspeicherndes Schwammparenchym, Atemhöhlen, Einrollmechanismen bei Austrocknung, und Bauchschuppen zur Wasseraufnahme. Auch die weiter oben erwähnten Anpassungen zum Strahlungsschutz sind bei Wüstenmoosen häufig vertreten. Die meisten Wüstenmoose sind akrokarpe Laubmoose, besonders Arten der Familie Pottiaceae mit folgenden Anpassungen: Rollblätter, Dickblättrigkeit, Rippen mit wasserspeichernden Zellen, eingerollte Blattränder, Glashaare. Häufig sind auch annuelle oder kurzlebige Arten, die ihren Lebenszyklus in kurzen Feuchtperioden durchlaufen können. Trockenperioden überdauern diese Arten als Sporen. Langlebige Arten sind austrocknungsresistent.
Regenwald

In den tropischen Regenwäldern kommen rund 3000 bis 4000 Arten vor, die jedoch zu 90 % aus nur 15 Familien stammen. Die größte Diversität gibt es in Asien. Große Differenzen bestehen zwischen den Moosfloren Asiens und Afrikas, sodass bei den Moosen nicht von einer Paläotropis gesprochen werden kann. Die Menge der Moose steigt mit der Meereshöhe. Im Tieflandregenwald kommen kaum Moose vor. Die hohen Temperaturen verbunden mit den geringen Lichtintensitäten unter dem dichten Kronendach verhindern eine positive Photosyntheseleistung. Über 1000 Meter Seehöhe steigen Artenzahl und Phytomasse stark an und erreichen zwischen 1800 und 2800 Metern die höchste Dichte, besonders bei epiphytischen Moosen. In den Nebelwäldern kämmen Hängemoose den Nebel aus.
Epiphyten
Die ersten fossilen Funde von epiphytischen Moosen stammen aus dem Tertiär und gehören zu heutigen Gattungen oder Arten. Da die epiphytisch lebenden Arten stark abgeleitete Formen sind, ist diese Lebensweise relativ jung. Epiphytische Moose zeichnen sich durch folgende Anpassungen aus:
- Die Sporen keimen im Sporangium zu einem chlorophyllhaltigen, mehrzelligen Stadium heran. Dies führt auf dem Substrat zu einem Entwicklungsvorsprung.
- Diözische Arten bilden Zwergmännchen, die in den Polstern der weiblichen Pflanzen sitzen. So kann die Befruchtung über die nötige kurze Distanz erfolgen.
- Sie besitzen wasserspeichernde Strukturen.
- Als Lebensformen treten Polster (Wasserspeicher), Wedel und Schweife sowie Hängemoose (zum Nebelauskämmen) auf.
Die Nährstoffzufuhr erfolgt über den Regen. Dadurch sind Epiphyten besonders zahlreich in Gebieten mit hohen Niederschlägen (tropischer Nebelwald).
Epiphylle

Die Eroberung von lebenden Blättern als Lebensraum dürfte noch jünger sein als der Epiphytismus. Epiphylle Moose zeigen die am stärksten abgeleiteten Merkmale, zum Beispiel Neotenie: Bei der Gattung Ephemeropsis ist der Gametophyt stark reduziert, die Gametangien werden in Knospen am Dauerprotonema gebildet. Vorherrschend sind hier die Lebermoose, besonders die Familie Lejeuneaceae. Diese besitzen zur Anhaftung Hapteren an den Rhizoidenden. Epiphylle Moose kommen nur in tropischen und subtropischen immergrünen Regenwäldern vor. Bevorzugt werden glatte, ledrige Blätter, die zunächst von obligaten Epiphyllen besiedelt werden, denen fakultative Epiphylle und zuletzt Laubmoose folgen. Die Vermehrung erfolgt hauptsächlich durch Brutkörper. Zumindest eine Art (Radula flaccida) nutzt das Blatt nicht nur als Lebensraum, sondern dringt mit den Rhizoiden in das Blatt ein und entnimmt Wasser und Mineralien, ist also ein Hemiparasit.
Rolle für das Ökosystem
Dort, wo Moose häufig sind, wie in Bergwäldern und Mooren, haben sie eine wichtige ökologische Rolle im Nährstoffkreislauf, da sie die Nährstoffe aus dem Niederschlag filtern, ferner für den Wasserkreislauf, da sie zum einen Nebel ausfiltern können und zu einem gewissen Grad auch den Niederschlag speichern können.
Als Lebensraum spielen Moose eine Rolle für die Kleintierwelt, und als Keimbett für Blütenpflanzen. Einige Moose bilden Symbiosen mit Cyanobakterien (Blasia, Hornmoose) und Pilzen (Mykorrhiza, bei vielen Lebermoosen). Eine Gattung (Cryptothallus) ist obligat saprophytisch unter Moosdecken. Einige Lebermoose (etwa Colura zoophaga) fangen in ihren Wassersäcken Wimpertierchen und andere Kleintiere. Da ihnen jedoch Verdauungsproteasen fehlen, liegt keine echte Carnivorie, sondern nur Zoophagie vor.
Inhaltsstoffe
In ihren Assimilationspigmenten (Chlorophyll a und b), den Kohlenhydratreservestoffen Stärke und manchmal Fructane, und den Zellwänden aus Cellulose stimmen die Moose mit allen anderen Grünen Pflanzen überein. Im Gegensatz zu den Farn- und Blütenpflanzen kommen jedoch die Zellwandsubstanzen Cutin, Suberin und Lignin faktisch nicht vor.[6][7]
Flavonoide
Flavonoide wurden in knapp der Hälfte der untersuchten Moose nachgewiesen. Sie fehlen bei den Hornmoosen sowie innerhalb der Laubmoose bei den Polytrichidae, Andreaeopsida, und Tetraphididae. Bei den Lebermoosen werden ja nach Familie oder Ordnung charakteristische Flavonoid-Typen gebildet werden, ist bei den Laubmoosen keine systematisch verwertbare Verteilung der Flavonoide erkennbar. Es treten Flavon-C- und O-Glykoside auf, Dihydroflavone, Flavonole, Dihydrochalcone und Aurone. Es gibt auch Flavonoide, die als Glukuronide und Galakturonide auftreten. Bei den Laubmoosen ist das Spektrum wesentlich größer als bei den Lebermoosen. Bei ihnen kommen auch Isoflavone, Biflavone und 3-Desoxy-anthocyanine vor. Das Vorkommen von Isoflavonen bei den Laubmoosen verbindet sie mit den Gabelblattgewächsen, Selaginellales und den Gymnospermen. Auch die Sphagnorubine der Torfmoose zählen zu den Flavonoiden.
Phenolische Substanzen
Sehr wohl kommen aber phenolische Verbindungen, darunter Zimtsäurederivate, vor, die den Abbauprodukten des Lignins in höheren Pflanzen ähneln. Ein Beispiel ist die Sphagnumsäure der Torfmoose (p-Hydroxy-β-(carboxymethyl)-Zimtsäure). Bibenzyle kommen in den Lebermoosen, nicht jedoch in den Laubmoosen vor. Ältere Angaben über das Vorkommen von Lignin sind zu bezweifeln, es dürfte sich stets um Lignane handeln, polyphenolische, lignin-ähnliche Substanzen, die im Vergleich zum Lignin deutlich weniger stark methyliert sind.
Terpene und Terpenoide
Bei Moosen wurden 24 Monoterpene, 172 Sesquiterpene, 44 Diterpenoide, 14 Triterpenoide und 13 Steroide nachgewiesen. Mono- und Sesquiterpene kommen nur bei Lebermoosen vor, Diterpenoide bei Leber- und Laubmoosen, Triterpenoide nur bei Laubmoosen. Diese Stoffe bilden die für die Lebermoose charakteristischen Ölkörper und sind auch für den oft artcharakteristischen Geruch mancher Moose verantwortlich. Zu den Geruchsstoffen zählen vor allem Monoterpene (zum Beispiel Limonen, Pinen, Geraniol, Borneol) und Sesquiterpene (vom Eleman-, Eudesman-, Germacran-, Bisabolantyp). Die blauen Ölkörper von Calypogeia trichomanis sind durch Azulene bedingt. Die meisten Sesquiterpene sind Enantiomere der Verbindungen, die in den höheren Pflanzen vorkommen. Die Diterpene sind vom Labdan-, Pimaran-, Clerodan-, Kaurantyp sowie den nur in den Moosen vorkommenden Dolabellan- und Sacculatantyp.
Biologische Aktivität der Inhaltsstoffe
Die oben angeführten Inhaltsstoffe, besonders die Terpene, sind vielfach biologisch aktiv, wobei folgende Wirkungen bis jetzt bekannt sind:
- Antimikrobielle (fungizide und bakterizide) Wirkung: Obwohl bislang wenig untersucht, ist die Abwehr von Pilzen und Bakterien für die Moose von großer Bedeutung. Man geht daher davon aus, dass alle Moose antimikrobiell wirksame Substanzen enthalten. Erwiesen ist die Wirkung etwa bei Polygodial aus Porella, Norpin-guison aus Conocephalum conicum, Lunularin aus Lunularia cruciata.
- Keimungsfördernde und -hemmende Wirkung: Viele Moosextrakte hemmen oder fördern – je nach Art – das Keimpflanzenwachstum höherer Pflanzen. Die Keimungsrate stieg in Versuchen um bis zu 70 %. Keimungshemmung hilft den Moosen, künftige Konkurrenten nicht aufkommen zu lassen. Aber auch die Keimungsförderung wird so gedeutet: Phytohormon-ähnliche Substanzen lassen die Samen in einem Moospolster schnell keimen, wobei er seine Reserven aufzehrt, bevor er das passende Substrat erreicht und damit abstirbt. Die verantwortlichen Inhaltsstoffe sind bis jetzt nicht isoliert worden. Auch die fungizide Wirkung der Moose verringert durch das Verhindern der Mykorrhizabildung die Konkurrenz durch andere Pflanzen.
- Biozide und fraßhemmende Wirkung: Die meisten Moose enthalten fraßhemmende Stoffe, sodass Moose selten von Pflanzenfressern wie Insekten oder Schnecken gefressen werden. Untersucht wurde diese Wirkung mit Fraßversuchen bei Extrakten aus Laub-, Leber- und Torfmoosen sowie isolierten Wirkstoffen wie dem Sesquiterpen Pinguison aus Aneura pinguis und Plagiochilin A aus Plagiochila. Diese fraßhemmende Wirkung hat den praktischen Vorteil, dass Moosherbarien kaum von Schädlingen befallen werden und auch nicht konserviert werden müssen.
- Einige Moosarten haben eine für den Menschen allergene Wirkung, wie zum Beispiel Frullania tamarisci im Mittelmeergebiet. Auslöser sind meist Lactone.
Areale
Moose besitzen generell größere Areale als Blütenpflanzen, was vor allem auf ihre Ausbreitungsmechanismen über Sporen zurückzuführen ist.
Geschlossene Areale
- Kosmopolitisch verbreitet sind etwa Marchantia polymorpha und Bryum argenteum.
- Ein pangäisches Areal besitzen rund 60 % der Familien. Sie sind weltweit, tropisch oder außertropisch verbreitet. Diese Familien bestehen wahrscheinlich seit dem Perm. Beispiele sind Polytrichaceae, Sphagnaceae, Dicranaceae, Hypnaceae, Bryaceae.
- Ein laurasisches (holarktisches) Areal besitzen ebenfalls sehr viele Moose, etwa die Rhytidiaceae, Timmiaceae, Schistostegiaceae. Die Trennung Nordamerikas durch einen Meeresarm in der Kreidezeit lässt sich noch heute an der unterschiedlichen Moosflora der Ost- und Westküste erkennen.
- Ein Gondwana-Areal besitzen rund 30 % der Familien. Sie sind wahrscheinlich im Mesozoikum entstanden, bevor Gondwana zerbrach.
- Seltener sind Arten mit circum-thetischer Verbreitung (aride Moose mesozoischen Ursprungs) sowie pantropische Areale.
Disjunkte Areale
Kontinentübergreifende Großdisjunktionen treten bei Moosen sehr häufig auf und auch auf Artebene, während sie bei Blütenpflanzen seltener sind und nur auf Gattungsebene auftreten. Diese Disjunktionen können als Reste ehemals zusammenhängender Areale oder als Ergebnis von Fernverbreitung gedeutet werden, was aber im Einzelfall meist nicht mehr eindeutig bestimmbar ist.
- Bipolare Disjunktionen betrifft Arten, die in den außertropischen Gebieten der Nord- und Südhemisphäre vorkommen. Es sind rund 100 Arten mit dieser Verbreitung bekannt, zum Beispiel Conostomum tetragonum.
- Südhemisphärische Disjunktion ist die circumantarktische Verbreitung und ist von rund 50 Arten bekannt, zum Beispiel die Gattung Monoclea.
- Arten mit laurasischer Disjunktion kommen nur in Teilen der Holarktis vor, so zum Beispiel Plagiothecium undulatum nur an den Westküsten Nordamerikas und Europas, Campylopus atrovirens an den Ost- und Westküsten Nordamerikas und Eurasiens. Weitere Möglichkeiten sind eine amphipazifische Verbreitung (Ostasien – West-Nordamerika, zum Beispiel Takakia lepidozioides) und die amphiatlantische Verbreitung (Ost-Nordamerika – West-Europa, zum Beispiel Diphyscium foliosum).
- Eine Disjunktion Neotropen – tropisches Afrika ist von derzeit 334 Arten bekannt, eine Disjunktion tropisches Afrika – Südostasien von 52 Arten. Die Moosfloras Afrikas ähnelt daher stärker der Südamerikas als der Südostasiens. Für die Moose trifft das Konzept der Paläotropis daher nicht zu.
Ungeklärte Disjunktionen
Einige Arten haben derart extrem disjunkte Areale, dass sich ihr Vorkommen jeder Erklärung zu entziehen scheint. Ein Beispiel ist Distichophyllum carinatum aus der ansonsten tropischen Familie der Hookeriaceae. Es ist nur von drei Standorten an feuchten Kalkfelsen der Nordalpen bekannt, wo es auch 1908 erstbeschrieben wurde, sowie aus Japan.[8]
Die in den Tropen verbreitete Art Hyophila involuta wächst auf feuchten Kalkfelsen. Sie kommt allerdings auch in Schweizer Seen, im Bodensee und in Aare und Oberrhein vor, hier jedoch als Wassermoos der Spritzwasserzone.[8]
Fossilgeschichte
Das älteste Moos-Fossil, das Lebermoos Pallavicinites devonicus aus dem untersten Oberdevon, ist rund 350 Millionen Jahre alt. Es wird den heutigen Metzgeriidae zugeordnet. Der Gattungsname Pallavicinites deutet auf die strukturell stark ähnelnde, rezente Gattung Pallavicinia hin.[9]
Aus dem Devon sind nur thallose Lebermoose bekannt. Das älteste Laubmoos, Muscites plumatus, stammt aus dem Unterkarbon Englands. Im Perm traten erste torfmoosartige Laubmoose auf. Im Paläophytikum waren schon alle Großgruppen der Moose vertreten.
Aus dem Mesophytikum sind nur wenige Fossilien bekannt, da dieses Zeitalter eher trocken war und somit die Fossilisationsbedingungen für Moose ungleich schlechter. In dieser Zeit entwickelten sich jedoch die eher trockenangepassten Sippen wie die Marchantiidae: Marchantites cyathoides aus dem Mittleren Trias ist die erste eindeutige Art der Marchantiales. Auch die Jungermanniidae treten hier erstmals auf. Zum Ende der Kreidezeit kommt bereits der erste Vertreter einer heute noch lebenden Gattung vor (Campylopodium allonense). Von der mittleren Kreide bis ins Tertiär treten auch die ersten epiphytischen und epiphyllen Lebermoose sowie bei den Laubmoosen epilithische (auf Gestein wachsende) und pleurokarpe Sippen auf.
Die Mehrzahl der tertiären Fossile kann bereits heute lebenden Arten zugeordnet werden, womit viele Arten mindestens 40 Millionen Jahre alt sind. In Europa finden sich aus dem Tertiär viele Arten, die heute nur noch in subtropischen Gebieten vorkommen, etwa den Kanaren oder Azoren. In Europa sind sie während der Eiszeiten ausgestorben.
Überleben
Nachdem sie 1500 Jahre eingefroren unter dem antarktischen Eis lag, begann eine Moospflanze nach einigen Wochen unter idealen Brutbedingungen wieder zu sprießen. Bis dahin hatte man die Überlebensfähigkeit mehrzelliger Organismen auf maximal 20 Jahre geschätzt.[10] Dabei helfen bestimmte Gene, die bei sinkenden Temperaturen aktiviert werden und nur in Moosen vorkommen.[11][12]
Systematik
Bis in jüngste Zeit wurden die Moose als einheitliche Gruppe aufgefasst und in zwei bis drei Klassen untergliedert: Lebermoose, Laubmoose und in jüngerer Zeit Hornmoose. In den letzten Jahren sind vor allem aufgrund von Ultrastrukturforschungen und molekularbiologischen Erkenntnissen die tiefgreifenden Unterschiede zwischen diesen Gruppen deutlich geworden, sodass sie in immer höhere taxonomische Einheiten gestellt wurden. Die drei Großgruppen werden heute von den meisten Autoren als monophyletisch angesehen.[13] Ihre Stellung zueinander sowie zu den übrigen Landpflanzen, den Gefäßpflanzen, ist noch nicht endgültig geklärt.
Die Moose sind wahrscheinlich keine monophyletische Einheit. Studien der Spermatogenese sowie von Chloroplasten-Genen postulieren zwar eine Monophylie der Moose und eine basale Dichotomie zwischen Moosen und Gefäßpflanzen an der Basis der Embryophyten.[14] Die meisten Studien seit circa 1980, als die Paraphylie der Moose erstmals postuliert wurde, deuten jedoch auf eine Paraphylie der Moose hin.[15] Eine Studie aus dem Jahr 2014 kam jedoch zu dem Schluss, dass dies auf einem Artefakt beruht, verursacht vor allem durch stille Mutationen.[16] Die Frage, welche Moosgruppe innerhalb der Embryophyten die basalste ist, die Leber- oder die Hornmoose, ist nicht endgültig geklärt. Viele Studien sprechen dafür, dass Laub- und Lebermoose Schwestergruppen sind: besonders Studien zu Spermatogenese, Spermien-Ultrastruktur, genereller Morphologie und genetische Studien.[17] Es gibt aber auch auf Sequenzdaten und auf Genomstrukturen gestützte Argumente dafür, dass die Hornmoose die Schwestergruppe der Gefäßpflanzen sind.[13] Eine auf breiter Basis durchgeführte Studie hat dies 2006 weiter untermauert und folgendes Kladogramm vorgeschlagen:[18]
| |||||||||||||||||||
Die Moose werden heute allgemein nicht mehr als Verwandtschaftsgruppe angesehen. Die drei Gruppen werden nur mehr als gemeinsamer Organisationstyp angesehen. Die drei Abteilungen mit der Untergliederung bis zur Klasse sind:[19]
- Abteilung Lebermoose (Marchantiophyta)
- Überklasse I
- Klasse Treubiopsida
- Klasse Haplomitriopsida
- Überklasse II
- Klasse Blasiopsida
- Klasse Marchantiopsida
- Überklasse III
- Klasse Fossombroniopsida
- Klasse Pallaviciniopsida
- Klasse Pelliopsida
- Überklasse IV
- Klasse Jungermanniopsida
- Überklasse I
- Abteilung Laubmoose (Bryophyta)
- Unterabteilung Takakiophytina
- Klasse Takakiopsida
- Unterabteilung Sphagnophytina
- Klasse Sphagnopsida
- Unterabteilung Bryophytina
- Klasse Andreaeopsida
- Klasse Oedipodiopsida
- Klasse Tetraphidopsida
- Klasse Polytrichopsida
- Klasse Bryopsida
- Unterabteilung Takakiophytina
- Abteilung Hornmoose (Anthocerotophyta)
- Klasse Leiosporocerotopsida
- Klasse Anthocerotopsida
Für eine Klassifikation bis zur Familie siehe Systematik der Moose.
Gefährdung und Schutz
Die Gefährdung von Moosarten liegt vor allem in der Zerstörung ihres Lebensraumes begründet, in Mitteleuropa besonders durch die Intensivierung von Land- und Forstwirtschaft, wodurch besonders Arten der Stoppeläcker, epiphytische Moose auf Laubbäumen und Arten auf Totholz gefährdet sind. Weitere Gründe sind die Verbauung besonders von Feuchtgebieten und das Absenken des Grundwasserspiegels. Darüber hinaus ist die Luft- und Gewässerverschmutzung zu nennen, wobei die Verbesserung der Luftqualität in Mitteleuropa wieder zu einer Rückkehr der epiphytischen Moose in die Ballungsräume führt.
Die weltweite Rote Liste, erstellt von der International Association of Bryologists, enthält 91 Arten.[20] Ebenso gibt es eine Rote Liste für Europa[21] sowie einige europäische Staaten, darunter Belgien, Deutschland[22], Österreich[23], Polen, Schweden und die Schweiz.[24] In Deutschland gibt es auch Rote Listen für die meisten Bundesländer. Besonders stark ist die Gefährdung in Ballungsräumen. 1991 waren in West-Berlin 33 % der Arten verschollen oder ausgestorben und nur 23 % nicht gefährdet, während in ländlicheren Gebieten wie Sachsen 57 % der Arten gefährdet waren (1995) und in den Niederlanden 50 % (1992).
| Erhaltungszustände der Moosarten des Anhang II der FFH-Richtlinie in Deutschland (Berichtszeitraum 2007–2012)[25] | ||||
| Artname (deutsch) | Artname (wissenschaftlich) | ALP | ATL | CON |
|---|---|---|---|---|
| Vogesen-Bruchmoos | Bruchia vogesiaca | k. A. | k. A. | k. A. |
| Grünes Koboldmoos | Buxbaumia viridis | --- | ||
| Haar-Klauenmoos | Dichelyma capillaceum | --- | --- | |
| Grünes Gabelzahnmoos | Dicranum viride | --- | ||
| Gekieltes Zweiblattmoos | Distichophyllum carinatum | --- | --- | |
| Lappländisches Sichelmoos | Hamatocaulis lapponicus | k. A. | k. A. | k. A. |
| Firnisglänzendes Sichelmoos | Hamatocaulis vernicosus | k. A. | k. A. | k. A. |
| Gemeines Weißmoos | Leucobryum glaucum | |||
| Dreimänniges Zwerglungenmoos | Mannia triandra | --- | ||
| Langstieliges Schwanenhalsmoos | Meesia longiseta | k. A. | k. A. | k. A. |
| Kugel-Hornmoos | Notothylas orbicularis | --- | --- | |
| Rogers Kapuzenmoos | Orthotrichum rogeri | --- | ||
| Kärntner Spatenmoos | Scapania carinthiaca | --- | --- | |
| Rudolphis Trompetenmoos | Tayloria rudolphiana | --- | --- | |
| ALP = alpine biogeografische Region, ATL = atlantische biogeografische Region, CON = kontinentale biogeografische Region grün = günstiger Erhaltungszustand, orange = unzureichender Erhaltungszustand, rot = schlechter Erhaltungszustand grau = unbekannter Erhaltungszustand, --- = die Art kommt in der jeweiligen biogeografischen Region nicht vor k. A. = im Bericht wurde die Art nicht berücksichtigt | ||||
In Österreich gelten 29 % der 762 bekannten Laubmoosarten als gefährdet bis ausgestorben (davon 32 als ausgestorben oder verschollen und 24 vom Aussterben bedroht), während weitere 100 Arten als potentiell gefährdet eingestuft werden.[26] Von den 256 bekannten Lebermoosen (inklusive Hornmoose) gelten 23 % als gefährdet bis ausgestorben (davon 8 als ausgestorben oder verschollen und 10 vom Aussterben bedroht), während weitere 54 Arten als potentiell gefährdet eingestuft werden.[27]
In der Schweiz sind von den 1093 Arten und Unterarten 38 % auf der Roten Liste aufgeführt. Davon sind 15 Arten ausgestorben und 5,6 % vom Aussterben bedroht. Rund 47 % der Moose gelten als nicht gefährdet.[28] Besonders häufig vertreten sind Arten der Trockenrasen und von offenerdigen Flächen, wie zum Beispiel Äckern. Arten von Nass-Standorten sind nicht mehr so stark gefährdet, Ergebnis des verstärkten Schutzes von Mooren.
In Deutschland gelten von den 1121 Moosarten 54 als ausgestorben, 28 als vom Aussterben bedroht, 104 als stark gefährdet und 203 Arten als gefährdet.[29]
Im Washingtoner Artenschutzabkommen (CITES) sind keine Moose aufgeführt. In der Berner Konvention sind neun Lebermoos- und 13 Laubmoosarten aufgeführt. In vielen Ländern sind keine Moosarten geschützt, der Schutz erfolgt hier ausschließlich über Habitatschutz. In Deutschland sind durch die Bundesartenschutzverordnung (Fassung 16. Februar 2005, Liste) alle Arten der Gattungen Hylocomium, Leucobryum und Sphagnum geschützt. Damit ist jegliche Entnahme aus der Natur verboten. In Österreich ist, wie auch in Belgien und Teilen der Niederlande, die kommerzielle Nutzung der Torfmoose verboten. In wenigen weiteren Ländern sind manche Arten dezidiert geschützt, darunter in Estland, Finnland, Großbritannien, Ungarn, Japan, Lettland, Litauen, Luxemburg, Mexico, Portugal, Spanien und Ukraine.
In den Ländern der Europäischen Union unterliegen 88 Moosarten dem Schutzregime der FFH-Richtlinie, wovon 31 Arten im Anhang II der Richtlinie gelistet sind. Für diese in Anhang II geführten Arten haben die EU-Mitgliedstaaten Schutzgebiete auszuweisen.[30]
In Deutschland kommen 13 der Anhang II-Moosarten vor (siehe nebenstehende Tabelle).[30]
Moose und Mensch
Nutzung durch den Menschen

Für den Menschen waren und sind die Moose schon seit langem von Nutzen. Einige Verwendungszwecke waren etwa die Nutzung als Füllmaterial von Matratzen und Polstern, weshalb Linné eine Gattung Hypnum, Schlafmoos, nannte. Eskimos und Japaner verwendeten Moose als Sargfüllung. Bei Blockhäusern wurden vielfach die Ritzen mit Moosen ausgestopft, wie auch bei mittelalterlichen Booten. Trockenes Moos wurde als Verpackungsmaterial beim Versand zerbrechlicher Objekte verwendet, feuchtes Moos beim Versand von Gartenpflanzen. In Japan werden kleine Moosgärten in Bonsai-Pflanzschalen wie auch große etwa um buddhistische Tempel angelegt. Etliche Moosarten wie beispielsweise das Weißmoos (Leucobryum glaucum) sind im Modellbau (Architekturmodell für Sträucher) sowie in der Floristik als Dekoration (etwa Mooskränze für Gräber) beliebt und in Weihnachtskrippen Tradition.
In der Aquaristik dienen aquatische Moose als Dekorationselemente, Laichsubstrate und Versteckplätze für Aquarienbewohner.[31] Unter der Sammelbezeichnung „Javamoos“ werden verschiedene Arten mit morphologischer Ähnlichkeit zu Taxiphyllum barbieri schon seit Jahrzehnten im Aquarium gepflegt, wobei der Einsatz als Laichsubstrat in der Vergangenheit meist im Vordergrund stand. Im Zuge einer steigenden Nachfrage für die Gestaltung von Naturaquarien und Nano-Aquarien wurde in den letzten Jahren eine Vielzahl weiterer Arten charakterisiert und auf den Markt gebracht.
Torfmoose dienten bis in den Ersten Weltkrieg als Wundkompressen. Neben der hohen Wasseraufnahmekapazität war die antimikrobielle Wirkung der Moose von Bedeutung. Einige Naturvölker nutzten diese beiden Eigenschaften, indem sie aus Moosen Babywindeln herstellten, etwa manche Indianer- und Eskimogruppen. Auch die Anwendung als Menstruationsbinde kam vor. Ausgrabungen zeigten, dass in Mitteleuropa während des Mittelalters Moose als Toilettenpapier verwendet wurden.
Besonders Lebermoose wurden wegen der antimikrobiellen Wirkung in der Volksmedizin verwendet. Manche Indianer Nordamerikas bereiteten aus Moosen Salben zur Wundversorgung zu. In der Traditionellen Chinesischen Medizin werden rund 40 Moosarten verwendet, etwa gegen Verbrennungen, Ekzeme, Angina und Bronchitis.
Auf menschlichen Schädeln gewachsene Moose wie Homalothecium sericeum[32] galten als zauberkräftig[33] und wurden bis ins 17. Jahrhundert als wundreinigendes[34] und blutstillendes Arzneimittel benutzt. So zum Beispiel gemäß Tabernaemontanus (1558, bearbeitet 1664 durch C. Bauhin): „Mooß von Todtenkopff, Muscus ex craneo humano [...]. Etliche Medici und Apotheker legen einen Todtenkopff eine zeitlang an einem feuchten Orth, auß welchem endtlich ein Mooß herfuer waechst [...] zu der Blutstillung“.[35]
Die größte wirtschaftliche Bedeutung hat der Hochmoortorf aus Torfmoosen. Er wird vor allem als Kultursubstrat im Gartenbau sowie als Brennstoff genutzt. In Russland, Irland und Finnland gibt es Torfkraftwerke zur Stromerzeugung.
Im Bauwesen wird getrocknetes Moos als Dämmstoff verwendet. In den meisten Fällen wird es zuvor chemisch gegen Insektenbefall behandelt, zur Verminderung der Hygroskopizität sowie zur Verbesserung der brandschutztechnischen Eigenschaften. Im historischen Blockbau (z. B. in der Spreewald-Region) wurden die Fugen zwischen den Rundhölzern bzw. Kanthölzern mit Moos ausgestopft und dadurch abgedichtet, darauf erfolgte ein Lehmverstrich. Wenn sich Moos auf freibewittertem Beton ansiedelt (Mauerwerk, Betondachsteine), kann dies langfristig zur Zerstörung der Betonoberflächen beitragen. Das hohe Feuchtigkeitsspeichervermögen von Moos verhindert die Austrocknung des Betons, was bei Frost zum Absanden des Betons und langfristig zu seiner Oberflächenzerstörung führt.
Eine besonders frühe bekannte Verwendung durch Römer in Nordengland ist das Isolieren der Hohlräume unter Holzfußböden. Abdichtungen von Holzbauten erfolgten vermutlich weltweit mit Moos, hierzulande in Almhütten noch heute verbreitet. Das Moos, das am häufigsten für Kaminabdichtungen verwendet wurde, wurde danach benannt: Fontinalis antipyretica (Quellmoos oder Fiebermoos[36]), von lateinisch antipyreticus „gegen das Feuer“.[37] Manche Moose können bis zum 30-Fachen ihres Trockengewichts Wasser aufnehmen, was ihre Verwendung als Babywindel und Menstruationsbinde begründet. Im 1. Weltkrieg hat Verbandsmaterial in erster Linie aus Torfmoosen in „Leinensackerln“ bestanden. Torf (aus Torfmoosen) ist ein gutes Substrat für Gartenbau, sollte jedoch als Kohlenstoffspeicher im Sinn des Klimaschutzes geschont werden. Im Mikroskop oder schon unter der Lupe sehen manche Moose wie Wälder aus, ein Mikrokosmos mit darin schwimmenden Bärtierchen und anderen wenig- oder einzellige Tierchen. Moose leben kaum im Wasser, sehr wohl aber in Spritzwasserbereichen entlang von Fließgewässern.[38]
Verwendung als Bioindikatoren
Mehrere Eigenschaften machen die Moose zu sehr guten Bioindikatoren: Sie nehmen Wasser und Nährstoffe über die Oberfläche auf und sind so der direkten Wirkung von Schadstoffen ausgesetzt; ihr kurzer Lebenszyklus führt zu raschen Reaktionen auf Umweltveränderungen; sie sind makroskopisch bestimmbar und ganzjährig präsent. Sie werden jedoch bis jetzt nur in Europa, Kanada, Japan und Neuseeland als Bioindikatoren verwendet. Aktives und passives Biomonitoring mittels Moosen ist in einigen VDI-Richtlinien standardisiert.[39] Die Norm EN 16414 beschreibt ebenfalls passives Biomonitoring mit Moosen.[40]
- Bei Wasserverschmutzung zeigen Moose organische und chemische Belastung an, Gewässerversauerung und Schwermetallbelastung.
- Bei Luftverschmutzung reagieren Moose besonders auf Schwefeldioxid. In den vergangenen Jahrzehnten wurde die steigende Belastung anhand des Verschwindens von Moosen aus Industriegebieten kartiert, heute die sinkende Belastung anhand der Wiederbesiedlung, besonders durch Epiphyten. Auch die räumliche Verteilung der Stickstoffdeposition lässt sich mit Moosen verfolgen.[41]
- Moose akkumulieren aufgrund ihrer hohen Ionenaustauschkapazitäten Schwermetalle. Die Moosoberfläche wirkt dabei aufgrund negativ geladener Gruppen als effektiver Kationenaustauscher.[42] Europaweit werden zum Monitoring die Moosarten Hylocomium splendens, Hypnum cupressiforme und Pleurozium schreberi untersucht. Das Forschungskonsortium Mossclone testet, welche Torfmoose sich zur standardisierten Luftüberwachung eignen.[43] Die gleichen Mechanismen lassen Moose auch Radionuklide anreichern, sodass sie als Langzeitsensoren für die radioaktive Belastung dienen.
- Aufgrund ihres kurzen Lebenszyklus und der weiten Sporenausbreitung reagieren Moose rasch auf Klimafluktuationen, indem sich ihr Areal verschiebt. In den gemäßigten Zonen wie in Mitteleuropa sind die Hauptvegetationsperioden der Moose der Herbst, die frostfreien Perioden im Winter und das Frühjahr. Daher reagieren in diesem Gebiet die Moose besonders stark auf Änderungen der Wintertemperaturen. In den letzten Jahren, zwischen 1985 und 1999, sind 32 Moosarten aus den wintermilden atlantischen und mediterranen Gebiet nach Mitteleuropa vorgedrungen.
Produktion von Biopharmazeutika
Das Laubmoos Physcomitrella patens ist ein Modellorganismus der Entwicklungsbiologie und molekularen Evolution der Pflanzen mit zunehmender Nutzung durch die Biotechnologie. Es kann in Moosbioreaktoren kultiviert und durch Homologe Rekombination zielgerichtet genetisch verändert werden.[44] Bei der Verwendung von transgenem Moos zur Produktion von Biopharmazeutika kann das rekombinante Protein im Optimalfall aus dem Kulturmedium aufgereinigt werden.[45] Durch den Einsatz bestimmter Knockout-Moose kann das Glykosylierungsmuster im Sinne einer Humanisierung des Biopharmazeutikums verändert werden.[46] Ein Beispiel für die Produktion von Biopharmazeutika in Moos stellt Faktor H dar: dieses Molekül ist Bestandteil des humanen Komplementsystems, ein Defekt des entsprechenden Gens führt zu verschiedenen Nieren- und Augenerkrankungen. Biologisch aktiver, rekombinanter Faktor H wurde Anfang des Jahres 2011 in Moosbioreaktoren hergestellt.[47]
Literatur
Der Artikel basiert vor allem auf folgenden zwei Büchern:
- Jan-Peter Frahm: Biologie der Moose. Spektrum Akademischer Verlag, Heidelberg und Berlin 2001, ISBN 3-8274-0164-X
- Jan-Peter Frahm, Wolfgang Frey, J. Döring: Moosflora. (Stuttgart 1983) 4., neu bearbeitete und erweiterte Auflage (UTB für Wissenschaft, Band 1250). Ulmer, Stuttgart 2004, ISBN 3-8001-2772-5 (Ulmer) & ISBN 3-8252-1250-5 (UTB)
- Weiterführende Literatur
- Franz Fukarek et al.: Urania-Pflanzenreich: Moose, Farne, Nacktsamer. Urania, Berlin 2000, ISBN 3-332-01168-5
- Janice M. Glime: Bryophyte Ecology. Volume 1. Physiological Ecology. Ebook sponsored by Michigan Technological University and the International Association of Bryologists. 2007 online
- Martin Hellbach: Die Verwendung von Moosen in der japanischen und europäischen Gartenkultur: Darstellung und Vergleich. In: Die Gartenkunst 25 (2/2013), S. 377–400.
- Robin Wall Kimmerer: Gathering Moss: A Natural and Cultural History of Mosses. Oregon State University Press, 2003
- J. Shaw, K. Renzaglia: Phylogeny and diversification of bryophytes. American Journal of Botany 91(10), 2004, S. 1557–1581.
- Volkmar Wirth, Ruprecht Düll: Farbatlas Flechten und Moose. Ulmer, Stuttgart 2000, ISBN 3-8001-3517-5.
- Ruprecht Düll: Exkursionstaschenbuch der wichtigsten Moose Deutschlands. Eine Einführung in die Mooskunde, mit besonderer Berücksichtigung der Biologie und Ökologie der Moose (für die Lupenbestimmung der leicht erkennbaren Arten im Gelände). Rheydt 1985.
Weblinks
- http://www.blam-hp.eu/
- http://www.bryolich.ch/
- Moose in Deutschland
- Eroberung des Landes durch Fremd-DNA
- Moose! Warum jetzt die beste Zeit ist, sie zu entdecken von Johanna Romberg am 18. Januar 2022 auf riffreporter.de (mit 19 Fotos)
Einzelnachweise
- Alfred Helfenstein: Das Namengut des Pilatusgebietes. Keller, Luzern 1982, ISBN 3-85766-004-X, S. 26 f. (Musflue) und 49 (Moos: „unscheinbare Pflanze, die moorigen Boden bevorzugt, aber auch Fluren, worauf diese üppig gedeiht“).
- Vgl. auch Jürgen Martin: Die ‚Ulmer Wundarznei‘. Einleitung – Text – Glossar zu einem Denkmal deutscher Fachprosa des 15. Jahrhunderts. Königshausen & Neumann, Würzburg 1991 (= Würzburger medizinhistorische Forschungen. Band 52), ISBN 3-88479-801-4 (zugleich Medizinische Dissertation Würzburg 1990), S. 151 (mies/mieß [Neutrum und Maskulinum]).
- Peter H. Raven, Ray F. Evert, Susan E. Eichhorn: Biologie der Pflanzen. Gruyter, 2006, S. 415 ISBN 3-11-018531-8
- Frahm: Biologie der Moose 2001, S. 195.
- Frahm: Biologie der Moose 2001, S. 170.
- Der ganze Abschnitt folgt D. Frohne, U. Jensen: Systematik des Pflanzenreichs unter besonderer Berücksichtigung chemischer Merkmale und pflanzlicher Drogen. 4. Auflage, G. Fischer, Stuttgart, Jena, New York 1992, ISBN 3-437-20486-6, S. 70–74.
- Jan-Peter Frahm: Biologie der Moose. Spektrum Akademischer Verlag, Heidelberg und Berlin 2001, ISBN 3-8274-0164-X, S. 262–266.
- Frahm: Biologie der Moose, 2001, S. 221 f.
- Frahm: Biologie der Moose 2001, S. 46.
- Moospflanze überlebt 1.500 Jahre unter antarktischem Eis, ORF.at vom 17. März 2014
- „Tough as Old Moss“, The American Scholar vom 15. Oktober 2014
- „Moose überleben Klimakatastrophen“, Laborpraxis vom 15. September 2014
- J. Shaw, K. Renzaglia: Phylogeny and diversification of bryophytes. American Journal of Botany 91(10), 2004, S. 1557–1581.
- Garbary, Renzaglia: Bryophyte phylogeny and the evolution of land plants: evidence from development and ultrastructure. In: Bates, Ashton, Duckett (Hrsg.): Bryology for the twenty-first century. W.S. Mancy and Sons, Leeds 1998. Nishiyama et al.: Chloroplast Phylogeny Indicates that Bryophytes Are Monophyletic. Molecular Biology and Evolution 21(10), 2004, S. 1813–1819.
- R.J. Duff, D.L. Nickrent: Phylogenetic relationships of land plants using mitochondrial small-subunit rDNA sequences. American Journal of Botany 86(3) 1999, S. 372–386.
- Cymon J. Cox, Blaise Li, Peter G. Foster, T. Martin Embley, Peter Civáň: Conflicting Phylogenies for Early Land Plants are Caused by Composition Biases among Synonymous Substitutions. In: Systematic Biology. 63, Nr. 2, 2014, S. 272–279. doi:10.1093/sysbio/syt109. PMID 24399481. PMC 3926305 (freier Volltext).
- D.L. Nickrent, C.L. Parkinson, J.D. Palmer, R.J. Duff: Multigene Phylogeny of Land Plants with Special Reference to Bryophytes and the Earliest Land Plants. Molecular Biology and Evolution 17 (12) 2000, S. 1885–1895.
- Yin-Long Qiu et al.: The deepest divergences in land plants inferred from phylogenomic evidence. In: Proceedings of the National Academy of Sciences 103, (42), (2006), S. 15511–15516, doi:10.1073/pnas.0603335103.
- Wolfgang Frey, Eberhard Fischer, Michael Stech: Bryophytes and seedless Vascular Plants. In: Wolfgang Frey (Hrsg.): Syllabus of Plant Families - A. Engler's Syllabus der Pflanzenfamilien. 13. Auflage. Band 3. Borntraeger, Berlin/Stuttgart 2009, ISBN 978-3-443-01063-8.
- Tan, Geissler, Hallingbäck: Towards a World Red List of Bryophytes. Bryological Times (77), S. 3–6.
- Schumacker & Martiny: Red Data Bood of European Bryophytes. Part 2: Threatened bryophytes in Europe including Macaronesia. Trondheim 1995
- Ludwig et al.: Rote Liste der Moose (Anthocerophyta et Bryophyta) Deutschlands. In: G. Ludwig, M. Schnittler (Bearb.): Rote Liste gefährdeter Pflanzen Deutschlands. Schriftenreihe Vegetationskunde Band 28, S. 189–306. ISBN 3-89624-001-3
- H. Niklfeld: Rote Listen gefährdeter Pflanzen Österreichs. Grüne Reihe des Bundesministeriums für Umwelt, Jugend und Familie Band 10, Wien 1999, S. 153–186. ISBN 3-85333-028-2
- Norbert Schnyder et al.: Rote Liste der gefährdeten Arten der Schweiz: Moose. Ausgabe 2004 (PDF).
- European Topic Centre on Biological Diversity (2014): Species assessments at EU biogeographical level, Stand: 28. Februar 2014
- Grims, Köckinger: Rote Liste gefährdeter Laubmoose (Musci) Österreichs. 2. Fassung. In: H. Niklfeld: Rote Listen gefährdeter Pflanzen Österreichs. S. 157–171.
- Saukel, Köckinger: Rote Liste gefährdeter Lebermoose (Hepaticae) und Hornmoose (Anthocerotae) Österreichs. 2. Fassung. In: H. Niklfeld: Rote Listen gefährdeter Pflanzen Österreichs. S. 172–179.
- Bundesamt für Umwelt (BAFU): Rote Listen: Moose. Stand 2007 (Memento vom 20. Dezember 2008 im Internet Archive).
- Tabelle des BFN (PDF; 51 kB).
- Weddeling, K., Ludwig, G. & Hachtel, M. (2005): Die Moose (Bryophyta, Marchantiophyta, Anthocerophyta) der FFH-Richtlinie, S. 207–329, in: Petersen, B., Ellwanger, G., Biewald, G., Boye, P., Hauke, U., Ludwig, G., Pretscher, P., Schröder, E., Symank, A. (2005): Das europäische Schutzgebietssystem Natura 2000 – Ökologie und Verbreitung von Arten der FFH-Richtlinie in Deutschland, Band 1: Pflanzen und Wirbellose, Schriftenreihe für Landschaftspflege und Naturschutz, Band 69, 743 S. (PDF; 48 kB)
- Glime, J. M. (2007): Economic and ethnic uses of bryophytes. In: Flora of North America Editorial Committee. (Hrsg.). Flora of North America North of Mexico. Vol. 27. Bryophyta, part 1. Oxford University Press, New York. S. 14–41 (PDF)
- Karl-Heinz Weimann: Die deutsche medizinische Fachsprache des Paracelsus. Philosophische Dissertation, Erlangen 1951, S. 504 f.
- Jakob Grimm: Deutsche Mythologie. I–III, Berlin 1835; 4. Aufl., besorgt von Elard H. Meyer, Berlin 1875–1878; Neudruck, mit einer Einführung von Leopold Kretzenbacher, Graz 1968; Nachdruck Wiesbaden 1992, Band III, S. 349.
- Philippus Begardi: Index Sanitatits. Eyn schoens und vast nützichs Buechlin, genant Zeyger der gesuntheyt [...]., Worms 1539, Blatt 29.
- Dieter Beckmann, Barbara Beckmann: Alraune, Beifuß und andere Hexenkräuter. Alltagswissen vergangener Zeiten. Frankfurt am Main/ New York 1990, S. 196.
- www.flowgrow.de.
- Vgl. dazu www.swissbryophytes.ch.
- Lothar Bodingbauer: Vom Leben der Natur : Überlebenskünstler in grünen Polstern : Der Botaniker Harald Zechmeister über Moose. Teil 3: Eine ganze Welt im Mikroskop gesendet 15. März 2018, 08.55–09.00 Uhr und Beschreibung. 7 Tage nachhörbar, downloadbar.
- VDI 3957 Blatt 1:2014-09 Biologische Messverfahren zur Ermittlung und Beurteilung der Wirkung von Luftverunreinigungen auf Pflanzen (Biomonitoring); Grundlagen und Zielsetzung (Biological measuring techniques for the determination and evaluation of effects of air pollutants on plants (biomonitoring); Fundamentals and aims). Beuth Verlag, Berlin, S. 10–12.
- DIN EN 16414:2014-08 Außenluft; Biomonitoring mit Moosen; Akkumulation von Luftschadstoffen in Moosen (passives Monitoring): Probenahme und Probenaufbereitung; Deutsche Fassung EN 16414:2014. Beuth Verlag, Berlin, S. 6.
- Karsten Mohr: Biomonitoring von Stickstoffdeposition mit Moosen. In: Gefahrstoffe – Reinhalt. Luft. 74, Nr. 6, 2014, ISSN 0949-8036, S. 263–265.
- VDI 3957 Blatt 17:2009-07 Biologische Messverfahren zur Ermittlung und Beurteilung der Wirkung von Luftverunreinigungen (Bioindikation); Aktives Monitoring der Schwermetallbelastung mit Torfmoosen (Sphagnum-bag-technique)(Biological measurement procedures to determine and assess effects of air pollutants on plants (bioindication); Active monitoring of the heavy metal load with peat moss (Sphagnum-bag-technique)). Beuth Verlag, Berlin, S. 2–3.
- Video „Moose sollen Luftverschmutzung kontrollieren“, Euronews, 3. Juni 2013, abgerufen am 24. Juni 2013
- Ralf Reski (1998): Physcomitrella and Arabidopsis: the David and Goliath of reverse genetics. Trends in Plant Science 3, S. 209–210, doi:10.1016/S1360-1385(98)01257-6
- Baur, A., R. Reski, G. Gorr (2005): Enhanced recovery of a secreted recombinant human growth factor using stabilizing additives and by co-expression of human serum albumin in the moss Physcomitrella patens. Plant Biotech. J. 3, S. 331–340 doi:10.1111/j.1467-7652.2005.00127.x
- Eva L. Decker, Ralf Reski (2008): Current achievements in the production of complex biopharmaceuticals with moss bioreactors. Bioprocess and Biosystems Engineering 31(1), S. 3–9 PMID 17701058
- Büttner-Mainik, A., J. Parsons, H. Jérôme, A. Hartmann, S. Lamer, A. Schaaf, A. Schlosser, P.F. Zipfel, R. Reski, E.L. Decker (2011): Production of biologically active recombinant human factor H in Physcomitrella. Plant Biotechnology Journal 9, S. 373–383. doi:10.1111/j.1467-7652.2010.00552.x
-Limonen.svg.png.webp)
