Photosystem II
Das Photosystem II (abgekürzt PSII) ist ein Teil des Photosynthese-Systems von Pflanzen, Algen und Cyanobakterien. Es ist ein Proteinkomplex, der in die Thylakoidmembran der Chloroplasten eingebettet ist, zu beiden Seiten in deren Stroma bzw. Lumen ragt und in dem der erste Schritt der Lichtreaktion stattfindet. Bei diesem Schritt wird im Reaktionszentrum Plastochinon zu Plastochinol reduziert, wobei das von Pigmenten absorbierte Licht als Energiequelle verwendet wird. Die Energie des Lichts wird also in Form eines Reduktionspotentials gespeichert. Dieses Reduktionspotential wird für die weiteren im Photosystem I (PSI) ablaufenden Schritte der Photosynthese-Lichtreaktion benötigt.
| Übergeordnet |
| Photosystem |
| Untergeordnet |
| Photosystem II-Reaktionszentrum Lichtsammelkomplex II |
| Gene Ontology |
|---|
| QuickGO |
Struktur

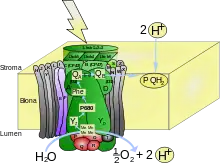
Das PSII ist ein Heterodimer aus den beiden Proteinen D1 und D2, die zueinander homolog sind.[1] Dieses Heterodimer bildet je nach Art einen aus etwa 20 Untereinheiten zusammengesetzten Proteinkomplex, in welchem die für die Lichtabsorption relevanten Lichtsammelpigmente eingebettet sind. Die Proteinstruktur hält die Lichtsammelpigmente in ihrer Position, so dass die Energie von Pigment zu Pigment möglichst effizient übertragen werden kann. Ein PSII-Monomer(D1 oder D2) enthält als Lichtsammelpigmente etwa 35 Moleküle Chlorophyll a und 11 Moleküle β-Carotin.[2] Im Zentrum des PSII-Monomers liegt das so genannte special pair, zwei dicht beieinander liegende Chlorophylle, auf die die gesamte absorbierte Energie transferiert wird. Durch ihre enge räumliche Nähe zueinander ist ihr Energieniveau durch exzitonische Wechselwirkungen abgesenkt, so dass sie ihr Absorptionsmaximum bei 680 nm besitzen. Aus diesem Grund werden sie auch als P680 bezeichnet.[3]
In unmittelbarer räumlicher Nachbarschaft zum special pair befinden sich ein Pheophytin- und ein Plastochinon-Molekül, über die die Energie weiter zu einem anderen Plastochinon-Molekül transferiert wird. Dieses wird reduziert und verwendet sein Reduktionspotential für die weiteren Schritte der Lichtreaktion. Das nun positiv geladene special pair entzieht von Wassermolekülen über einen benachbarten Mangan-Komplex Elektronen, so dass es wieder im Ausgangszustand vorliegt und erneut Energie absorbieren kann.
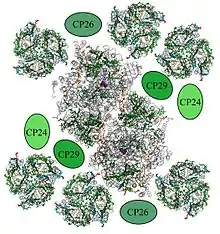
Ein PSII-Dimer ist von sechs Lichtsammelkomplex-II-Trimeren (LHCII) umgeben, sowie von den kleineren Chlorophyll-Proteinen CP24, CP26 und CP29. Diese sogenannten Lichtsammelantennen absorbieren über die enthaltenen Lichtsammelpigmente Energie und leiten diese an das PSII-Dimer weiter. Der Superkomplex wirkt dabei wie ein riesiger Trichter, der die gesamte absorbierte Energie auf die special pairs fokussiert.
Ablaufende Lichtreaktion
Die Gesamtbilanz der im PSII ablaufenden Reaktion lautet:
Für diese Reaktion müssen insgesamt vier Photonen absorbiert werden.
Mangan-Komplex
Am Mangan-Komplex findet die Oxidation des Wassers statt. Die genaue Struktur des Komplexes konnte noch nicht endgültig bestimmt werden, aber man weiß, dass es aus vier Mangan-, vier Sauerstoff- und einem Calcium-Atom besteht. Mangan besitzt die Fähigkeit viele verschiedene Oxidationsstufen annehmen zu können.[4] Dadurch kann der Komplex in vier Schritten oxidiert werden (durch Abgabe von Elektronen an das special pair) und schließlich zwei Moleküle Wasser zu Sauerstoff oxidieren und vier Protonen freisetzen. Durch die vier freigesetzten Protonen verringert sich der pH-Wert auf der Thylakoidlumen-Seite. Insgesamt wird also ein Protonengradient über die Thylakoidmembran erzeugt.
Literatur
- O. Sozer, M. Kis, Z. Gombos, B. Ughy: Proteins, glycerolipids and carotenoids in the functional photosystem II architecture. In: Front Biosci. Band 16, 2011, doi:10.2741/3710, PMID 21196193 (englisch).
- P. J. Nixon, F. Michoux, J. Yu, M. Boehm, J. Komenda: Recent advances in understanding the assembly and repair of photosystem II. In: Annals of Botany. Band 106, Nr. 1, 22. Juni 2010, S. 1–16, PMID 20328950.
Einzelnachweise
- A. W. Rutherford, P. Faller: Photosystem II: evolutionary perspectives. In: Philosophical transactions of the Royal Society of London. Series B, Biological sciences. Band 358, Nummer 1429, Januar 2003, ISSN 0962-8436, S. 245–253, doi:10.1098/rstb.2002.1186. PMID 12594932, PMC 1693113 (freier Volltext).
- B. Loll, J. Kern, W. Saenger, A. Zouni, J. Biesiadka: Towards complete cofactor arrangement in the 3.0 Å resolution structure of photosystem II. In: Nature. 438, 2005, S. 1040–1044.
- D. Voet, J. G. Voet, C. W. Pratt: Lehrbuch der Biochemie. Wiley-VCH, Weinheim 2002.
- B. Alberts, D. Bray, J. Lewis, M. Raff, K. Roberts, J. D. Watson: Molekularbiologie der Zelle. Garland Publishing, New York 2004.