NADP-abhängiges Malatenzym
Beim NADP+-abhängigen Malatenzym handelt es sich um ein in Tieren, Pilzen und Pflanzen vorkommendes Enzym, das eine wichtige Reaktion zur Bereitstellung von NADPH im Rahmen des Citrat-Shuttles katalysiert. Dabei wird Malat zu Pyruvat umgesetzt. Dieses mit je einer Isoform sowohl in Mitochondrien (ME3) als auch im Zytosol (ME1) vorhandene Enzym ist beim Menschen in allen Gewebetypen zu finden. Auch Pflanzen besitzen zwei Isoformen.[1][2]
| NADP-abhängiges Malatenzym | ||
|---|---|---|
| ||
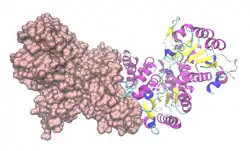
| Geteiltes Oberflächen-/Bändermodell des Dimer von ME1 (Mensch) nach PDB 2AW5 | ||
|
Vorhandene Strukturdaten: 2AW5 | ||
| Masse/Länge Primärstruktur | 572 Aminosäuren | |
| Kofaktor | Me2+ (Mn2+, Mg2+) | |
| Bezeichner | ||
| Gen-Name(n) | ME1, ME3 | |
| Externe IDs | ||
| Enzymklassifikation | ||
| EC, Kategorie | 1.1.1.40, Oxidoreduktase | |
| Reaktionsart | dehydrierende Decarboxylierung | |
| Substrat | Malat + NADP+ | |
| Produkte | Pyruvat + CO2 + NADPH | |
| Vorkommen | ||
| Übergeordnetes Taxon | Tiere, Pflanzen, Pilze, manche Bakterien[1] | |
Neben dem NADP+-abhängigen Malatenzym gibt es Malatenzyme, die mit NAD fungieren: zum einen das NAD-abhängige Malatenzym (Oxalacetat decarboxylierend), bei dem NAD+ reduziert wird (EC 1.1.1.38). Auch hier kann Oxalacetat als Substrat dienen. Zum anderen gibt es auch ein NAD-abhängiges Malat-Enzym, bei dem ebenfalls NAD+ reduziert wird (EC 1.1.1.39), aber Oxalacetat nicht umgesetzt werden kann. Malat-Enzyme sind nicht identisch mit der Malat-Dehydrogenase!
Katalysierte Reaktion
![]() + NADP+
+ NADP+ ![]() + NADPH + CO2
+ NADPH + CO2
L-Malat wird zu Pyruvat decarboxyliert, unter Generierung von einem NADPH aus einem NADP+. Oxalacetat wird ebenso als Substrat akzeptiert.
Generierung von NADPH
Neben den im Pentosephosphatweg vorkommenden Enzymen Glucose-6-phosphat-Dehydrogenase, 6-Phosphogluconat-Dehydrogenase und einer Form der Isocitrat-Dehydrogenase, sowie der Glutamatdehydrogenase ist das NADP+-abhängige Malatenzym für Tiere die einzige Möglichkeit, NADPH zu generieren.[3]
Literatur
- J. Rassow: Biochemie. 2. Auflage. Thieme 2008
- RL Pongratz, RG Kibbey, GI Shulman, GW Cline: Cytosolic and mitochondrial malic enzyme isoforms differentially control insulin secretion. In: J. Biol. Chem.. 282, Nr. 1, Januar 2007, S. 200–207. doi:10.1074/jbc.M602954200. PMID 17102138.
- O Vidal, L Varona, MA Oliver, JL Noguera, A Sànchez, M Amills: Malic enzyme 1 genotype is associated with backfat thickness and meat quality traits in pigs. In: Anim. Genet.. 37, Nr. 1, Februar 2006, S. 28–32. doi:10.1111/j.1365-2052.2005.01366.x. PMID 16441292.
- J Satterlee, RY Hsu: Duck liver malic enzyme: sequence of a tryptic peptide containing the cysteine residue labeled by the substrate analog bromopyruvate. In: Biochim. Biophys. Acta. 1079, Nr. 3, September 1991, S. 247–252. PMID 1911848.
Weblinks
Einzelnachweise
- PROSITE documentation PDOC00294. Malic enzymes. Swiss Institute of Bioinformatics (SIB), abgerufen am 14. August 2011 (englisch).
- UniProt P48163, UniProt Q16798
- David Nelson, Michael Cox: Lehninger Biochemie. Springer, Berlin; 4., vollst. überarb. u. erw. Auflage 2009; ISBN 978-3-540-68637-8, S. 1076.