Phosphoenolpyruvat-Carboxykinase
Phosphoenolpyruvat-Carboxykinase [GTP] (Abk.: PEPCK) heißt dasjenige Enzym, das die Umwandlung von Oxalacetat mittels GTP zu Phosphoenolpyruvat katalysiert. Dieser Reaktionsschritt ist der geschwindigkeitsbestimmende Teilschritt der Gluconeogenese. PEPCK kommt auch in Bakterien vor, in Wirbeltieren gibt es zwei Isoformen, zytosolisch und mitochondrial. Sie werden im Menschen von den Genen PCK1 und PCK2 codiert und besonders in Leber, Nieren und Adipozyten exprimiert. Im Gegensatz zu PEPCK-M kann die Aktivität der PEPCK-C durch Hormone reguliert werden. Mutationen in PCK1 oder PCK2 können die entsprechende (seltene) PEPCK-Mangelkrankheit verursachen.[1]
| Phosphoenolpyruvat-Carboxykinase 1 (zytosolisch) | ||
|---|---|---|
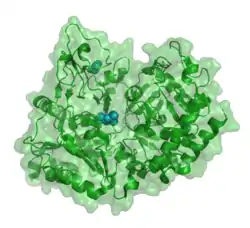 | ||
| Bänder-/Oberflächenmodell der PEPCK-C nach PDB 1KHF. Gebundenes PEP ist als Kalotte hervorgehoben. | ||
|
Vorhandene Strukturdaten: s. UniProt | ||
| Eigenschaften des menschlichen Proteins | ||
| Masse/Länge Primärstruktur | 622 Aminosäuren | |
| Kofaktor | Mangan | |
| Bezeichner | ||
| Gen-Name | PCK1 | |
| Externe IDs | ||
| Enzymklassifikation | ||
| EC, Kategorie | 4.1.1.32, Lyase | |
| Reaktionsart | Phosphorylierende Decarboxylierung | |
| Substrat | GTP + Oxalacetat | |
| Produkte | GDP + Phosphoenolpyruvat + CO2 | |
| Vorkommen | ||
| Homologie-Familie | PEPCK (GTP) | |
| Übergeordnetes Taxon | Lebewesen | |
| Ausnahmen | Pflanzen | |
| Orthologe | ||
| Mensch | Hausmaus | |
| Entrez | 5105 | 18534 |
| Ensembl | ENSMUSG00000027513 | |
| UniProt | P35558 | Q9Z2V4 |
| Refseq (mRNA) | NM_002591 | NM_011044 |
| Refseq (Protein) | NP_002582 | NP_035174 |
| Genlocus | Chr 20: 57.56 – 57.57 Mb | Chr 2: 173.15 – 173.16 Mb |
| PubMed-Suche | 5105 | 18534 |
| Phosphoenolpyruvat-Carboxykinase 2 (mitochondrial) | ||
|---|---|---|
| Eigenschaften des menschlichen Proteins | ||
| Masse/Länge Primärstruktur | 608 Aminosäuren | |
| Kofaktor | Mangan | |
| Bezeichner | ||
| Gen-Name | PCK2 | |
| Externe IDs | ||
| Orthologe | ||
| Mensch | Hausmaus | |
| Entrez | 5106 | 74551 |
| Ensembl | ENSG00000100889 | ENSMUSG00000040618 |
| UniProt | Q16822 | Q8BH04 |
| Refseq (mRNA) | NM_004563 | NM_028994 |
| Refseq (Protein) | NP_004554 | NP_083270 |
| Genlocus | Chr 14: 24.09 – 24.1 Mb | Chr 14: 55.54 – 55.55 Mb |
| PubMed-Suche | 5106 | 74551 |
Die PEPCK [GTP] ist nicht zu verwechseln mit der ATP-abhängigen PEPCK, die in Pflanzen und Bakterien, aber nicht in Tieren vorkommt.
Aufgrund ihrer zentralen Position in der Gluconeogenese ist die PEPCK ein Kandidat, wenn es um erblichen Diabetes oder Fettleibigkeit geht.[2]
Katalysierte Reaktion
GTP + 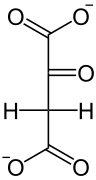 GDP +
GDP + 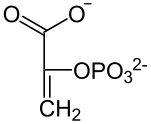 + CO2
+ CO2
Von GTP wird eine Phosphatgruppe auf Oxalacetat übertragen und Kohlenstoffdioxid abgespalten. Im Aktivzentrum des Enzyms befindet sich ein Arginin-Rest und das Metall Mangan der Oxidationsstufe +II. Der Ketosauerstoff bildet ein Komplex zwischen Arginin und Mn2+ und ermöglicht so die Abspaltung der Carboxygruppe am weiter entfernten Ende unter Ausbildung einer Doppelbindung. Anschließend wird ein Phosphat von GTP auf den Sauerstoff übertragen. Dabei sorgt gleichzeitig Mn2+ und Arginin auch für die Komplexierung von GTP im Enzym.[3]
Regulation
Die Aktivität der PEPCK-C, und damit die Gluconeogenese insgesamt, wird von einer Reihe von Hormonen beeinflusst. Glucagon fördert in der Leber durch die Phosphorylierung eines Transkriptionsfaktors die Transkription der PEPCK, genauso wie all-trans Retinsäure. Weitere regulierende Moleküle sind Leber-Lipide, Insulin (via SREBP-1c) und γ-Interferon.[4][5][6][7][8]
Für die Regulation durch Glucocorticoide siehe das ausführliche Beispiel dort.
Literatur
- Reynolds CH: Activation and inactivation of phosphoenolpyruvate carboxykinase by ferrous ions. In: Biochem. J.. 185, Nr. 2, Februar 1980, S. 451–4. PMID 7396825. PMC 1161372 (freier Volltext).
Weblinks
- Harris/reactome.org: oxaloacetate + GTP ⇒ phosphoenolpyruvate + GDP + CO2 [cytosol]
Einzelnachweise
- UniProt P35558, UniProt Q16822
- Beale EG, Harvey BJ, Forest C: PCK1 and PCK2 as candidate diabetes and obesity genes. In: Cell Biochem. Biophys.. 48, Nr. 2–3, 2007, S. 89–95. PMID 17709878.
- L. W. Tari: Structure and Mechanism of Phosphoenolpyruvate Carboxykinase. In: Journal of Biological Chemistry. 272, S. 8105–8108, doi:10.1074/jbc.272.13.8105.
- Christ B: Inhibition of glucagon-signaling and downstream actions by interleukin 1beta and tumor necrosis factor alpha in cultured primary rat hepatocytes. In: Horm. Metab. Res.. 40, Nr. 1, Januar 2008, S. 18–23. PMID 18335579.
- Cadoudal T, Glorian M, Massias A, Fouque F, Forest C, Benelli C: Retinoids upregulate phosphoenolpyruvate carboxykinase and glyceroneogenesis in human and rodent adipocytes. In: J. Nutr.. 138, Nr. 6, Juni 2008, S. 1004–9. PMID 18492826.
- Chen G: Liver lipid molecules induce PEPCK-C gene transcription and attenuate insulin action. In: Biochem. Biophys. Res. Commun.. 361, Nr. 3, September 2007, S. 805–10. doi:10.1016/j.bbrc.2007.07.108. PMID 17678617.
- Chakravarty K, Hanson RW: Insulin regulation of phosphoenolpyruvate carboxykinase-c gene transcription: the role of sterol regulatory element-binding protein 1c. In: Nutr. Rev.. 65, Nr. 6 Pt 2, Juni 2007, S. S47–56. doi:10.1111/j.1753-4887.2007.tb00328.x. PMID 17605314.
- Khazen W, Distel E, Collinet M, et al: Acute and selective inhibition of adipocyte glyceroneogenesis and cytosolic phosphoenolpyruvate carboxykinase by interferon gamma. In: Endocrinology. 148, Nr. 8, August 2007, S. 4007–14. doi:10.1210/en.2006-1760. PMID 17495004.