Salzpflanze
Salzpflanzen oder Halophyten (von altgriechisch ἅλς hals, „Salz“ und φυτόν phytón, „Pflanze“) bilden eine ökologisch abzugrenzende Gruppe unter den Höheren Pflanzen, die an erhöhte Gehalte von leicht löslichen Salzen an ihrem Standort angepasst sind und sich unter diesen Bedingungen fortpflanzen können.


Salzpflanzen besiedeln salzreiche Standorte weitgehend breitenunabhängig in trockenen bis überfluteten Lebensräumen, häufig in Meeresnähe und an Salzseen. Die noch wenig erforschten Mechanismen, mit deren Hilfe die Pflanzen sich an extreme Umweltbedingungen anpassen und photosynthetisch aktiv bleiben können, sind sehr vielfältig. Einige Salzpflanzen (die obligaten Halophyten) werden durch moderate Salzgehalte in ihrem Wachstum gefördert, andere Salzpflanzen benötigen kein Salz für ihre Lebenstätigkeit. Sie gedeihen wesentlich besser auf salzfreien Böden, nur sind sie dort der Konkurrenz anderer Pflanzen unterlegen.
Definitionen
Es gibt mehrere Definitionen des Begriffs Salzpflanze bzw. Halophyt. Ein Kriterium ist beispielsweise, dass die Pflanzen auf Salzboden mit mehr als 0,5 Prozent Salz im Bodentrockengewicht wachsen können. Dieser Wert ist zwar leicht zu bestimmen, wichtiger für die Pflanze ist aber die Salz- bzw. Ionenkonzentration im Bodenwasser. Die ebenfalls oft verwendete Definition von Jennings (1976) bezeichnet Halophyten als die natürliche Flora auf Salz-Standorten. Bereits Warming (1909), der den Begriff Halophyt erstmals definierte, schrieb: eine gewisse Menge an löslichen Salzen muss anwesend sein, bevor eine halophytische Vegetation entsteht; die Art des Salzes scheint von keiner Bedeutung zu sein. Mann et al. (1983) haben die Standorte wie folgt beschrieben: „[…] enthalten Salzwasser mit einem osmotischen Druck von über 3,3 bar“, was einer Konzentration von 70 mM monovalenter Salze entspricht.[1]
Pflanzen, die an Salzstandorten auch unter Ausschluss der Konkurrenz nicht überleben, werden im deutschsprachigen Raum oft Glykophyten genannt. Dieser Ausdruck wird vom Wort „Süßwasser“ abgeleitet und findet sich ausschließlich in der Deutschen Sprache. Passendere, jedoch seltener genutzte Bezeichnungen für denselben Begriff sind halophobe Pflanzen oder einfach Nicht-Halophyten.
Salztolerante Lebewesen werden generell als halophil bezeichnet, und zwar, wenn sie durch die evolutionär bedingte Salzresistenz nicht mehr fähig sind, in Abwesenheit von Salz zu existieren. Diese Salzresistenz hat sich mehrfach unabhängig entwickelt.[2] Daher sind Salzpflanzen auch keine monophyletische Verwandtschaftsgruppe, obwohl sie in einigen Pflanzengattungen und -familien gehäuft auftreten.
Unter den Höheren Pflanzen finden sich Halophyten nur unter den Angiospermen. Es gibt rund 1.500 bekannte Halophytenarten.[3] Familien mit zahlreichen Vertretern sind die Chenopodiaceae, Aizoaceae, Frankeniaceae, Plumbaginaceae und unter den Mangroven die Rhizophoraceae, Lythraceae, Avicennioideae innerhalb der Akanthusgewächse, Combretaceae und Myrsinaceae. Zudem gibt es Halophyten unter den Süß- und Sauergräsern sowie den Juncaceae.[4]
In Deutschland kommen 54 Halophyten vor. Dazu kommen noch einige Übergangsformen und Zwischenarten, die nur selten Halotoleranz ausbilden oder als Bastarde von litoralen (Ammophila arenaria) und binnenländischen (Calamagrostis epigeios) Arten aufgefasst werden. Die Existenz derartiger besonderer Litoralformen von sonst weitverbreiteten halophytischen oder sandbewohnenden Gräsern ist der beste Beweis dafür, dass diese bereits seit einer sehr langen Zeitepoche von ihrem gegenwärtigen Standort Besitz ergriffen haben müssen und hier die ihm entsprechenden Formen erzeugten.
Obligate Halophyten
Die obligaten Halophyten (obligatorisch = pflichtgemäß), auch Eu-Halophyten genannt, sind an ihre salzige Umgebung gebunden. Ohne eine bestimmte Konzentration von Salz als Lebensgrundlage wäre das Gedeihen und Keimen dieser Pflanzen nicht möglich, da sie sich an Extrembedingungen dieses Umweltfaktors weitgehend angepasst haben. Der Toleranzbereich der obligaten Halophyten gegenüber Salz ist dementsprechend sehr groß, so dass diese sogar bei ständiger Überflutung mit Meerwasser bestehen können. Die bekanntesten heimischen Gattungen sind Queller (Salicornia), Binsen (Juncus), Salzmelden (Suaeda) und Schlickgräser (Spartina).
Fakultative Halophyten

Die fakultativen Halophyten (fakultativ = wahlweise) haben die Fähigkeit, an Salzstandorten zu wachsen, sind aber nicht an diese gebunden. Vertreter, wie das Gänsefingerkraut (Potentilla anserina), die Strand-Aster (Aster tripolium), der Strand-Wegerich (Plantago maritima) und der Strand-Beifuß (Artemisia maritima) können durchaus auch in maritimen Gebieten auftreten. Ihr Optimum an Lebensfunktionen erreichen sie jedoch nur auf Böden, die überwiegend salzfrei sind oder nur einen leichten Salzgehalt aufweisen. Da sie in diesen Gebieten zunehmend auf die Konkurrenz anderer Pflanzen stoßen, sind diese Salzpflanzen häufig gegenüber den dort anzutreffenden Süßwasserpflanzen im Nachteil. Diese sind besser an ihr Milieu angepasst und vermehren sich schneller. Fakultative Halophyten weisen einen größer eingeschränkten Toleranzbereich gegenüber dem Salzgehalt des Bodens auf, als obligate Halophyten.
Indifferente Halophyten
So genannte standortindifferente Halophyten bilden eine Übergangsform zu den Süßwasserpflanzen und sind meist nur in salzfreien Gebieten zu finden. Ihr Toleranzbereich ist relativ gering, sie kommen aber noch mit Salzböden zurecht, die eine geringere Konzentration aufweisen. In diesen Fällen verändert sich der Habitus der entsprechenden Pflanze auf unterschiedlichste Weise und weicht vom Grunderscheinungsbild ab. Vertreter dieser Gruppe sind: Rotschwingel (Festuca rubra litoralis), Weißes Straußgras (Agrostis stolonifera), Kröten-Binse (Juncus bufonius), Kriechender Hahnenfuß (Ranunculus repens) und Mauerpfeffer (Sedum).
Einteilung nach Art der Einwirkung des Salzes
Salz kann auf verschiedensten Wegen auf die Pflanze einwirken, wonach sich Halophyten grundlegend als lufthalin (aerohalin), wasserhalin (hydrohalin) oder terrestrisch halin beschreiben lassen. Die beiden zuletzt genannten Kategorien greifen dabei ineinander, weshalb oft auch die zusammenfassende Bezeichnung hydroterrestrisch halin verwendet wird.
Lufthaline

Brechende Wellen und Gischt auf den Ozeanen führen durch einen Dispergierungsprozess (bulk to particle conversion) zur Freisetzung kleiner Tröpfchen (Sea spray) in der Luft. Wesentliche Anteile davon werden durch die Turbulenz der marinen Grenzschicht nach oben transportiert und können teilweise trocknen. Das durch solche Brandungszerstäubung entstehende Aerosol, welches zusammenfassend als Seesalzaerosol bezeichnet wird, wirkt sich infolge hoher Salzluftkonzentration auf Pflanzen in zum Meer nahe gelegenen und entfernten Gebieten aus. Viele lufthaline Arten sind zugleich wasserhalin, so dass sich zwischen beiden Kategorien eine engere Verbindung ergibt. Die im eigentlichen Sinne rein aerohalinen Arten leben als Übergang vom maritimen zum terrestrischen Bereich in abgelegener Umgebung zum Meer und nehmen Salz fast ausschließlich über die Blattoberfläche auf. So kann der Salzgehalt der Blätter an der Luvseite bis zu zehn Mal höher sein als bei Blättern derselben Pflanze im Windschatten. Der Gelbe Hornmohn (Glaucium flavum) ist etwa gegen Salzstaub und Spritzwasser unempfindlich, verträgt jedoch kein Salz im Boden.
In der Nähe von Verdunstungsbecken, also bestimmten Binnensalzseen, die regelmäßig in Dürreperioden austrocknen und eine Salzwüste hinterlassen (Desertifikation), finden sich ebenfalls zahlreiche Salzpflanzenarten. Das in der Luft vorhandene Salz ist auf solche Verdunstungsprozesse des Salzwassers zurückzuführen und wird von der dort lebenden Pflanzenwelt aus dem aeroben Umfeld aufgenommen.
Wasserhaline
Die maritimen Arten leben sowohl in näherer Umgebung von Salz- als auch von Brackwasser und finden sich von der Gezeitenzone über Flussmündungen hinein ins Landesinnere an Binnenlandsalzgewässern. Hydrohaline Pflanzen sind all jene Arten, die entweder vollkommen oder halbaquatil sind, also ihren Lebensmittelpunkt im oder in der Nähe vom Wasser haben. Ist der Boden trocken und sandig ausgebildet, im engeren Sinne an Stränden und Dünen, haben sich die dortigen arenicolen Halophyten meist mit einem weiteren, tieferen Wurzelsystem an ihr Umfeld angepasst. Auf schlickigem, oft überflutetem Untergrund, der eine direkte Wasseraufnahme gewährleistet, kommen hingegen eher Pflanzen mit kleineren, aber auch kräftigeren, nicht wegschwemmbaren Wurzeln auf. Einige geschlossene Pflanzenformationen haben sich offensichtlich auf verdünntes Meerwasser der Flussdeltas und auf Flussmündungen als Lebensraum spezialisiert, wohingegen andere in einer ausgeprägten Sandlückenflora an salzkonzentrierten Seen und Binnenmeeren wie dem Toten Meer leben. Dabei variiert der Salzgehalt thalassohaliner Standorte über einen weiten Bereich und kann dem des Meerwassers (3,5 %) bis zu dem Salzgehalt einer gesättigten Natriumchloridlösung (30 %) entsprechen. Die Übergangsformen zu den terrestrischen und aerohalinen Salzpflanzen bilden weiter vom Salzwasser abgelegene Vielfältigkeitsbereiche, welche sich oberhalb des bei Flut gewöhnlich erreichten Wasserspiegels auf normaler Erde oder Felsgeröll (vorzugsweise Sedum-Arten) angesiedelt haben und normalerweise nur von der salzigen Gischt erreicht werden.
Terrestrische Haline
Als terrestrische Haline bezeichnet man alle landlebenden Arten, die sich auf Binnensalzstellen spezialisiert haben. Sie nehmen Salz ausschließlich über den Boden auf. Zu den nicht am Strand vorkommenden Salzpflanzen gehören beispielsweise der Felsen-Beifuß (Artemisia rupestris), Schlitzblättriger Beifuß (Artemisia laciniata) oder das Land-Reitgras (Calamagrostis epigeios). Auch in Wüsten- und Steppenregionen auftretende Gewächse, wie Arten der Gattung Atriplex sind als solche vom Wasser abgelegene Formen aufzufassen, welche sich bevorzugt unter standortindifferenten Halophyten auffinden lassen.
Einteilung nach dem Salzgehalt des Bodens
Die Einordnung nach dem Salzgehalt im Boden wird durch Angaben in Promille (1 ‰ entspricht 1 g/L) stufenweise eingeschätzt. Da viele terrestrische Halophyten zugleich wasserhalin sind, trifft das Schema der Einteilung für beide Kategorien und gleichwohl auch in der Geologie und Bodenkunde zu.
- Oligohaline (griech. oligos – wenig) Pflanzen vertragen eine Salzkonzentration von 0,5 bis 5 ‰ und haben einen sehr geringen Toleranzbereich in Bezug auf Salz. Die meisten maritimen und terrestrischen Arten zählen in diese Ordnung.
- Mesohaline (griech. meso – mittig, mitten) nennt man Pflanzen, die sich in Bereichen mit 5 bis 18 ‰ Salzgehalt befinden. Gemeinschaften dieser ökologischen Gruppe findet man in der Nähe von Salzsümpfen oder Seen mittlerer Salzigkeit.
- Polyhaline (griech. poly – mehrere, viel) weisen einen Salzgehalt von bis zu 30 ‰ in ihrer Umgebung auf. Hierbei handelt es sich um Pflanzen, die an außergewöhnlich salzhaltigen Seen leben.
Wirkungen des Salzes auf die Pflanze
Die Wirkungen des Salzes werden auf drei Ebenen sichtbar. Bei Nichthalophyten führt dies zu Schädigungen, während die Halophyten durch unterschiedliche Mechanismen angepasst sind.
- Osmotische Effekte erschweren die Wasseraufnahme aus dem salzigen Medium (physiologische Trockenheit).
- Durch den Überschuss an Natrium kommt es zu einem Ionenungleichgewicht, da die lebensnotwendigen Ionen Kalium, Calcium und Stickstoff von nicht angepassten Pflanzen nicht mehr in ausreichenden Ausmaß aufgenommen werden können. Es kommt zu einem durch Natrium induzierten Kaliummangel.
- Salzionen haben auch spezifische Effekte auf verschiedene Stoffwechselbereiche. Beispiele sind die Hemmung des Proteinstoffwechsels, eine Erhöhung der Aktivität des Pentosephosphat-Zyklus und eine Verminderung der Glykolyse.
Unter den Bodensalzen weist Natriumchlorid die größte Toxizität und an den meisten Standorten auch den größten Anteil auf; darauf folgen, nach Stärke der Giftwirkung, Calciumchlorid, Magnesiumchlorid, Natrium- und Magnesiumsulfat.[5]
Standorte
Halophyten sind, abgesehen von den polaren Regionen der Arktis und Antarktis, auf allen Kontinenten verbreitet. Sie finden sich sowohl in europäischen Meeresregionen als auch in humiden, tropischen Regenwäldern oder ariden Salzsteppen, an Stränden abgelegener Inseln in Ozeanien, im alpinen Bereich von bis zu 3.100 Metern hoch gelegenen Salzseen und Salzquellen oder mitten in der Wüste (Sahara) auf natriumreichen Sanden. Wenngleich sie in allen nichtpolaren Klimazonen vertreten sind, bilden die tropischen und gemäßigten Breiten den Verbreitungsschwerpunkt.
Auf biogeografischer Ebene besitzt die Mehrheit der bekannten Arten ein räumlich eingeschränktes Verbreitungsgebiet. Weltweit verbreitete Pflanzen, so genannte Kosmopoliten, gibt es nur vereinzelt und ausschließlich unter obligaten Halophyten, wie beispielsweise der Salzbusch.
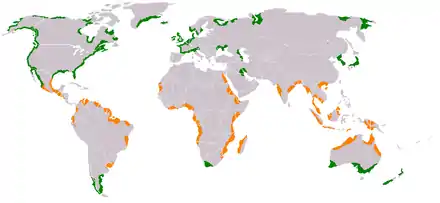
Grün: Salzwiesen
Orange: Mangrovenwälder
Primäre Standorte
Alle natürlichen und naturnahen Habitate Europas sind durch die Rarität einzelner Salzpflanzenarten geschützt. Diese natürlichen, nicht durch den Menschen geschaffenen oder verursachten Lebensräume heißen Primäre Standorte. Sie weisen meist eine große Populationsdichte auf. Die Artenvielfalt ist aufgrund des extremen Standortes oft relativ gering.
Die zwei wichtigsten küstennahen Lebensräume der Halophyten sind die Salzwiesen, die in gemäßigtem, und die Mangrovenwälder, die in tropischem und subtropischem Klima vorkommen. Fast alle Salzpflanzen sind, wenn auch teilweise xerophytisch austrocknungsresistent, zur ständigen Salzverdünnung auf eine lokale Wasserstelle angewiesen.
Lebensraum Salzwiese

In Uferbereichen der gemäßigten Klimazone finden sich an Flachküsten im Bereich der mittleren Hochwasserlinie schlickige Marschgebiete, die bei höheren Wasserständen überflutet werden. Solche salzigen Bereiche, Salzwiesen genannt, sind Lebensraum vieler Blütenpflanzen, die an diese extremen Verhältnisse angepasst sind. Die Besiedlung der Salzwiesen erfolgt in Abhängigkeit von der Höhe über dem mittleren Hochwasser und somit vom Salzgehalt und wird nach der Vegetation in verschiedene Zonen unterteilt.
In Deutschland sind die Salzwiesen großteils geschützt, etwa im Nationalpark Niedersächsisches Wattenmeer.
Lebensraum Mangrovenwald

Im Gezeitenbereich flacher, tropischer Küstenregionen findet sich das Ökosystem der immergrünen Mangroven. Besonders in den warmen Gebieten um den Äquator entwickeln sich z. T. mehr als 30 m hohe, artenarme Gezeitenwälder. Mangrovenbäume gehören zu den wenigen Gehölzen mit ausgeprägter Salzresistenz. Auffällig sind die oberirdischen Teile des Wurzelsystems vieler Mangrovenarten (z. B. Stelzwurzeln bei Rhizophoreae, Pneumatophoren bei Avicennia u. a.), die das unterirdische Wurzelsystem im anoxischen Sediment mit Sauerstoff versorgen und die Standfestigkeit der Bäume erhöhen. In welchem Maße die Ablagerung von Sedimenten im Bereich der Mangrovenwurzeln die Küstenlinie stabilisiert, ist strittig.
Weitere Standorte
In Mitteleuropa sind Salzstandorte im Binnenland recht selten. Bekannte Beispiele sind die Salzwiesen um das Kyffhäuser Gebirge in Thüringen, die Pannlake im Naturschutzgebiet Hollerland in Bremen, die Luchwiesen in Brandenburg oder die Salzlacken im Seewinkel östlich des Neusiedler Sees. Für das Auftreten von Salzstandorten abseits der Meeresküsten sind zwei Faktoren wichtig: Im Untergrund befinden sich Salzlagerstätten und zumindest in manchen Jahreszeiten ist die Verdunstung höher als der Niederschlag, so dass die Salze an die Bodenoberfläche gelangen und nicht ausgewaschen werden. Gerade an solchen Standorten treten nicht nur Natriumchlorid auf, sondern auch Magnesium, Carbonate und Sulfate.
Daneben finden sich Halophyten seltener im Gebirge, wobei im Fels eingeschlossene Salze oder hoch gelegene Salzquellen und -seen Grundlage für dieses etwas ungewöhnliche Habitat sind. Tagsüber bietet der oft steinige Untergrund eine Wärmeabsorption, so dass die Pflanzen in der Nacht nicht durch Kältetod sterben. Auch können an Steilküsten typische salztolerante Felsbesiedler wie Meerfenchel, Meersenf, Meer-Rübe und Strandflieder auftreten. Sie sind fähig, ihre Wurzeln tief im Gestein zu verankern, um bei Sturmflut nicht abgespült zu werden.
.jpg.webp)
Große Flächen nehmen Salzpflanzen in den trockenen (ariden) Gebieten der Erde ein, die zumindest so viel Niederschlag erhalten, dass sich mit dem aufgrund der Verdunstung aufsteigenden Bodenwasser die Salze an der Oberfläche konzentrieren können. Die Salzpflanzen trockener Standorte werden Xerohalophyten genannt. Im Folgenden sollen einige Gebiete mit xerophytischer Vegetation exemplarisch vorgestellt werden.
Im Ebro-Becken (Spanien) trifft das kontinentale Klima mit abflusslosen Salzseen zusammen. Auf den gipshaltigen Böden wachsen etliche endemische Gypsophyten, zum Beispiel Lygeum spartum. In Australien nimmt die Chenopodiaceen-Halbwüste (Saltbush) große Flächen im Süden des Kontinents ein. Auf den salzigen Böden (nur rund 0,1 % Chloride) wachsen Arten der Gattungen Atriplex und Maireana, während auf den Sandflächen Nicht-Halophyten (Akazien u. a.) wachsen. Die Maireana-Sträucher können bis 300 Jahre alt werden. In Iran, Afghanistan und weiten Bereichen Zentralasiens sind die Böden salzhaltig. In Zentral-Afghanistan kommen Halobiome noch in 3.100 Meter Seehöhe vor (Dasht-e-Nawor). Die inneriranischen Becken, die Kawire, sind vielfach extrem versalzt und absolut vegetationslos. In den Randbereichen treten typische, Chenopodiaceen-reiche Haloserien auf. In den zentralasiatischen Wüsten tritt Halophytenvegetation in feuchten Senken (Salzpfannen, Shory) und um Salzseen auf. Die am stärksten salzresistente Salzpflanze dieser Gebiete ist die polsterbildende Halocnemum strobilaceum (Chenopodiaceae). Für die Karakum-Wüste ist der halophytische Strauch Haloxylon persicum (Weißer Saxaul, Chenopodiaceae) die Charakterpflanze. Die Salzstandorte Zentralasiens reichen über das Kaspische Meer bis nach Europa. Im Norden der Halbinsel Krim befindet sich das Faule Meer (Sivash), das im Sommer austrocknet, und von wo Salz nach Norden geweht wird, wo es eine Sodaverbrackung (Solonzierung) des Bodens bewirkt. Die Salzböden Südrusslands werden Solontschake genannt. Im Great Basin in Nordamerika um den Großen Salzsee gibt es riesige Salzgebiete. Die wichtigste Art ist Atriplex confertifolia (englisch shadscale), die in den USA rund 150.000 km² bedeckt. Im Death Valley sowie im San Joaquin Valley in Kalifornien treten boraxreiche Salzstandorte auf, die besonders von Atriplex hymenelytra, Suaeda torreyana und Bassia-Arten besiedelt werden. In der südamerikanischen Pampa treten Salzpfanne auf, wie die Laguna La Picaza in der Provinz Santa Fe, deren Sodaverbrackung pH-Werte von 10 erreichen kann und wo besonders Distichlis-Rasen wachsen. In stärker ariden Gebieten tritt verstärkt Chlorid-Sulfat-Verbrackung auf, vor allem im westlichen Teil der Pampa.
Sekundäre Standorte
Neben den primären Standorten gibt es auf Bergwerks- und Industriegelände sowie entlang von Verkehrswegen sekundäre, anthropogene Salzstellen, also solche, die erst durch Einwirkung des Menschen entstanden sind. Die Pflanzenwelt solcher Habitate gehört zur Ruderalvegetation, da es sich um krautige Arten handelt, die zudem nicht land- oder forstwirtschaftlich genutzt werden. Wichtigster Standortsfaktor ist der erhöhte Salzgehalt, der durch verschiedene Handlungen, wie beispielsweise das Salzen der Straßen im Winter zustande kommt; mechanische Störungen spielen erst in zweiter Linie eine Rolle. Sekundäre Lebensräume stellen Inselhabitate für Halophyten und halobionte Tiere dar, so dass sie auch für die biogeographische Forschung von Bedeutung sind. Als besonders interessant hat sich das Studium der Besiedlung von Abraum- und Rückstandshalden der Kali-Industrie erwiesen, die man als „Inselberge“ der Kulturlandschaft einstufte. Dort fand man bislang im Binnenland seltene oder nicht beobachtete Arten, die vorher nur von primären Standorten bekannt waren. Bezogen auf die Populationsgrößen vieler bedrohter Halophyten fungieren die Sekundärstandorte inzwischen als wichtige Refugien.
Anpassungsstrategien
Salzpflanzen haben vielfältige Strategien entwickelt, um bei Salzbelastung wachsen zu können. Die „Fähigkeit einer Pflanze, ein Überangebot an Salzen in ihrem Substrat durch Salzregulation vom Protoplasma fernzuhalten oder eine erhöhte osmotische und ionentoxische Salzbelastung zu ertragen“, wird als Salzresistenz bezeichnet.[6] Resistenz ist somit der Oberbegriff, die beiden Unterbegriffe sind die Regulation und die Toleranz.
Salzresistenz äußert sich in morphologischen und physiologischen Anpassungen, die sich meist gegenseitig bedingen.
Abschirmung
Die Abschirmung (engl. exclusion) ist die Strategie, Salzionen gar nicht in die Pflanze aufzunehmen bzw. nicht in empfindliches (junges, wachsendes) Gewebe gelangen zu lassen.
Abschirmung in der Wurzel
Durch das Ausschlussprinzip, auch Salzfiltration genannt, wird bereits die Aufnahme von Salzionen über die Wurzel bedingt eingeschränkt. Wie bei allen Pflanzen wird die unkontrollierte apoplastische Wasseraufnahme der Mangrovengewächse durch den Casparischen Streifen verhindert. Die Ionenkanäle der Zellmembran sind jedoch wesentlich selektiver als die von Nicht-Halophyten, so dass fast kein Natrium und Chlorid, die wichtigen Ionen wie Kalium jedoch sehr wohl aufgenommen werden. Der Xylemsaft innerhalb der Wurzel ist im Gegensatz zum Boden salzarm. Beim im Randbereich von Mangrovenwäldern wachsenden Strauch Conocarpus erectus (Flügelsamengewächse) wurden im Xylemsaft der Zweige nur 17,6 mol m−3 Chlorid und 7,5 mol m−3 Natrium gemessen (im Vergleich zu 465 mol m−3 Chlorid und 362 mol m−3 Natrium im Meerwasser).[1]
Abschirmung im Spross
Bei manchen Arten, zum Beispiel beim Schmetterlingsblütler Prosopis fracta, ein Strauch arider Salzstandorte, werden besonders die Natrium-Ionen in basalen Pflanzenteilen wie Wurzel und Stamm zurückgehalten (sodium retention). Ähnliches gilt auch für das Andelgras (Puccinellia peisonis). Beim Gras Diplechna fusca werden Natrium- und Chlorid-Ionen in der Blattscheide zurückgehalten. Bei den Mangroven, bei denen sich aufgrund des Stammvolumens diese Strategie anbieten würde, konnte kein derartiger Mechanismus beobachtet werden.
Durch das Zurückhalten von Salzionen in basalen und auch älteren Pflanzenteilen wird der Ionengehalt in den jungen Sprossabschnitten und auch in den physiologisch aktiven Blättern niedrig gehalten.
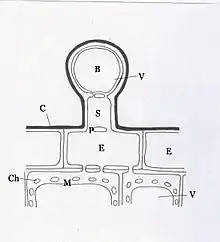
B = Blasenzelle, C = Cuticula,
Ch = Chloroplasten, E = Epidermiszellen,
M = Mesophyllzellen, P = Plasmodesmen,
S = Stielzelle, V = Vakuolen
Elimination
Als Elimination wird die Strategie bezeichnet, bereits in die Pflanze aufgenommene Salzionen wieder auszuscheiden. Es gibt hier die unterschiedlichsten Strategien. Die Ausscheidungsmechanismen bilden eine besonders wirksame, aber auch Energie verbrauchende Methode, aufgenommenes Salz direkt auszuscheiden und damit den Salzwert der Zelle nahezu konstant zu halten.
Absalzhaare
Absalzhaare oder auch Blasenhaare treten besonders häufig bei Gänsefußgewächsen (Chenopodiaceae) auf. Dies sind spezialisierte Haare (Trichome) auf der Blattoberfläche, in die aktiv Ionen transportiert werden. Die Haare sterben ab, platzen, die Ionen werden abgewaschen und somit aus der Pflanze entfernt. Blasenhaare sind meist zweizellig, sie bestehen aus einer nahezu vollständig mit dem Zellsaftraum der Vakuole ausgefüllten Blasenzelle, welche einer vesikel-, plasma-, mitochondrien- sowie chloroplastenreichen Stielzelle aufsitzt. Letztere verbindet durch zahlreiche Plasmodesmen die Blasenzelle mit dem unterhalb anliegenden Blattgewebe und nimmt gleichfalls eine sehr stoffwechselphysiologisch aktive Position ein, um den Natriumchloridtransport mit der darauf folgenden Akkumulation zu ermöglichen. Unter Energieverbrauch (ATP) werden gelöste Salze über die Stielzelle in die Vakuole der Blasenzelle transportiert und dort angesammelt. An einer Sollbruchstelle am Schaft knickt das Haar ab, wenn es genug Salz aufgenommen hat, und fällt zu Boden. Versagt dieser Mechanismus, platzt das Haar oder wird mit Ab- und Auswaschen durch den Niederschlag entfernt.
Manche Arten, wie Atriplex halimus oder die Portulak-Keilmelde (Halimione portulacoides) können mehr als 80 % der von ihnen aufgenommenen Ionen über die Blasenhaare ausscheiden.[1]
Absalzdrüsen
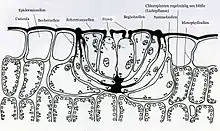
Viele Halophyten scheiden Salze durch spezielle Drüsen auf der Blattoberfläche aus. Im Gegensatz zur Exkretion und der Sekretion spricht man bei der Salzausscheidung von Rekretion, d. h. die Stoffe werden von der Pflanze in der Form ausgeschieden, wie sie aufgenommen wurden und sie erfüllen nach dem Ausscheiden keinen speziellen Zweck mehr.[1]
Die Salzdrüsen einzelner Halophyten zeigen sehr unterschiedliche Bau- und Funktionsmerkmale auf. Eine der einfachsten Formen findet sich bei der Gattung der Schlickgräser (Spartina). In deren Blättern und Halmen bestehen sie meist nur aus einer Poren durchsetzten Cuticula und einem Subcuticularraum mit darunter liegenden Basis- und Klappzellen.[2]

Beim Gewöhnlichen Strandflieder (Limonium vulgare), der einen sehr komplexen Aufbau der Salzdrüsen aufweist, vermutet man die Exozytose als zusätzliche Möglichkeit des Stofftransportes. So fusionieren die angesammelten Salzvesikel (Exosomen) mit der Membran der Rekretionszellen und treten durch Poren an die Oberfläche. Auf der Blattaußenseite können sich dadurch sichtbare Salzkristalle bilden. Ebenfalls verschieden ist die Anzahl und Verteilung der Salzdrüsen im Blatt. Während beim Strandflieder bis zu 3000 Drüsen pro cm² gezählt wurden, zeigt die Strand-Grasnelke (Armeria maritima) nur 590 Drüsen und das Milchkraut (Glaux maritima) etwa 800 Drüsen pro cm² auf.[7]
Ausgeschieden werden spezifisch Natrium- und Chlorid-Ionen, während Kalium in der Pflanze zurückbehalten wird, sodass das Kalium/Natrium-Verhältnis in der Pflanze hoch bleibt. Die durch die Drüsen ausgeschiedene Salzmenge kann sehr hohe Werte erreichen, so kann Diplachne fusca sogar die fünffache Menge der in der gleichen Zeit aufgenommenen Salzmenge ausscheiden, das Gras Spartina alternifolia immerhin rund die Hälfte. Die Mangrove Aegialitis annulata scheidet in jungen Blättern in 12 Stunden rund 38 % der im Blatt vorhandenen Salzmenge aus.[1] Der Energie-Bedarf für die Salzausscheidung ist erheblich. Bei Tamarix werden pro mol ausgeschiedenes Natriumchlorid rund 20 bis 24 mol ATP benötigt.[8]
Abwurf von Pflanzenteilen
Rosettenpflanzen reichern Salzionen bis zum Erreichen der Toxizitätsgrenze in Geweben der ältesten Blätter an. Bevor diese absterben, entzieht die Pflanze ihnen noch die wieder verwertbaren Nährstoffe (Stickstoff) und entsorgt sie dann mit dem gespeicherten Salz durch Abwurf. Die darauf folgenden jüngeren Blätter übernehmen die Funktion. Bekannte mitteleuropäische Vertreter sind Strandwegerich (Plantago maritima), Strand-Dreizack (Triglochin maritima) und die Strand-Aster (Aster tripolium).
Retranslokation
Unter Retranslokation versteht man den Rücktransport von Ionen aus den Blättern über das Phloem zurück in die Wurzeln, wo die Ionen wieder ins umgebende Medium abgegeben werden. Nachgewiesen wurde dieser Mechanismus etwa für das Süßgras Pappophorum pappiferum, das binnen 48 Stunden rund 35 % des im Spross vorhandenen Natriums über die Wurzeln ausscheiden kann. Auch für Mangroven wird dieser Mechanismus diskutiert, da die Blätter vieler Arten bei gleich bleibendem Salzgehalt bis zu 18 Monate alt werden.[1]
Sukkulenz

_02.jpg.webp)
Sukkulenz ist eine Strategie zur Verdünnung des aufgenommenen Salzes, sie tritt vor allem bei Chlorid-Halophyten auf. Dabei wird mit den Ionen auch Wasser aufgenommen und in den großen Vakuolen gespeichert. Dadurch wird eine zu hohe intrazelluläre Salzkonzentration verhindert. Je nach dem sukkulenten Organ unterscheidet man Blattsukkulenten wie Soden (Suaeda), Schuppenmieren (Spergularia) und einige Mangrovenarten, und Stammsukkulente wie den Queller. Besonders häufig tritt Sukkulenz bei den Gänsefußgewächsen auf. Bei den blattsukkulenten Mangroven Rhizophora mangle (Rhizophoragewächse), Laguncularia racemosa und Conocarpus erectus (beide Flügelsamengewächse) gibt es eine hohe Korrelation zwischen Chloridgehalt bezogen auf die Blattoberfläche und dem Wassergehalt bezogen auf die Blattoberfläche; diese Korrelation tritt nicht auf bei salzausscheidenden Mangroven.
Meist sind die Sukkulenten durch fleischige, aufgequollene Spross- und Wurzelteile gekennzeichnet, die durch mehrschichtige Speichergewebe zu Wasserspeicherorganen umgebildet wurden. Die Blätter, in denen Anzahl und Größe der Parenchymzellen erhöht sind, haben eine reduzierte Oberfläche und sind oft in den Stiel verjüngt, um die Transpiration einzuschränken. Alle Verdünnungsmechanismen bewirken mit der Ansammlung von Wasser eine Volumenvergrößerung des Lösungsraums und eine Verringerung der Salzionenkonzentration.[9]
Die Alternative zur Speicherung in der Zellvakuole bildet die Verteilung des überschüssigen Salzes im gesamten Pflanzenkörper, wodurch zunächst eine Verringerung der Salzkonzentration bewirkt wird. Beim einjährigen Queller oder der Salz-Binse ist der Vegetationszyklus bereits beendet, wenn die Salzkonzentration letal wird. Die salzüberlastete Pflanze färbt sich braun bis rot – ein generelles Stresssymptom – und stirbt schließlich ab.[7]
Intrazelluläre Kompartimentierung
Die unterschiedliche Verteilung der aufgenommenen Ionen auf verschiedene Zellbestandteile (Zellkompartimente) ist als Anpassungsmechanismus zwischen Regulation und Toleranz angesiedelt. Auch Pflanzen, die Salze speichern, können im Cytoplasma nicht beliebige Ionenkonzentrationen ertragen, da auch die meisten ihrer Enzyme salzempfindlich sind. Daher wird die Hauptmenge der Salzionen in der Vakuole eingeschlossen. Besonders auffällig ist dies bei den Sukkulenten mit ihren großen Vakuolen, die Kompartimentierung ist jedoch nicht auf die Sukkulenten beschränkt. Das Cytoplasma und die Chloroplasten enthalten somit nur eine relativ geringe Konzentration an Salzionen. Der Ionentransport in die Vakuolen erfolgt durch Membran-ATPasen. Der dadurch entstehende Unterschied im osmotischen Potential zwischen Vakuole und Cytoplasma wird durch compatible solutes (siehe unten) ausgeglichen.
Toleranz
Larcher definierte die Salztoleranz folgendermaßen: Salztoleranz ist die protoplasmatische Komponente der Resistenz, nämlich die Fähigkeit, die bei Salzstress auftretende Verschiebung im Ionenverhältnis und die mit der erhöhten Ionenkonzentration verbundenen toxischen und osmotischen Wirkungen je nach Pflanzenart, Gewebetyp und Vitalitätszustand mehr oder weniger gut zu tolerieren.[10] Diese Salztoleranz wird durch mehrere biochemische Mechanismen hervorgebracht.
Membranzusammensetzung
Salzpflanzen besitzen eine andere Zusammensetzung ihrer Zellmembranen. Ein höherer Anteil an gesättigten Fettsäuren verringert die Fluidität der Membranen und vermindert so den Austritt von Salzionen aus der Vakuole. Dies ist eine wichtige Voraussetzung zur Aufrechterhaltung der oben angesprochenen Kompartimentierung.
Ionenpumpmechanismen
Um die Kompartimentierung der Salzionen zu erreichen, benötigen die Salzpflanzen Transportmechanismen.
Die Akkumulation von Natrium- und Chloridionen in der Vakuole ist von einem pH-Gradienten abhängig, der durch die Tonoplasten-ATPase aufgebaut wird. Der pH-Gradient zwischen Cytoplasma und Vakuole ermöglicht sodann einen H+/Na+-Antiport, durch den das Natrium in die Vakuole gelangt. Diese H+/Na+-Antiporter werden zum Beispiel beim Strandwegerich (Plantago maritima) nur bei Salzstress gebildet, nicht jedoch, wenn Salz im Wuchsmedium fehlt.
Compatible Solutes
Durch die Akkumulation der anorganischen Salzionen in der Vakuole entsteht ein Konzentrationsunterschied zum Cytoplasma. Um dieses osmotische Potential auszugleichen, synthetisieren Salzpflanzen organische Verbindungen, die sie im Cytoplasma und in den Chloroplasten akkumulieren. Diese kompatiblen, das heißt für die Pflanze nicht toxischen, löslichen Osmotika werden kompatible Substanzen oder mit ihrer englischen Bezeichnung compatible solutes genannt. Die Konzentration der kompatiblen Substanzen ist dabei vom Ausmaß des Salzstresses abhängig.
Häufige kompatible Substanzen sind Aminosäuren (Prolin), quaternäre Ammonium-Verbindungen wie Glycinbetain, Zucker sowie azyklische (Sorbit, Mannit) und zyklische Zuckeralkohole (so genannte Cyclite, zum Beispiel Pinit). Zuckeralkohole treten besonders bei Mangroven auf. Manche marine Algen wie Dunaliella akkumulieren Glycerol, andere wie Chlorella Saccharose.
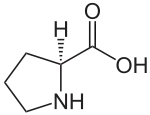 Prolin tritt häufig in Pflanzen unter Stress auf
Prolin tritt häufig in Pflanzen unter Stress auf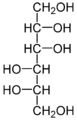 Mannit, ein Zuckeralkohol, der häufig in Mangroven als kompatible Substanz auftritt
Mannit, ein Zuckeralkohol, der häufig in Mangroven als kompatible Substanz auftritt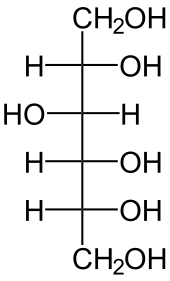 Sorbit kommt beispielsweise in Plantago maritima vor
Sorbit kommt beispielsweise in Plantago maritima vor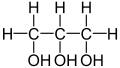 Die Alge Dunaliella akkumuliert unter Salzstress Glycerol
Die Alge Dunaliella akkumuliert unter Salzstress Glycerol
Dass kompatible Substanzen die Salztoleranz tatsächlich erhöhen, konnte anhand von transgenem Tabak gezeigt werden. Tabak ist normalerweise salzempfindlich. Durch gentechnischen Einbau des Gens für das Enzym Mannitol-1-Phosphat-Dehydrogenase akkumulierten die so veränderten Pflanzen Mannit und wuchsen dadurch unter Salzbelastung wesentlich besser als der Wildtyp.[11]
Einige Pflanzen speichern große Mengen organischer Substanzen in der Vakuole, um das für die Wasseraufnahme nötige osmotische Potential aufzubauen, und sind daher nicht auf die Aufnahme der Salzionen angewiesen. Zu diesen Substanzen zählen Oxalat, Malat, Aspartat (Asparat) und Saccharose. Insbesondere bei Strand-Beifuß, Schlickgras und Strandflieder fallen diese erhöhten Anteile organischer Stoffe auf.[9]
Photosynthesemechanismen
In manchen Pflanzen wird unter Salzstress der CAM-Weg der Photosynthese aktiviert. Dieser ermöglicht den Pflanzen die Photosynthese bei sehr geringer Wasserverdunstung. Dies vermindert die Wasseraufnahme durch die Pflanze aus dem Boden und damit auch die Salzaufnahme. Dadurch wird die Salzbelastung der Pflanze vermindert. Zu diesen fakultativen CAM-Pflanzen gehören Mesembryanthemum crystallinum, Mesembryanthemum nodiflorum, Aptenia cordifolia und Carpobrotus edulis.[8]
Der Strandwegerich (Plantago maritima) verfügt als C4-Pflanze ebenfalls über einen wassersparenden Photosynthesetyp.
| Anpassungsmechanismen bei Halophyten der deutschen Salzmarschen | ||||||
| Halophyten (Auswahl) | Anpassungsmechanismen | |||||
| Akkumulation | Sukkulenz | Blasenhaare | Blattabwurf | Salzdrüsen | Ausschluss | |
| Andel (Puccinellia maritima) | X | – | – | – | – | – |
| Dänisches Löffelkraut (Cochlearia danica) | X | X | – | X | - | - |
| Strand-Grasnelke (Armeria maritima) | – | X | – | X | X | X |
| Queller (Salicornia europaea) | X | X | – | – | – | ? |
| Salzbinse (Juncus gerardii) | X | – | – | X | – | - |
| Salzmelde (Atriplex halimus) | X | – | X | – | – | - |
| Schlickgras (Spartina) | X | – | – | - | X | X |
| Strandaster (Aster tripolium) | X | X | – | X | – | - |
| Strand-Beifuß (Artemisia maritima) | X | – | – | – | – | X |
| Stranddreizack (Triglochin maritima) | X | X | – | X | – | - |
| Strandflieder (Limonium) | X | – | – | - | X | X |
| Strandsode (Suaeda maritima) | X | X | – | – | – | - |
| Strandwegerich (Plantago maritima) | X | X | - | X | – | X |
Grün hervorgehoben: besonders starke Ausprägung
Funktionen und Nutzung
Halophyten wie der Queller oder die Sode gehören zu den Pionierpflanzen und können zur Sedimentation sowie zur Entstehung von Salzwiesen in Meeresregionen beitragen. Während die Wurzeln den Boden festhalten, sorgt der obere Teil der Pflanze für eine Beruhigung der Wasserbewegung. Das vom Meerwasser mitgeführte Salz und andere Sedimente lagern sich zwischen den Wurzeln und einzelnen Pflanzenteilen ab. Darauf sinken diese in den Boden ein. Eine langfristige Wiederholung dieses Vorgangs kann dazu führen, dass sich der Boden immer weiter anhebt und über den Wasserspiegel steigt. Solche Erhebungen bieten nun wiederum der weniger salzresistenten Flora eine Lebensgrundlage. Diese verlandungsfördernde Wirkung wird durch die Anlage von „Halophytenbeeten“ gelegentlich genutzt. Die wellen- und windberuhigende Wirkung eignet sich außerdem weltweit als natürlicher Puffer und Schutzfunktion gegen Sturmfluten und Tsunamis (Aufforstung des Mangrovenbestandes in Vietnam, Thailand und Indien).
Einen weiteren nützlichen Vorteil bildet die Verhinderung von Abrasion an Stränden und Küsten. Die weiten Wurzelausläufer einiger Pflanzen (zum Beispiel Gewöhnlicher Strandhafer (Ammophila arenaria), desgleichen Strandroggen (Elymus arenarius)) verankern sich über weite Strecken im Boden und festigen diesen. Damit wird präventiv eine Abtragung von Material durch das Wasser verhindert. An gefährdeten Inseln oder Buchten kann somit das Vordringen des Wassers verhindert oder sogar gestoppt werden.
Das staatliche Forschungszentrum Desert Research Center (DRC) in Kairo sucht nach Methoden, mit denen ägyptische Wüstengebiete nutzbar gemacht werden können. Die Maryout Experimental Station umfasst mit ungefähr vier Hektar die größte Versuchsstationen des DRC und untersucht seit 1968 das Verhalten von Tieren und Kulturpflanzen bei extremen Bedingungen. Erforscht wird hauptsächlich, wie gut Ziegen, Schafe, Kaninchen oder Kamele Futter aus Pflanzen vertragen, die auch bei hohen Salzkonzentrationen im Boden wachsen. Man testete bisher die Reaktionen der Nutztiere auf zwei Salzpflanzenarten als Nahrungsgrundlage, wobei Forscher das Wachstum, die Fruchtbarkeit und die Fleischqualität mit Versuchstieren normaler Futterverhältnisse verglichen. Atriplex halimus (Salzbusch) und Acacia saligna (Salzakazie) schränkten bei dem Experiment ausschließlich das Wachstum ein, was durch fettreiche Nahrung ausgeglichen werden kann. Sie dienen heute als Nahrungsquelle an besonders trockenen Orten. Halophyten werden auch zur Stabilisierung der Felder verwendet, ohne das Wachstum von Getreide einzuschränken. Inzwischen konnte durch den gemischten Anbau mit Salzpflanzen die nutzbare Fläche in Wüsten stark vergrößert werden.[12]
Viele Salzwiesenpflanzen finden auch Verwendung als Nahrungsmittel in den Küchen der nördlichen Länder. Essbare Salzpflanzen (wie zum Beispiel Strandwegerich, Queller als Meeresspargel oder Stranddreizack als Röhrkohl) verleihen Speisen einen delikaten, salzig bis pfeffrigen Geschmack, dienen dem Körper als natürliche Iodquelle.
Zudem nutzte man früher die beim Verbrennen von Halophyten entstandene Asche für verschiedenste Herstellungszweige, wie Glas und Seife, was aber aufgrund der zurückgehenden Artenbestände heute nicht mehr erlaubt ist.
Quellenangaben
- Marianne Popp: Salt Resistance in Herbaceous Halophytes and Mangroves. Progess in Botany, Volume 56, Springer Verlag Berlin 1995, S. 416–429.
- H. Bothe: Salzresistenz bei Pflanzen, 1976.
- Lexikon der Biologie. Band 7. Spektrum Akademischer Verlag, Heidelberg 2001, S. 33, ISBN 3-8274-0332-4-
- H. Walter, S.-W. Breckle: Ökologie der Erde. Band 1: Grundlagen. G. Fischer, Stuttgart, 2. Auflage 1991, S. 102–109, ISBN 3-437-20454-8.
- Karlheinz Kreeb: Pflanzen an Salzstandorten. Naturwissenschaften 61, 1974, S. 337–343
- Walter Larcher: Ökophysiologie der Pflanzen. Eugen Ulmer, Stuttgart, 4. Auflage 1995, S. 316.
- Christiane von den Berg: Lebensraum Salzwiese – Halophilie oder: pflanzliche Toleranzmechanismen gegen Salzstress, Bearbeitungsstand: Februar 2005 (Abgerufen: 9. April 2006).
- Dieter Schlee: Ökologische Biochemie. Gustav Fischer, Jena, Stuttgart 1992, S. 170–187, ISBN 3-334-60393-8.
- Universität Osnabrück: Pflanzen salzhaltiger Standorte (Halophyten) (Memento vom 27. November 2005 im Internet Archive) (Aufgerufen: 7. April 2006).
- Walter Larcher: Ökophysiologie der Pflanzen. Eugen Ulmer, Stuttgart, 4. Auflage 1995, S. 319.
- M.C. Tarczynski, R.G. Jensen, H.J. Bohnert (1993), Science 259, S. 508–510.
- Hilmar Liebsch; Michael Thekat: Salz – ein Problem für die Landwirtschaft In: Quarks Sendungsarchiv. Quarks&Co, Sendung: 23. August 2005 (Abgerufen: 21. April 2006).
Literatur
- Mitteleuropäische Salzvegetation
- Ernst Albert Arndt: Zwischen Düne und Meeresgrund. Tiere und Pflanzen des Ostseeraumes. Leipzig/Jena/Berlin 1969.
- A. Gerhardt: Pflanzen der Küste. Naturwissenschaften im Unterricht Biologie. Aulis, Köln 1982,5, S. 164–174. ISSN 0342-5487
- H. J. Janssen: Die Gefährdung des Wattenmeeres. BUND-Information. Bd. 20. Freiburg 1983.
- F. Jantzen: Pflanzen am Meer. Landbuch, Hannover 1968, 1978, 1987. ISBN 3-7842-0363-9
- B. P. Kremer: Pflanzen unserer Küsten. Stuttgart 1977, 1999. ISBN 3-440-07734-9
- Richard Pott: Farbatlas Nordseeküste und Nordseeinseln. Ulmer, Stuttgart 1995. ISBN 3-8001-3350-4 (gute, ausführlich bebilderte Beschreibung der Vegetation an der deutschen Nordsee)
- G. Quendens: Strand und Küste. BLV, München 1984, 1988.
- H. E. Reineck (Hrsg.): Das Watt. Kramer, Frankfurt 1978, 1982. ISBN 3-7829-1067-2
- M. Thies: Biologie des Wattenmeeres. Aulis, Köln 1985. ISBN 3-7614-0795-5
- Salzvegetation weltweit
- Georg Grabherr: Farbatlas Ökosysteme der Erde. Natürliche, naturnahe und künstliche Land-Ökosysteme aus geobotanischer Sicht. Ulmer, Stuttgart 1997. ISBN 3-8001-3489-6 (kurzer Überblick)
- Heinrich Walter, Siegmar-W. Breckle: Ökologie der Erde. 4 Bde. Gustav Fischer/Elsevier, Stuttgart/München 1991–2003. ISBN 3-437-20297-9 (ausführliche Beschreibung der Vegetation der Erde und ihrer Ökophysiologie, auch der Halophyten)
- Physiologie
- R. Albert: Halophyten. In: H. Kinzel: Pflanzenökologie und Mineralstoffwechsel. Ulmer, Stuttgart 1982, S. 33–204. ISBN 3-8001-3427-6
- R. Albert, G. Pfunder, G. Hertenberger u. a.: The physiotype approach to understanding halophytes and xerophytes. In: S.-W. Breckle, B. Schweizer, U. Arndt (Hrsg.): Ergebnisse weltweiter ökologischer Forschung. Heimbach, Stuttgart 2000, S. 69–87.
- W. Baumeister, W. Ernst: Mineralstoffwechsel und Pflanzenwachstum. Fischer, Stuttgart 1978. ISBN 3-437-30271-X
- Marianne Popp: Salt Resistance in Herbaceous Halophytes and Mangroves. In: Progress in Botany. Bd. 56. Springer, Berlin 56.1995, S. 416–429. ISSN 0340-4773
- I. A. Ungar: Ecophysiology of vascular halophytes. CRC Press, Boca Raton 1991. ISBN 0-8493-6217-2
- Y. Waisel: Biology of Halophytes. Physiological Ecology. Hrsg. v. T. T. Kozlowski. New York/ London 1972. ISBN 0-12-730850-4
Weblinks
- Halophyten in der Botanik (Memento vom 29. Dezember 2011 im Internet Archive) (Übersicht über weiterführende Weblinks)
- Lebensraum Salzwiese
- Liste von Halophyten
- Naturpark um das Kyffhäuser Gebirge (PDF-Datei; 4,94 MB)
- Deutsche Nationalparke im Wattenmeer der Nordsee