Aspartat-Aminotransferase
Aspartat-Aminotransferase (ASAT, AST), früher Serum-Glutamat-Oxalacetat-Transaminase (SGOT) oder Glutamat-Oxalacetat-Transaminase (GOT), heißen Enzyme, die die Umwandlung von α-Ketoglutarat in die Aminosäure Glutaminsäure katalysieren. Ohne diesen Reaktionsschritt wäre das Malat-Aspartat-Shuttle und damit die Verwertung von Kohlenhydraten im Stoffwechsel von Eukaryoten unmöglich. Außerdem ist die genannte Reaktion Teil des Abbaus mehrerer Aminosäuren, weshalb die ASAT in allen Lebewesen zu finden ist.
| Zytoplasmatische Aspartat-Aminotransferase | ||
|---|---|---|
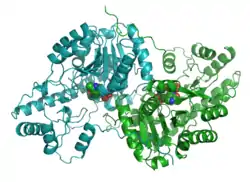 | ||
| Bändermodell des Dimers vom Wildschwein (Sus scrofa) nach PDB 1AJS. Pyridoxalphosphat-Moleküle (eines an Methylaspartat gebunden) sind als Kalotten dargestellt. | ||
| Eigenschaften des menschlichen Proteins | ||
| Masse/Länge Primärstruktur | 412 Aminosäuren | |
| Sekundär- bis Quartärstruktur | Homodimer | |
| Kofaktor | Pyridoxalphosphat | |
| Bezeichner | ||
| Gen-Name | GOT1 | |
| Externe IDs | ||
| Enzymklassifikation | ||
| EC, Kategorie | 2.6.1.1, Aminotransferase | |
| Reaktionsart | Transaminierung | |
| Substrat | L-Aspartat + α-Ketoglutarat | |
| Produkte | Oxalacetat + L-Glutamat | |
| Vorkommen | ||
| Homologie-Familie | ASAT | |
| Übergeordnetes Taxon | Lebewesen | |
Mit der Entwicklung der Eukaryoten wurde eine zweite Isoform der ASAT verfügbar. Man unterscheidet zytoplasmatische und mitochondriale ASAT (c-ASAT, m-ASAT), mit den entsprechenden Genen GOT1 und GOT2. Pflanzen haben eine weitere Form in den Chloroplasten. Der Mensch produziert ASAT vor allem in den Skelettmuskeln, Herzmuskeln und Leber. Das Verhältnis von c-ASAT/m-ASAT im Blutserum lässt auf den Zustand von Herz und Leber schließen.[1]
Katalysierte Reaktion
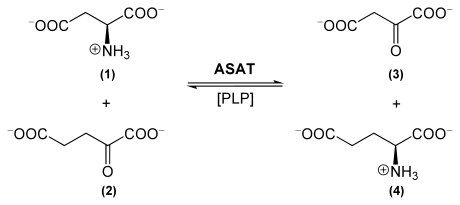
Die Aspartataminotransferase katalysiert allgemein die Übertragung der L-Aminogruppe einer Aminosäure auf eine α-Ketosäure. Dies erfolgt beispielsweise für die Reaktion L-Aspartat (1, siehe auch unterstehendes Schema) + α-Ketoglutarat (2) ⇔ Oxalacetat (3) + L-Glutamat (4). ASAT benötigt für ihre Funktion Pyridoxalphosphat (PLP, siehe auch Vitamin B6), welches als prosthetische Gruppe an das Enzym gebunden ist.
| Mitochondriale Aspartat-Aminotransferase | ||
|---|---|---|
| Eigenschaften des menschlichen Proteins | ||
| Masse/Länge Primärstruktur | 401 Aminosäuren | |
| Sekundär- bis Quartärstruktur | Homodimer | |
| Kofaktor | Pyridoxalphosphat | |
| Bezeichner | ||
| Gen-Name | GOT2 | |
| Externe IDs | ||
Labordiagnostik
In der Labordiagnostik wird die Aktivität der ASAT aus dem Plasma oder dem Serum bestimmt, um abzuklären, ob eine Leber- oder Gallenwegserkrankung vorliegt. Der Referenzbereich für Messungen bei 37 °C nach IFCC liegt bei < 52 U/l. (Einheiten pro Liter)
Erhöhte ASAT-Werte im Blut sind in der Regel Folge einer Leber- oder Skelettmuskelerkrankung bzw. eines Herzinfarktes. Steigt parallel zur ASAT auch die ALAT an, deutet das immer auf eine Schädigung von Leberzellen hin (siehe De-Ritis-Quotient). Da es auch in den roten Blutkörperchen ASAT gibt, findet man in hämolytischen Blutproben erhöhte ASAT-Werte. Diese Hämolyse kann auch in vitro durch unkorrekte Lagerung und langen Transport der Blutproben auftreten. Starke Erhöhungen findet man bei allen Hepatitiden sowie bei toxischen Leberschädigungen (z. B. durch Pilzgifte). Unter Therapie mit Antibiotika sind auch bei sonst Gesunden die ASAT-Werte oft erhöht. Nach Therapieende sinken die Spiegel wieder auf Normalwerte.
Siehe auch
Literatur
- Neumeister, Besenthal, Liebrich: Klinikleitfaden Labordiagnostik, München/Jena, Urban&Fischer, 2003 ISBN 3-437-22231-7.
- Lothar Thomas: Labor und Diagnose, Frankfurt/Main, TH-Books, 2005, ISBN 3-9805215-5-9.
Weblinks
Einzelnachweise
- M. Panteghini: Aspartate aminotransferase isoenzymes. Clin Biochem. 23/4/1990:311-9. PMID 2225456.