RuBisCO
Ribulose-1,5-bisphosphat-carboxylase/-oxygenase, bekannt auch unter der akronymartigen Abkürzung RuBisCO, ist ein für die Kohlenstoffdioxid-Fixierung beispielsweise in Pflanzen wichtiges Enzym. Es ist dafür verantwortlich, dass alle photosynthetisch aktiven Pflanzen und Bakterien Kohlenstoffdioxid aufnehmen können, weshalb es vermutlich das mengenmäßig häufigste Protein der Erde ist[1].
| RuBisCO | ||
|---|---|---|

| ||
| RuBisCO-Molekül PDB 1RCX und 9RUB | ||
|
Vorhandene Strukturdaten: 1RBL | ||
| Masse/Länge Primärstruktur | 477 AS; 52,7 kDa | |
| Sekundär- bis Quartärstruktur | Hetero-16-mer (8 große + 8 kleine UE) | |
| Kofaktor | Mg2+ | |
| Bezeichner | ||
| Externe IDs |
| |
| Enzymklassifikation | ||
| EC, Kategorie | 4.1.1.39, Lyase | |
| Substrat | D-Ribulose-1,5-Bisphosphat + CO2 + H2O | |
| Produkte | 2 3-Phospho-D-Glycerat + 2 H+ | |
Als einleitender Schritt im Calvin-Zyklus addiert RuBisCO ein Molekül Kohlenstoffdioxid (CO2) an Ribulose-1,5-bisphosphat. Die dabei entstehende Verbindung 2-Carboxy-3-keto-D-arabinitol-1,5-bisphosphat zerfällt unter Zugabe von H2O in zwei Phosphoglycerat-Moleküle, die weiter zu Kohlenhydraten aufgebaut werden. Die Energie für diese Reaktionen stammt in Form von ATP aus der Photosynthese, also vom Sonnenlicht, oder, wie im Fall einiger chemolithotrophen Bakterien, aus den Reaktionen der Chemosynthese (Chemotrophie).
Neben der CO2-Fixierung katalysiert RuBisCO als Nebenreaktion auch den Einbau von Sauerstoff (O2). Bei der Weiterverwertung des entstehenden Produkts geht Energie und ein Kohlenstoffatom als CO2 verloren, so dass dieser Prozess Photorespiration genannt wird. Bei allen Organismen, die eine oxygene Photosynthese betreiben, laufen beide Reaktionen gleichzeitig ab, wobei der Einbau von CO2 überwiegt. Einige Landpflanzen sind in der Lage, die Effizienz der RuBisCO durch Trennung von Stoffwechselwegen zu steigern: C4-Pflanzen durch räumliche Trennung, CAM-Pflanzen durch zeitliche Trennung. Die meisten Algen und die Hornmoose bilden Pyrenoide, in denen ebenfalls lokal Kohlendioxid angereichert wird. Die Aktivität von RuBisCO ist vom Licht abhängig. RuBisCO muss vor der enzymatischen Aktivität durch eine lichtabhängige Aktivase aktiviert werden.
Es wurde von Samuel Goodnow Wildman entdeckt.
Aufbau
RuBisCO besteht in Pflanzen, Algen und Cyanobakterien aus 16 Untereinheiten. Hierbei liegen acht sogenannte große Untereinheiten (LSU oder „L“, ca. 51.000–58.000 Da) und ebenso acht kleine Untereinheiten (SSU oder „S“, ca. 18.000 Da) als Hexadecamer vor. In Pflanzen wird RuBisCO in den Chloroplasten der Zelle assembliert. Eine Besonderheit ist, dass die acht identischen großen Untereinheiten im Chloroplastengenom und die acht identischen kleinen Untereinheiten des Enzyms im Zellkerngenom kodiert sind. Bei der Ackerschmalwand (Arabidopsis thaliana) ist das Gen für die lange Kette 1.440 Basenpaare lang und resultiert nach Transkription, Translation und posttranslationaler Modifikation in dem 477 Aminosäuren enthaltenden Protein. Die kurzen Ketten bestehen bei Arabidopsis aus 126 Aminosäuren.[2][3]
Die Quartärstruktur der häufigsten Form des Enzyms (Typ I, s. Abschnitt Orthologe Formen) ist (L2)4(S4)2,[4] wobei das katalytische Zentrum von je einem Paar der großen Untereinheiten gebildet wird; jedes von diesen bindet eines der Produktmoleküle 3-Phosphoglycerat (3-PG; vergl. Calvinzyklus). Die kleinen Untereinheiten halten den Komplex zusammen, sind aber für die katalytische Funktion entbehrlich. Vermutlich erhöhen sie auch die Spezifität des zylinderförmigen Holoenzyms.
Katalysierte Reaktionen
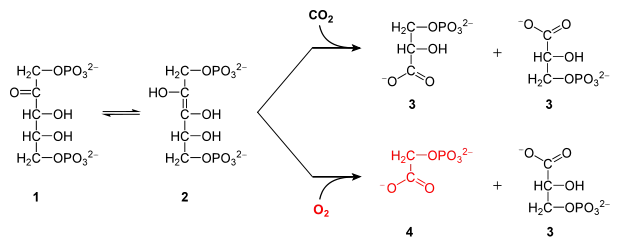
Als Kofaktor von RuBisCO agiert Magnesium. In der Dunkelreaktion (Calvin-Zyklus) wird ein Molekül Ribulose-1,5-bisphosphat (1) mit Kohlenstoffdioxid zu zwei Molekülen 3-D-Phosphoglycerat (3) umgesetzt. Ribulose-1,5-bisphosphat steht dabei durch eine Keto-Enol-Tautomerie mit seiner Endiolform (2) im Gleichgewicht, an die CO2 kondensiert. Nach erfolgter Reaktion befindet sich das Kohlenstoffatom des Kohlenstoffdioxids nun innerhalb des pflanzlichen Stoffwechsels (Kohlenstoffdioxid-Fixierung).
Alternativ akzeptiert RuBisCO auch Sauerstoff. Bei der Fixierung von Sauerstoff fällt stattdessen ein Molekül 2-Phosphoglycolat an (4), das in größeren Mengen giftig wirkt und daher über die Photorespiration entsorgt werden muss.
Landpflanzen fixieren weltweit jährlich schätzungsweise 120 Gigatonnen Kohlenstoff aus CO2. Dies ist etwa ein Sechstel des gesamten atmosphärischen CO2 und entspricht ca. dem 17- bis 20-fachen der jährlich durch anthropogene Aktivitäten in die Atmosphäre freigesetzten CO2-Menge. Davon bleiben derzeit jährlich etwa 1–2 Gigatonnen Kohlenstoff durch Akkumulation von Biomasse und von organischer Substanz im Boden netto in den terrestrischen Ökosystemen gespeichert. Der Rest wird durch autotrophe und heterotrophe Atmung wieder in die Atmosphäre abgegeben.[5] Zur Fixierung sind 0,2 % des auf der Erde vorkommenden Gesamtproteins erforderlich (auf jeden Erdenbürger entfallen, gleichmäßig verteilt, 10 kg RuBisCO).
Mit einer Wechselzahl von 17/s (in der lebenden Zelle: 3/s) und der verlustreichen Nebenreaktion der Photorespiration erscheint die RuBisCO widersinnigerweise als eines der am schlechtesten optimierten (oder meist verkannten) Enzyme. Daher hat es nicht an Versuchen gefehlt, seine Eigenschaften auf dem Wege der Gentechnologie zu verändern, um theoretische Ertragssteigerungen von bis zu 100 % zu erzielen.[6]
Allerdings zeigten diese Versuche bald, dass jede Erhöhung der Wechselzahl zu Lasten der Spezifität ging: Das Enzym konnte schlechter zwischen Sauerstoff und Kohlenstoffdioxid unterscheiden, was die Photorespiration begünstigte. Umgekehrt führte eine verbesserte Spezifität zu einer geringeren Wechselzahl, und damit zu einer geringeren Produktivität. Es scheint, dass RuBisCO einer jeweiligen Spezies trotz seiner oben erwähnten Nachteile nahezu vollständig an den vorliegenden Umweltbedingungen (Konzentration an O2 und CO2, Temperatur) optimiert ist.[7]
Regulation
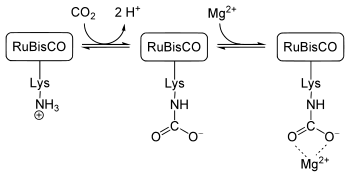
RuBisCO wird durch eine Carbamatylierung eines L-Lysins reguliert. Dieses Lysin ist an Position 201 der großen Untereinheit lokalisiert. Ein Kohlenstoffdioxidmolekül reagiert hierbei mit der ε-Aminogruppe des Lysins zu einem Carbamat (vgl. Bild mitte). RuBisCO ist aber erst dann aktiv, wenn jenes Lysin als Carbamat vorliegt und zudem ein Magnesiumion an dieses Carbamat bindet (vgl. Bild rechts). Dies bewirkt eine Konformationsänderung (das Magnesiumion stabilisiert diese), in dessen Folge die große Untereinheit enzymatisch aktiv werden kann.
Das Kohlenstoffdioxidmolekül, das mit der ε-Aminogruppe des Lysins zu einem Carbamat reagiert, hat nichts mit dem CO2-Molekül zu tun, das enzymatisch in der Carboxylasereaktion (siehe weiter oben) umgesetzt wird.
Orthologe Formen
Es wurden vier verschiedene RuBisCO-Formen in der Natur identifiziert, die unterschiedliche Tertiärstrukturen und kinetische Charakteristika aufweisen:[8]
- Alle grünen Pflanzen, Algen und Cyanobakterien besitzen eine RuBisCO des Typs I
- In manchen photosynthetisch aktiven Proteobakterien, chemoautotrophen Bakterien und Dinoflagellaten wurde eine Form RuBisCO des Typs II entdeckt. Auch Methanococcoides burtonii, ein Archaeon, weist eine RuBisCO des Typs II auf. Sie hat keine kleinen Untereinheiten und bildet ein Dimer. Darüber hinaus hat sie eine höhere Wechselzahl als Typ I-RuBisCO, ist aber weniger spezifisch gegenüber dem Einbau von Sauerstoff.
- Die RuBisCO des Typs III findet man in Archaeen. Ihre Tertiärstruktur entspricht weitestgehend Typ I bzw. Typ II, es wurden aber auch Besonderheiten identifiziert. So besitzt die RuBisCO aus Thermococcus kodakaraensis eine neuartige, ringförmige Struktur aus fünf großen Untereinheiten. Typ III-Enzyme sind häufig an hohe Temperaturen angepasst und weisen hohe Wechselzahlen auf. Lange Zeit war es ein Rätsel, warum jene Archaeen zwar ein Typ III-RuBisCO-Enzym, aber keine Ribulose-5-phosphat-Kinase kodieren. Letztere katalysiert die Bildung von Ru-1,5-bP und ist damit ein Schlüsselenzym des Calvin-Zyklus. Es wird jedoch postuliert, dass Archaeen auf anderen Wegen Ru-1,5-bP synthetisieren können, beispielsweise aus 5-Phosphoribosyl-1-pyrophosphat.[9][10]
- Es gibt noch ein sogenanntes „RuBisCO-ähnliches Enzym“, das aber nicht die Fixierung von Kohlenstoffdioxid katalysiert und damit kein bona fide RuBisCO darstellt. Es ist am Methioninstoffwechsel (Methionin-Salvage-Weg) involviert.[11] Beispielsweise hat das hyperthermophile Archaeon Archaeoglobus fulgidus ein „RuBisCO-ähnliches Enzym“.
Literatur
- Hans W. Heldt und Birgit Piechulla: Pflanzenbiochemie. Spektrum Akademischer Verlag GmbH, 4. Auflage 2008; ISBN 978-3-8274-1961-3; S. 161ff.
- Caroline Bowsher, Martin Steer und Alyson Tobin: Plant Biochemistry. Garland Pub 2008; ISBN 978-0-8153-4121-5; S. 97ff.
- Tabita, FR. et al. (2008): Distinct form I, II, III, and IV RuBisCO proteins from the three kingdoms of life provide clues about RuBisCO evolution and structure/function relationships. In: J Exp Bot. 59(7); 1515–1524; PMID 18281717; PDF (freier Volltextzugriff, engl.)
- Tabita FR. et al. (2008): Phylogenetic and evolutionary relationships of RuBisCO and the RuBisCO-like proteins and the functional lessons provided by diverse molecular forms. In: Philos Trans R Soc Lond B Biol Sci. 363(1504); 2629–2740; PMID 18487131; PMC 2606765 (freier Volltext)
Einzelnachweise
- Bruce Alberts, Alexander Johnson, Julian Lewis, Martin Raff, Keith Roberts, and Peter Walter: NCBI Books: Molecular Biology of the Cell, 4th edition. New York: Garland Science; 2002., abgerufen am 4. März 2021.
- UniProt-Eintrag O03042
- GermOnline-Eintrag
- Tabita, F.R., Hanson, T.E., Li, H., Satagopan, S., Singh, J. and Tabita, S.C. (2007) Function, structure, and evolution of the RuBisCO-like proteins and their RuBisCO homologs. In: Microbiol Mol Biol Rev, 71(4), 576–599; PMID 18063718; PMC 2168653 (freier Volltext)
- Prentice, I.C., G.D. Farquhar, M.J.R. Fasham, M.L. Goulden, M. Heimann, V.J. Jaramillo, H.S. Kheshgi, C. Le Quéré, R.J. Scholes, D.W.R. Wallace (2001). The Carbon Cycle and Atmospheric Carbon Dioxide. In: Climate Change 2001: The Scientific Basis. Contribution of Working Group I to the Third Assessment Report of the Intergovernmental Panel on Climate Change [Houghton, J.T.,Y. Ding, D.J. Griggs, M. Noguer, P.J. van der Linden, X. Dai, K. Maskell, and C.A. Johnson (eds.)]. Cambridge University Press, Cambridge, United Kingdom and New York, NY, USA, 881pp.
- Turbo für Biokraftstoff, Artikel in Chemie-Online vom 18. Juni 2007
- Tcherkez, G.G. et al. (2006): Despite slow catalysis and confused substrate specificity, all ribulose bisphosphate carboxylases may be nearly perfectly optimized. In: Proc. Natl. Acad. Sci. Bd. 103, S. 7246–7251. PMID 16641091; PDF (freier Volltextzugriff, engl.)
- Mueller-Cajar, O. und Badger, MR. (2007): New roads lead to RuBisCO in archaebacteria. In: Bioessays 29(8); 722–724; PMID 17621634; doi:10.1002/bies.20616
- Sato, T. et al. (2007): Archaeal type III RuBisCOs function in a pathway for AMP metabolism. In: Science 315(5814); 1003–1006; PMID 17303759; doi:10.1126/science.1135999
- Finn, MW. und Tabita, FR. (2004): Modified pathway to synthesize ribulose 1,5-bisphosphate in methanogenic archaea. In: J Bacteriol. 186(19); 6360–6366; PMID 15375115; PDF (freier Volltextzugriff, engl.)
- Ashida H. et al. (2003): A functional link between RuBisCO-like protein of Bacillus and photosynthetic RuBisCO. In: Science 302(5643); 286–290; PMID 14551435; doi:10.1126/science.1086997