Glycolaldehyd
Glycolaldehyd ist die einfachste Verbindung der Gruppe der Hydroxyaldehyde. Er verfügt über eine Aldehyd- und eine Hydroxygruppe. Somit kann man ihn formal den Kohlenhydraten zuordnen (Aldodiose).
| Strukturformel | ||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
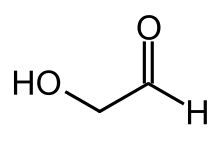 | ||||||||||||||||
| Allgemeines | ||||||||||||||||
| Name | Glycolaldehyd | |||||||||||||||
| Andere Namen |
| |||||||||||||||
| Summenformel | C2H4O2 | |||||||||||||||
| Kurzbeschreibung |
farblose sirupöse Flüssigkeit von süßlichem Geschmack[1] | |||||||||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||||||||
| ||||||||||||||||
| Eigenschaften | ||||||||||||||||
| Molare Masse | 60,05 g·mol−1 | |||||||||||||||
| Aggregatzustand |
flüssig | |||||||||||||||
| Dichte | ||||||||||||||||
| Siedepunkt |
96–97 °C[1] | |||||||||||||||
| Löslichkeit |
löslich in Chloroform[3] | |||||||||||||||
| Brechungsindex |
1,4772 (20 °C)[3] | |||||||||||||||
| Sicherheitshinweise | ||||||||||||||||
| ||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. Brechungsindex: Na-D-Linie, 20 °C | ||||||||||||||||
Vorkommen
Glycolaldehyd entsteht beim Abbau von Ethylenglycol im menschlichen Körper. Weiterhin wurde Glycolaldehyd im Weltraum nachgewiesen, unter anderem im Sternsystem IRAS 16293–2422.[5] Es wird durch die Formose-Reaktion aus Formaldehyd gebildet und kann deshalb schon in der präbiotischen Phase der Evolution entstanden sein.
Gewinnung und Darstellung
Es existiert eine Vielzahl an Wegen, um Glycolaldehyd darzustellen, beispielsweise durch vorsichtiges Oxidieren von Ethylenglycol mittels Wasserstoffperoxid in Gegenwart von Eisen(II)-sulfat.[6]
Durch katalytische Umpolung von Formaldehyd lässt sich Glycolaldehyd aus einem C1-Baustein herstellen. Diese Reaktion ist von Bedeutung, um die C1-Rohstoffbasis (Erdgas, Kohle, Methanhydrat aus der Tiefsee) für Synthesen nutzbar zu machen.[7]
Eigenschaften
Glycolaldehyd neigt zur Dimerisierung zu 2,5-Dihydroxy-1,4-dioxan[8] (Smp.: 96 °C, in Wasser leicht löslich[1]). Es reagiert weiterhin mit Propenal zu Ribose, einem essenziellen Bestandteil der Ribonukleinsäure, und gilt damit als Vorstufe zum Ursprung des Lebens.
Verwendung
Glycolaldehyd wird zur Herstellung von Polymeren, die freie Hydroxygruppen enthalten sowie als Zwischenprodukt für verschiedene Ester und Aminoalkohole verwendet.
Weblinks
- Biological Magnetic Resonance Data Bank: Glycolaldehyde
Einzelnachweise
- Eintrag zu Glycolaldehyd. In: Römpp Online. Georg Thieme Verlag, abgerufen am 7. Februar 2019.
- David R. Lide (Hrsg.): CRC Handbook of Chemistry and Physics. 90. Auflage. (Internet-Version: 2010), CRC Press/Taylor and Francis, Boca Raton, FL, Physical Constants of Organic Compounds, S. 3-270.
- David R. Lide: CRC Handbook of Chemistry and Physics A Ready-reference Book of Chemical and Physical Data. CRC Press, 1995, ISBN 978-0-8493-0595-5, S. 296 (eingeschränkte Vorschau in der Google-Buchsuche).
- Datenblatt Glycolaldehyde dimer, crystalline, mixture of stereoisomers. Melts between 80 and 90 °C depending on stereoisomeric composition bei Sigma-Aldrich, abgerufen am 23. Februar 2019 (PDF).
- Verwandter einer Aminosäure im All entdeckt. Max-Planck-Wissenschaftler finden Aminoacetonitril nahe dem galaktischen Zentrum (Pressemitteilung vom 26. März 2008).
- Hans Peter Latscha, Uli Kazmaier und Helmut Alfons Klein: Organische Chemie: Chemie-Basiswissen II. Springer, Berlin; 6., vollständig überarbeitete Auflage 2008, ISBN 978-3-540-77106-7, S. 217.
- Patentanmeldung DE4212264A1: Verfahren zur katalytischen Herstellung von Kondensationsprodukten des Formaldehyds. Angemeldet am 11. April 1992, veröffentlicht am 14. Oktober 1993, Anmelder: BASF, Erfinder: Eugen Gehrer, Wolfgang Harder, Klaus Ebel.
- Externe Identifikatoren von bzw. Datenbank-Links zu 1,4-Dioxan-2,5-diol: CAS-Nummer: 23147-58-2, EG-Nummer: 607-202-3, ECHA-InfoCard: 100.108.667, PubChem: 186078, ChemSpider: 161748, Wikidata: Q72472673.