Triterpene
Triterpene sind Naturstoffe, die aus drei Terpeneinheiten, also insgesamt sechs Isopreneinheiten mit zusammen 30 Kohlenstoffatomen, aufgebaut sind. In Einzelfällen kann die Anzahl der Kohlenstoffatome bei oxidierten Vertretern davon abweichen, Beispiele hierfür sind (+)-Azadiron oder Limonin.[1]
Einteilung der Triterpene
Gruppierung nach Anzahl der Ringe
Die meisten Verbindungen, die den Triterpenen zugeordnet werden, besitzen 30 Kohlenstoffatome. Dennoch gibt es über 4000 Verbindungen[1], die in diese Stoffgruppe eingeordnet werden. Unterschieden werden sie grundsätzlich in der Anzahl der Cyclen innerhalb der Verbindung.
| Klassifizierung der Triterpene | ||||
|---|---|---|---|---|
| Anzahl der Ringe |
Trivialname eines Vertreters |
Strukturformel | ||
| 0 | Squalen | 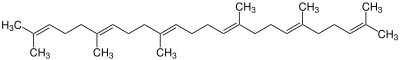 | ||
| 1 | Achilleol A[2][3] | 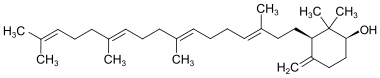 | ||
| 2 | Polypodatetraen[4] | 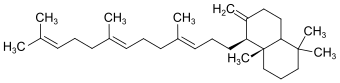 | ||
| 3 | Malabarican[5] | 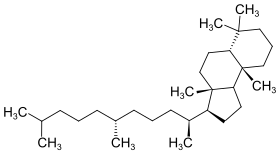 | ||
| 4 | Lanosterin | 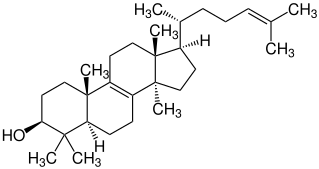 | ||
| 5 | Betulin | 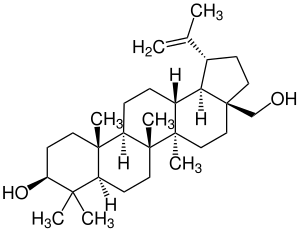 | ||
Triterpene, die kein Ringsystem besitzen, werden als lineare Triterpene bezeichnet; besitzen sie einen Ring, werden die Verbindungen den monozyklischen Triterpenen zugeordnet und mit 2,3, 4 bzw. 5 Ringen analog den bicyclischen, tricyclischen, tetracyclischen bzw. pentacyclischen Triterpenen.
Zuordnung ausgewählter Vertreter
Einzelne Triterpene werden meist noch genauer zugeordnet als nur über die Anzahl der Ringe im Molekül. In vielen Vertretern dieser Stoffgruppe können sehr ähnliche Strukturen wiedergefunden werden. Die Rede ist hier häufig vom Grundgerüst bzw. vom Skelett der Moleküle. Bei den Triterpenen tauchen insbesondere drei Grundgerüste häufig auf. Diese sind das Steran-, das Baccharan- und das Hopangerüst.
Lineare Triterpene
Die einfachsten Triterpene sind Squalan und Squalen. Sie dienen als Grundgerüst der tetracyclischen und pentacyclischen Triterpene, die hauptsächlich durch Biosynthese hergestellt werden. Ein charakteristischer Schritt ist die sogenannte Faltung des Squalens. Hierdurch entstehen die verschiedenen Grundgerüste, wie beispielsweise das Gonan-, das Baccharan- oder das Hopan-Gerüst. Insgesamt sind über 200 verschiedene Gerüste bereits bekannt.[6] Ausgehend von diesen Gerüsten können allerdings durch weitere Reaktionsschritte viele verschiedene Produkte entstehen.[1]
.svg.png.webp)
In Bezug auf die Isoprenregel bieten die Triterpene ebenfalls einige Unregelmäßigkeiten. So erfüllen einfache Verbindungen häufig die Isoprenregel. Beispiele hierfür sind Squalan und Squalen. Verbindungen dessen Biosynthese aus vielen verschiedenen Reaktionsschritten bestehen, erfüllen dann auch häufig die ursprüngliche Isoprenregel nicht, wie beispielsweise Lanosterin. Diese sind nicht vollständig in Isopreneinheiten zerlegbar.[7]
Tetracyclische Triterpene
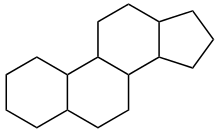
Die tetracyclischen Triterpene sind aus dem Sterangerüst (veraltet: Gonangerüst) aufgebaut. Die Verbindungen innerhalb dieser Gruppe werden auch als Steroide bezeichnet.[1] Allerdings gibt es auch Steroide, die nicht den Triterpenen zugeordnet werden. Ein Beispiel hierfür ist das häufig in tierischen Fetten auftauchende Cholesterin. Einige bedeutende Vertreter der tetracyclischen Triterpene sind in der nachfolgenden Tabelle aufgelistet:
| Untergruppen der tetracyclischen Triterpene | |||||
|---|---|---|---|---|---|
| Vertreter | Strukturformel mit grün markiertem Steran-Gerüst |
Untergruppe | Anwendungsgebiet Vorkommen | ||
| (+)-Dammar-24-en-3β-20S-diol | 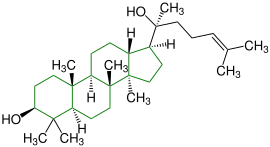 |
Dammarane |  In Pflastermasse und als Bindemittel in Lacken | ||
| (+)-Azadiron | 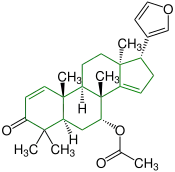 |
Apotirucallane |  Insektizide | ||
| (–)-Tirucalla-7,24-dien-3β-ol | 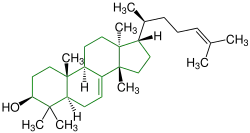 |
Tirucallane | .jpg.webp) Schwarzer Tee | ||
| Lanosterin | 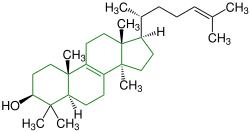 |
Lanostane |  Pilzmetaboliten, Inhaltsstoffe einer Tanne, Inhaltsstoff von Hefe (Bild) | ||
| Cimicifugenol | 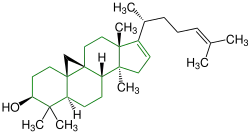 |
Cycloartane | Ersatzstoff für Östrogen | ||
| Cucurbitacin F | 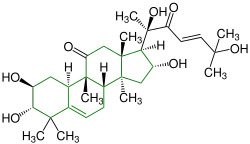 |
Cucurbitane |  pharmazeutische Verwendung (hemmt das Wachstum von Tumorzellen) | ||
Pentacyclische Triterpene
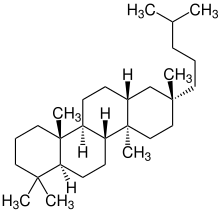
Bei den pentacyclischen Triterpenen werden den Verbindungen zwei wesentliche Grundgerüste zu Grunde gelegt, das Baccharangerüst und das Hopangerüst. In der folgenden Tabelle sind einige industriell relevante Vertreter des Baccharan-Typs aufgelistet:[1]
| Untergruppen der pentacyclischen Triterpene | |||||
|---|---|---|---|---|---|
| Vertreter | Strukturformel mit grün markiertem Baccharan-Gerüst |
Untergruppe | Anwendungsgebiet Vorkommen | ||
| (+)-1,11-Dihydroxy-20(29)-lupen-3-on | 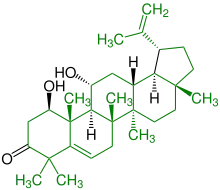 |
Lupane |  Antibiotikum, Senkung des Blut-Cholesterinspiegels, Bestandteil von Salbei-Pflanzen | ||
| Betulin | 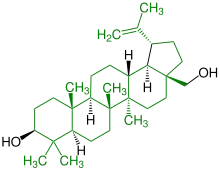 |
Lupane |  Behandlung gegen AIDS | ||
| (+)-Soyasapogenol C | 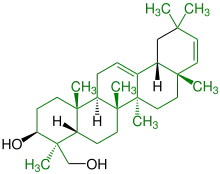 |
Oleanane |  Schaumbildner in Shampoos | ||
| (+)-Ursolsäure | 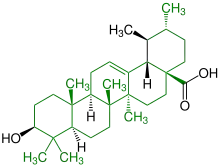 |
Ursane |  Behandlung von Leukämie, Emulgator in Lebensmitteln; kommt in Apfel- und Birnenschalen vor | ||
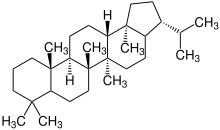
Neben dem Baccharan-Gerüst weisen einige pentacyclische Triterpene auch ein Hopan-Gerüst auf. Die Vertreter haben allerdings keine große industrielle Relevanz, kommen aber sehr wohl auch in einigen Pflanzenarten vor.[1]
Einzelnachweise
- Eberhard Breitmaier: Terpene: Aromen, Düfte, Pharmaka, Pheromone 2. Auflage, Wiley-VCH, Weinheim, 2005, ISBN 978-3-527-62369-3, S. 85 ff.
- Externe Identifikatoren von bzw. Datenbank-Links zu Achilleol A: CAS-Nummer: 125287-06-1, PubChem: 5471312, ChemSpider: 4581493, Wikidata: Q108508068.
- A. F. Barrero, E. J. Alvarez-Manzaneda R., R. Alvarez-Manzaneda R.: Achilleol A: A new monocyclic triterpene skeleton from Achillea odorata L. In: Tetrahedron Letters. Band 30, Nr. 25, 1. Januar 1989, S. 3351–3352, doi:10.1016/S0040-4039(00)99242-6.
- Kenji Shiojima, Y6ko Arai, Kazuo Masuda, Toshifumi Kamada, Hiroyuki Ageta: Fern constituents: Polypodatetraenes, novel bicyclic triterpenoids, isolated from polypodiaceous and aspidiaceous plants. In: Tetrahedron Letters. Band 24, Nr. 51, 1. Januar 1983, S. 5733–5736, doi:10.1016/S0040-4039(00)94187-X.
- Prabhakar S. Achanta, Rajesh Kumar Gattu, Adavi Rao V. Belvotagi, Raghuram Rao Akkinepally, Ravi Kumar Bobbala, Appa Rao V.N. Achanta: New malabaricane triterpenes from the oleoresin of Ailanthus malabarica. In: Fitoterapia. Band 100, 1. Januar 2015, S. 166–173.
- Ran Xu, Gia C. Fazion, Seiichi P. T. Matsuda: On the origins of triterpenoid skeletat diversity. In: Phytochemistry., Nr. 65, 2004, S. 261–291, doi:10.1016/j.phytochem.2003.11.014.
- Leopold Ruzicka: Rolle der Riechstoffe in meinem chemischen Lebenswerk, Helv. Chim. Acta 54 (1971), 1753–1759.