Chromophor
Als Chromophor (altgriechisch χρῶμα chrṓma ,Farbe‘, φορός phorós ‚tragend‘) wird die gesamte farbgebende Atom- oder Ionengruppierung einer chemischen Verbindung oder eines Werkstoffs bezeichnet. Die Farbigkeit kann durch Lichtabsorption, Lichtreflexion, Lichtstreuung oder Lichtbrechung erfolgen.


Der Begriff Chromophor wird sowohl im Zusammenhang mit organischen Farbstoffen und Pigmenten verwendet, als auch bei anorganischen Farbgläsern, bei denen die Farbigkeit durch eingelagerte Ionen (z. B. Kationen von Eisen, Nickel, Cobalt, Mangan, Kupfer und Chrom) oder durch Metallkolloide (z. B. Kupfer und Gold) verursacht wird.[1]
Bei organischen Farbmitteln enthalten die Moleküle eine chromophore Struktur mit delokalisierbaren -Elektronen. Durch selektive Lichtabsorption eines Photons passender Energie können solche Elektronen auf ein höheres Energieniveau gehoben werden; damit wird dieses Molekül in einen energetisch angeregten Zustand versetzt.[2]
Ein Chromophor ist nicht zu verwechseln mit einem pigmenttragenden Organell (Chromatophor) einer Zelle bzw. mit einer Pigmentzelle (Chromatophore).
Organische Chromophore
Organische Farbstoffe und Pigmente verfügen über Chromophore, die aus einem hochkonjugierten -Elektronensystem bestehen.
Bei all diesen Stoffen sorgt die selektive Absorption von Lichtquanten für Elektronenübergänge vom höchsten besetzten Molekülorbital (HOMO) des Chromophors zu seinem niedrigsten unbesetzten Molekülorbital (LUMO).
Typische organische Chromophore sind beispielsweise:
- Lange Ketten konjugierter Doppelbindungen wie beim Carotin oder Chlorophyll
- Durch Azogruppen (A1) verbundene Aromaten wie bei dem Azofarbstoff Methylorange (A2) mit der NR2-Gruppe (rechts) als auxochromer sowie der NaO3S-Gruppe (links) als antiauxochromer Gruppe
- Chinoide Systeme (B) wie bei Alizarin und den Triarylmethanfarbstoffen Fuchsin oder Phenolphthalein
- Nitroverbindungen (C1) wie bei dem aromatischen Nitrofarbstoff Pikrinsäure (C2) mit der OH-Gruppe als auxochromer Gruppe
A1: Azogruppe, A2: Methylorange, B: Chinoides System, C1: Nitroverbindung, C2: Pikrinsäure
Die Verbindungen verfügen oft über weitere Gruppen, welche die Farbigkeit verstärken. Gemäß der Farbstofftheorie nach Witt werden diese auch als Auxochrome bzw. auxochrome Gruppen sowie Antiauxochrome bzw. antiauxochrome Gruppen bezeichnet. So muss das Absorptionsspektrum eines Chromophors allein zunächst einmal nicht notwendig im sichtbaren Bereich des elektromagnetischen Spektrums liegen – wird der Chromophor allerdings durch den mesomeren Effekt eines weiteren Substituenten verändert, verschiebt sich damit i. d. R. auch sein Absorptionsspektrum. Wird das Absorptionsspektrum durch die Einführung einer auxochromen Gruppe in den kurzwelligeren Bereich des elektromagnetischen Spektrums verschoben, spricht man von einem hypsochromen Effekt (Blauverschiebung). Die Verschiebung in einen langwelligeren Bereich wird als bathochromer Effekt bezeichnet (Rotverschiebung).
Abhängigkeit des chromophoren Systems von der chemischen Umgebung
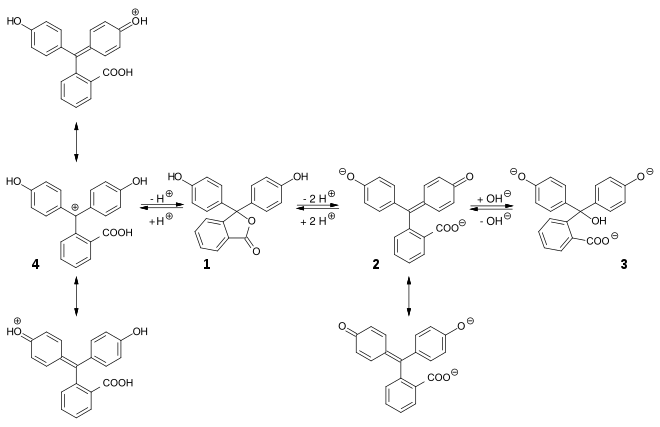
Die Indikatorreaktion des Phenolphthaleins verdeutlicht, wie die chemische Umgebung – in diesem Fall der pH-Wert – den Chromophor verändern und damit die Farbigkeit beeinflussen kann.

Durch Deprotonierung bei pH >8 bildet sich aus dem farblosen Phenolphthalein (1) unter Öffnung des Lactonrings das rot gefärbte chinoide Dianion (2), für das sich 2 mesomere Grenzstrukturen formulieren lassen. Bei pH>12 bildet sich die Hydroxy-substituierte, farblose Triphenylmethan-Verbindung 3. Unter stark sauren Bedingungen wird der Lactonring des Phenolphthaleins geöffnet und unter Wasserabspaltung bildet sich das mesomeriestabilisierte, farbige Kation 4.
Anorganische Chromophore
In anorganischen Farbstoffen beruht die Farbigkeit je nach Elektronenkonfiguration des Chromophors auf Charge-Transfer-Übergängen oder der Anregung von Elektronen der inneren Elektronenschale.

Die Mineralogie unterscheidet zwischen idiochromatischen und allochromatischen Stoffen.
- Bei idiochromatischen Stoffen ist der Chromophor direkt am Aufbau des Minerals beteiligt, z. B. beim kristallwasserhaltigen blauen Kupfersulfat (kristallwasserfreies Kupfersulfat ist weiß).

- Allochromatische Stoffe dagegen enthalten den Chromophor nur in Spuren. Rubin etwa besteht chemisch vor allem aus Aluminiumoxid, seine Farbigkeit jedoch erlangt er erst durch Spuren von Chrom, die in das Kristallgitter des Aluminiumoxids eingebaut werden.

Anorganische Chromophore sind häufig unter den Übergangsmetallen zu finden. Beispiele sind Vanadium, Chrom, Mangan, Eisen, Cobalt, Nickel und Kupfer. Je nach Oxidationsstufe und Komplexbildung können diese Elemente sehr verschiedene Farben zeigen, z. B. das deswegen auch „chemisches Chamäleon“ genannte Mangan gleich sechs verschiedene[3][4].
Siehe auch
Einzelnachweise
- Eintrag zu Chromophore. In: Römpp Online. Georg Thieme Verlag, abgerufen am 19. Juli 2019.
- Martin Klessinger: Konstitution und Lichtabsorption organischer Farbstoffe. In: Chemie in unserer Zeit. Band 12, Nr. 1, 1978, S. 1–11, doi:10.1002/ciuz.19780120102.
- Universität Regensburg: Demonstrationsvorträge in der Anorganischen Chemie – Mangan (Mn) (Memento vom 12. Juni 2007 im Internet Archive)
- Kantonsschule Baden: Das chemische Chamäleon (PDF; 260 kB)