Eschenmoser-Fragmentierung
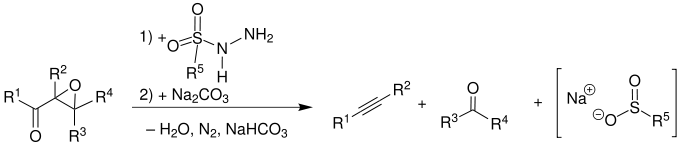
Die Eschenmoser-Fragmentierung (oft auch Eschenmoser-Ohloff- oder Eschenmoser-Tanabe-Fragmentierung genannt) ist eine Namensreaktion der Organischen Chemie. Sie beschreibt die Synthese von Alkinen und Ketonen aus α,β-ungesättigten Ketonen bzw. davon abgeleiteten α,β-Epoxyketonen. Dabei wird entweder säure- oder basenkatalytisch gearbeitet (hier basenkatalytisch mit Natriumcarbonat) und Arylsulfonsäurehydrazid benötigt. Die Reaktion ist nach ihrem Entdecker Albert Eschenmoser benannt und ging aus dessen Zusammenarbeit mit Firmenich-Forschern um Günther Ohloff bei der Synthese von Muscon und anderen makrocylischen Moschuskörpern hervor.[1][2]
Mechanismus
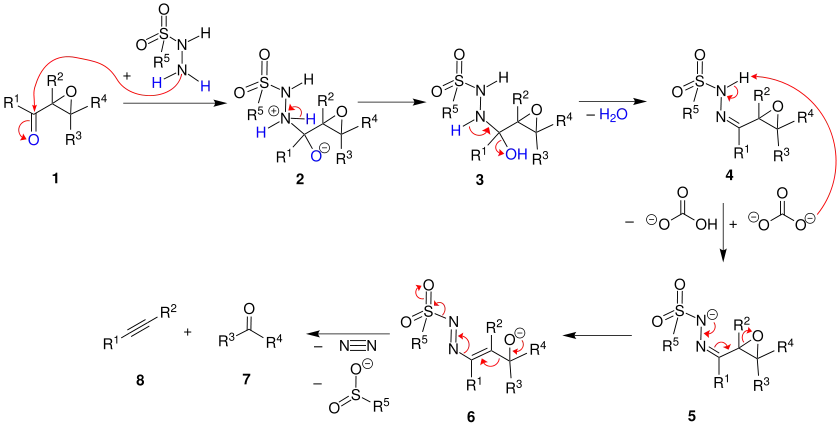
Die benötigten α,β-Epoxyketone 1 werden gewöhnlich durch Weitz-Scheffer-Epoxidierung von α,β-ungesättigten Ketonen synthetisiert. In den ersten Schritten kondensiert ein Arylsulfonsäurehydrazid (siehe erster Reaktionspfeil), zum Beispiel p-Toluolsulfonylhydrazid, mit dem Epoxyketon 1 unter Bildung des Sulfonylhydrazons 4. Der anschließende Fragmentierungs-Schritt kann dann säure- oder basenkatalysiert eingeleitet werden, wobei entweder der Epoxid-Sauerstoff protoniert, oder der Sulfonamid-Stickstoff deprotoniert wird. In beiden Fällen resultiert daraus die Verbindung 6. In diesem Mechanismus wird allerdings basenkatalytisch mit Natriumcarbonat gearbeitet. Typischerweise wird allerdings säurekatalysiert mit Eisessig in Dichlormethan bei −18 °C gearbeitet. Unter Abspaltung von Stickstoff und Arylsulfinsäure fragmentiert das Intermediat 6 zum Keton 7 und dem Alkin 8. Triebkraft der Reaktion ist die Bildung molekularen Stickstoffs.[3]
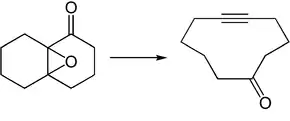
Daneben gibt es auch eine radikalische Variante dieser α,β-Enon→Alkinon-Fragmentierung mit 1,2-Dibrom-5,5-dimethylhydantoin (DDH) in sek-Butanol, die ohne Epoxidierung auskommt und direkt vom α,β-ungesättigten Hydrazon ausgeht.[4] Dabei findet eine Allylbromierung mit DDH am Sulfonamid-Stickstoff, der capto-dativ-stabilisierten Radikalstelle statt, und das Bromid-Ion fungiert als Abgangsgruppe bei dem sich anschließenden nukleophilen Angriff eines Alkoholat-Ions. Diese Fehr-Ohloff-Büchi-Variante der Eschenmoser-Ohloff-Fragmentierung umgeht damit den Epoxidations-Schritt, der bei sterisch anspruchsvollen Substraten häufig zu schlechten Ausbeuten der klassischen Eschenmoser-Fragmentierung führt. Durch die Verwendung bicyclischer Epoxyketone, die das Epoxid an beiden Brückenköpfen tragen, werden cyclische 1,6-Inone erhalten, was zur Synthese von Makrocyclen von Bedeutung ist.
Einzelnachweise
- J. Schreiber u. a.: Die Synthese von Acetylen-carbonyl-Verbindungen durch Fragmentierung von α, β-Epoxy-ketonen mit p-Toluolsulfonylhydrazin. Vorläufige Mitteilung. In: Helvetica Chimica Acta. 50, Nr. 7, 1967, S. 2101–2108, doi:10.1002/hlca.19670500747.
- Dorothee Felix, J. Schreiber, G. Ohloff, A. Eschenmoser: α, β-Epoxyketon → Alkinon-Fragmentierung I: Synthese von exalton und rac - muscon aus cyclododecanon über synthetische methoden, 3. Mitteilung. In: Helvetica Chimica Acta. 54, Nr. 8, 1971, S. 2896–2912, doi:10.1002/hlca.19710540855.
- Z. Wang: Comprehensive Organic Name Reactions and Reagents. Volume 1, Wiley, 2009, ISBN 978-0-471-70450-8 (3-Volume Set), S. 1005.
- Charles Fehr, Günther Ohloff, George Büchi: A New α,β-Enone → Alkynone Fragmentation. Syntheses of exaltone® and (±)-muscone. In: Helvetica Chimica Acta. 62, Nr. 8, 1979, S. 2655–2660, doi:10.1002/hlca.19790620815.