Enone
Als Enone werden in der Organischen Chemie Ketone bezeichnet, die außer der C=O-Doppelbindung (für die im systematischen Substanznamen das Suffix –on steht) noch eine C=C-Doppelbindung (Suffix –en) enthalten. Sprachlich verkürzt wird die Stoffgruppe solcher Substanzen als En-one bezeichnet. Das Kohlenstoffgerüst der Enone kann ringförmig (cyclisch) oder acyclisch sein; auch Kombinationen dieser Skelette sind möglich.
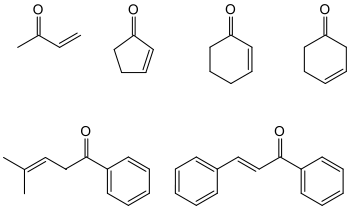
Eine ältere Bezeichnung ist „ungesättigte Ketone“. Nach der Stellung (siehe Ständigkeit) der C=C-Doppelbindung unterscheidet man α,β-ungesättigte Ketone von β,γ-ungesättigten, γ,δ-ungesättigten etc. Ketonen, wobei α für ein dem Kohlenstoffatom der Carbonylgruppe benachbartes C-Atom steht.
In den α,β-ungesättigten Ketonen sind die beiden Doppelbindungen "konjugiert". Häufig sind α,β-ungesättigte Ketone thermodynamisch stabiler als ihre Doppelbindungsisomere. Daher wird der Begriff „Enone“ oft auf erstere beschränkt.
Nomenklatur
Griechische Buchstaben werden in der Organischen Chemie jedoch auch zur Beschreibung anderer Strukturen verwendet, z. B. in der Stereochemie, oder zur Benennung von Kristall-Modifikationen. Die Positionsangaben mit griechischen Buchstaben sind aber in der Historie der Organischen Chemie verankert und werden sich daher wohl kaum „ausrotten“ lassen. Aber in der Nomenklatur einzelner Verbindungen sollten sie nach Möglichkeit vermieden werden.
Bei acyclischen Ketonen nummeriert man die längste Kette von Kohlenstoffatomen wie bei den Alkanen. Dadurch wird der Carbonylgruppe ihre Stellungsbezifferung und das Suffix –on zugewiesen. Anschließend trägt man die Position der C=C-Doppelbindung ein, wie bei der Bezifferung der Alkene.
Bei cyclischen Ketonen hat die C=O-Gruppe den höchsten Rang und erhält daher die Nummer 1. Die Nummern (Lokanten) der C=C-Doppelbindung sollen möglichst niedrig sein (ausgehend vom O=C-Atom kann man im Uhrzeiger- oder Gegen-Uhrzeigersinn zählen).
Viele Enone enthalten bicyclische oder polycyclische Kohlenstoffgerüste, z. B. Steroide. In diesen Fällen bestimmt die spezielle Bezifferung dieser Ringe die Stellung des "-on".
Traditionell werden viele Enone mit ihren Trivialnamen benannt, vor allem Naturstoffe. Ein lehrreiches Beispiel ist Carvon: 2-Methyl-5-isopropenyl-2-cyclohexen-1-on, exakter: 2-Methyl-5-(1-methylethenyl)-cyclohex-2-en-1-on.
Besondere Eigenschaften α,β-ungesättigter Ketone
Während sich in den nicht-konjugierten Enonen C=C- und C=O-Doppelbindungen in der Regel nicht beeinflussen, tritt bei Enonen eine elektronische Wechselwirkung zwischen den beiden funktionellen Gruppen auf, die mit dem Begriff Konjugation beschrieben wird. Voraussetzung ist, dass die vier Atome des Enon-Systems (C=C-C=O) in einer Ebene liegen, oder von dieser nur wenig abweichen. Mit anderen Worten sollte das Enon-System in einer möglichst planaren Konformation vorliegen.
Die Delokalisation der π-Elektronen kann durch folgende mesomere Grenzstrukturen dargestellt werden:
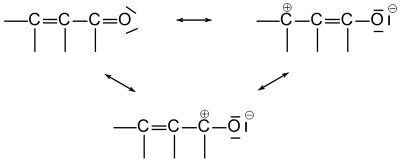
- Grenzstrukutrformeln des Enon-Systems
Das Enon-System ist isoelektronisch mit dem 1,3-Dien-System (Prototyp 1,3-Butadien); jedoch erlangt die polare Grenzstruktur (rechts) ein höheres Gewicht, wenn das endständige C-Atom im Kohlenwasserstoff gegen ein Sauerstoffatom ausgetauscht wird. Denn Sauerstoff hat eine höhere Elektronegativität als Kohlenstoff, und „zieht die Elektronen daher stärker an sich“ (salopp ausgedrückt). Aus dieser Betrachtung wird auch verständlich, dass – verglichen mit „normalen“ Ketonen – die O=C-Bindung länger ist, und die formale Einfachbindung =C-C= kürzer.
Eine zweite Möglichkeit, die Enon-Funktion zu beschreiben, bietet die Molekülorbitaltheorie, wobei schon die einfache Hückel-Näherung[1] entscheidende Trends erkennen lässt. Die π-Molekülorbitale (π-MOs) sind polarisiert.
Die besonderen Bindungsverhältnisse in den Enonen bewirken unter anderem charakteristische Veränderungen in den IR-Spektren und UV-Spektren im Vergleich mit einfachen Ketonen.
Reaktivität α,β-ungesättigter Ketone
Enone sind bifunktionelle Verbindungen; daher sind bei nicht-konjugierten Enonen die für die O=C- und die C=C-Funktion (Alken und Keton) charakteristischen Reaktionen möglich. In der Regel finden Reaktionen mit elektrophilen Agenzien an der C=C-Doppelbindung statt, während Nukleophile am Kohlenstoffatom der Carbonylgruppe angreifen.
Bei den α,β-ungesättigten Ketonen ist jedoch das π-Elektronensystem delokalisiert. Hinsichtlich ihrer Reaktivität muss daher die Enon-Funktion als Einheit betrachtet werden. Dadurch wird die Reaktivität dieser Enone im Vergleich zu "normalen" Ketonen verändert. Zwar wird die Addition von Nukleophilen an das Kohlenstoffatom der Carbonylgruppe häufig beobachtet, aber ein weiterer Reaktionstyp ist die Assoziation eines Nukleophils mit dem β-Kohlenstoffatom des Enon-Systems, die sogenannte ‚‘konjugierte Addition‘‘ (engl. conjugate addition). Hierzu gehört die Michael-Addition und viele Reaktionen mit metallorganischen Verbindungen. Betrachtet man die polaren Grenzstrukturformeln (siehe oben), so wird dies plausibel.
Für das Verständnis der Reaktivität haben sich jedoch die Modelle der Molekülorbitaltheorie als besser geeignet erwiesen. Im Rahmen der Theorie der Grenzorbitale (HOMO-LUMO-Wechselwirkungen) sind konjugierte Enone durch LUMOs ausgezeichnet, die in der Energieskala relativ niedrig liegen. Bei Reaktionen mit nukleophilen Agenzien ist – abgesehen von Coulomb-Kräften – in erster Näherung die Wechselwirkung des Enon-LUMOs mit dem HOMO eines Nukleophils wichtig. Die MO-Koeffizienten am Carbonylkohlenstoffatom und β-Kohlenstoffatom unterscheiden sich in ihrer Größe; weiche Nukleophile haben daher die Tendenz, an letzterem anzugreifen.[2] Dies gilt auch für viele Radikale.
Synthesen α,β-ungesättigter Ketone
Zur Herstellung von Substanzen dieser Verbindungsklasse wurden zahlreiche Methoden entwickelt, von denen jedoch in diesem Rahmen nur eine Auswahl besprochen werden kann. Für die praktische Anwendung ist entscheidend, dass die Edukte, die Ausgangsmaterialien, leicht zugänglich und möglichst billig sind.
Alle Ketone können als Produkte der Dehydrierung (Oxidation) sekundärer Alkohole betrachtet werden. Falls die entsprechenden ungesättigten Alkohole zur Verfügung stehen, ist ihre Oxidation möglich. Verglichen mit den gesättigten Alkoholen erfolgt sie unter "milderen" Bedingungen, z. B. mit Mangandioxid. Ein Beispiel ist die Synthese von 2-Cyclopentenon.
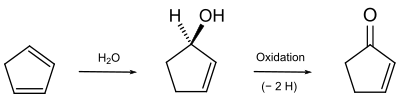
Aus Cyclopentadien entsteht in einer 1,4-Addition von Wasser 2-Cyclopentenol. Dieses wird durch wässrige Chromsäure zum Keton oxidiert.
Im Prinzip können auch gesättigte Ketone dehydriert werden, aber eine selektive Dehydrierung in α,β-Stellung ist schwierig. Ein „klassischer“ Umweg ist die Halogenierung gesättigter Ketone in α-Stellung; aus den gebildeten α-Halogenketonen kann in der Regel durch Basen Halogenwasserstoff abgespalten werden (α,β-Elimination). Als Halogen wird meistens Brom gewählt. Aus einigen α,α'-Dibromketonen konnten so Dienone erhalten werden, so 4,4-Dimethyl-2,5-cyclohexanon[3].[4]
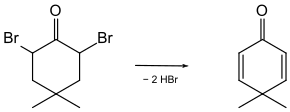
4,4-Dimethyl-2,5-cyclohexadienon aus 2,6-Dibrom-4,4-dimethylcyclohexanon. Als Base wird Calciumcarbonat in Dimethylformamid (DMF) verwendet.
Das älteste Syntheseprinzip ist die Kondensation von Aldehyden oder Ketonen mit einem anderen Keton ("Aldolkondensation"). So wurden Benzylidenaceton, Dibenzylidenaceton, Benzylidenacetophenon oder Mesityloxid erstmals gewonnen. Die Halbtrivialnamen der ersten drei Beispiele zeigen noch heute die Herkunft dieser Verbindungen an.
Man kennt auch intramolekulare Varianten dieser Reaktion: Manche Dicarbonylverbindungen liefern Cycloalkenone. Beispielsweise lässt sich Undecan-2,5-dion zu Dihydrojasmon cyclisieren, einem wichtigen Riechstoff.[5]
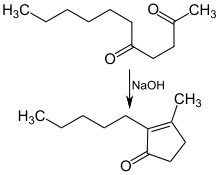
Cyclisierung von Undecan-2,5-dion zu Dihydrojasmon. Die Reaktion wird in siedendem Ethanol mit 2-prozentiger wässriger Natronlauge als Katalysator durchgeführt.
Einzelnachweise
- E. Heilbronner, H. Bock: Das HMO-Modell und seine Anwendung. Bd. 2, Verlag Chemie, Weinheim 1970, S. 165 und 170.
- Ian Fleming: Frontier Orgitals and Organic Chemical Reactions. Wiley, London u. a. 1976, S. 70, 163; Deutsche Ausgabe: Ian Fleming: Grenzorbitale und Reaktionen organischer Verbindungen. übersetzt von Henning Hopf. VCH, Weinheim/ Basel/ Cambridge 1990, ISBN 3-527-25792-6.
- Externe Identifikatoren von bzw. Datenbank-Links zu 4,4-Dimethylcyclohexadienon: CAS-Nummer: 1073-14-9, PubChem: 556333, ChemSpider: 483656, Wikidata: Q82108469.
- F. G. Bordwell, K. M. Wellman: In: J. Org. Chem. 28, (1963), S. 2544.
- Heinz Hunsdiecker: Über das Verhalten der γ-Diketone, I. Mitteilung. In: Berichte der deutschen chemischen Gesellschaft. Band 75, Nr. 5, 6. Mai 1942, S. 447–454, doi:10.1002/cber.19420750502.
Literatur
- Saul Patai (Hrsg.): The chemistry of enones (The chemistry of functional groups). Wiley, Chichester u. a. 1989.
- Teil 1: ISBN 0-471-91563-7.
- Teil 2: ISBN 0-471-92289-7.