Eschenmosersalz
Das Eschenmosersalz ist ein organisches Salz. Es besteht aus einem N,N-Dimethylmethyliden-Kation meist mit einem Iodidion als Gegenion. Auch andere Gegenionen wie Chlorid- oder Nitrationen werden häufig eingesetzt. Das Salz ist benannt nach seinem Entwickler, dem Schweizer Chemiker Albert Eschenmoser.
| Strukturformel | |||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
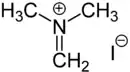 | |||||||||||||||||||
| Allgemeines | |||||||||||||||||||
| Name | Eschenmosersalz | ||||||||||||||||||
| Andere Namen |
N,N-Dimethylmethaniminiumiodid (IUPAC) | ||||||||||||||||||
| Summenformel | C3H8IN | ||||||||||||||||||
| Kurzbeschreibung |
hellgelber Feststoff[1] | ||||||||||||||||||
| Externe Identifikatoren/Datenbanken | |||||||||||||||||||
| |||||||||||||||||||
| Eigenschaften | |||||||||||||||||||
| Molare Masse | 185,01 g·mol−1 | ||||||||||||||||||
| Aggregatzustand |
fest | ||||||||||||||||||
| Schmelzpunkt | |||||||||||||||||||
| Löslichkeit |
Zersetzung in Wasser[1] | ||||||||||||||||||
| Sicherheitshinweise | |||||||||||||||||||
| |||||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | |||||||||||||||||||
Das Eschenmosersalz wird zur Dimethylaminomethylierung verwendet, es kann mit ihm also eine Dimethylaminomethyl-Funktion eingeführt werden. Hierzu wird das Salz mit einem Nukleophil umgesetzt. Dieses greift hierzu am Kohlenstoffatom der Doppelbindung an.
Darstellung
Es existieren mehrere Wege zur Synthese von Eschenmosersalz. Von diesen basieren viele auf der Umsetzung von N,N,N',N'-Tetramethylmethandiamin mit iodhaltigen Elektrophilen wie Diiodmethan[3] oder Trimethylsilyliodid.[4] Ein neuerer Ansatz geht vom Hydroiodid des Dimethylamins und Formaldehyd aus.[5]
Siehe auch
Einzelnachweise
- Datenblatt Dimethylmethylenammoniumiodid bei AlfaAesar, abgerufen am 14. April 2010 (PDF) (JavaScript erforderlich).
- Datenblatt N,N-Dimethylmethyleneiminium iodide bei Sigma-Aldrich, abgerufen am 12. Oktober 2016 (PDF).
- G. R. Clark, G. L. Shaw, P. W. J. Surman, M. J. Taylor, D. Steele: Preparation, Structure and Vibrational Spectrum of the Dimethylmethyleniminium Ion, including the Role of Cationic Polymers in its Formation. In: Journal of the Chemical Society, Faraday Transactions. Band 90, Nr. 20, 1994, S. 3139–3144, doi:10.1039/FT9949003139.
- T. A. Bryson, G. H. Bonitz, C. J. Reichel, R. E. Dardis: Preformed Mannich Salts: A Facile Preparation of Dimethyl(methylene)ammonium Iodide. In: Journal of Organic Chemistry. Band 45, Nr. 3, 1980, S. 524–525, doi:10.1021/jo01291a032.
- Tehrani, K. Abbaspour; De Kimpe, N.: Science of Synthesis. Band 27, 2004, Product class 8: iminium salts, S. 313–348.
