Hexamethylentriperoxiddiamin
Hexamethylentriperoxiddiamin, häufig als HMTD abgekürzt, ist eine organische Verbindung, ein Amin mit drei Peroxidgruppen.
| Strukturformel | |||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
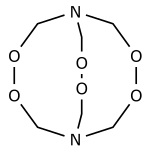 | |||||||||||||
| Allgemeines | |||||||||||||
| Name | Hexamethylentriperoxiddiamin | ||||||||||||
| Andere Namen |
| ||||||||||||
| Summenformel | C6H12N2O6 | ||||||||||||
| Kurzbeschreibung |
weiße Kristalle[1] | ||||||||||||
| Externe Identifikatoren/Datenbanken | |||||||||||||
| |||||||||||||
| Eigenschaften | |||||||||||||
| Molare Masse | 208,1 g·mol−1 | ||||||||||||
| Aggregatzustand |
fest | ||||||||||||
| Dichte |
1,57 g·cm−3[1] | ||||||||||||
| Schmelzpunkt |
rasche Zersetzung ab 150 °C[1] | ||||||||||||
| Löslichkeit |
nahezu unlöslich in Wasser und organischen Lösungsmitteln [1] | ||||||||||||
| Sicherheitshinweise | |||||||||||||
| |||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | |||||||||||||
Hexamethylentriperoxiddiamin wurde erstmals 1885 von Ludwig Legler in Dresden aus Ammoniak und Lampensäure (einem Gemisch aus Essigsäure, Acetaldehyd und Ameisensäure[3]) hergestellt.[4] Im Jahr 1900 gelang Baeyer und Villiger die Darstellung aus Ammoniumsulfat, Formaldehyd und Wasserstoffperoxid. Conway Freiherr von Girsewald aus Berlin-Halensee meldete es im Jahre 1912 als Initialsprengstoff zum Patent an und entwickelte ein noch heute angewendetes Verfahren zur Synthese.
Gewinnung und Darstellung
Die Darstellung erfolgt nach dem 1912 erstmals beschriebenen Verfahren durch Umsetzung von Hexamethylentetramin mit Wasserstoffperoxid und Citronensäure als Katalysator.[1] Bei der Herstellung ist zu beachten, dass die Reaktion stark exotherm verläuft. Wenn die Temperatur ansteigt, verringert sich zunächst die HMTD-Bildung, bei zu hohen Temperaturen kann es bereits bei der Synthese zur Explosion kommen.
Eigenschaften
Reines Hexamethylentriperoxiddiamin ist ein kristalliner, weißer Feststoff. Die Verbindung ist in Wasser und den meisten organischen Lösungsmitteln nur schwer löslich. HMTD ist ein relativ stabiles organisches Peroxid. Allerdings führt bereits heißes Wasser zur Zersetzung unter Sauerstoffentwicklung. Getrocknetes Hexamethylentriperoxiddiamin ist ein äußerst wirkungsvoller Initialsprengstoff; die Einwirkung von Schlag, Hitze, Reibung oder Funken kann zur Detonation führen. Auch bei Druck mit Metallspateln oder anderen harten Gegenständen sowie UV-Lichteinwirkung kann das Peroxid – wie fast alle Initialsprengstoffe – detonieren. HMTD bildet selbst niemals große Kristalle. Auch bei längerer Lagerung über mehr als 12 Monaten bei 40 °C beträgt die Sublimationsrate nur 0,02 % bei unveränderter Kristallgröße, während jedoch eine Zersetzung stattfindet.[1]

| Bildungsenergie | −1610,6 kJ·kg−1[1] |
| Bildungsenthalpie | −1729,7 kJ·kg−1[1] |
| Sauerstoffbilanz | −92,2 %[1] |
| Stickstoffgehalt | 13,46 %[1] |
| Normalgasvolumen | 1247 l·kg−1[1] |
| Explosionswärme | 3369 kJ·kg−1 (H2O (l)) 3128 kJ·kg−1 (H2O (g))[1] |
| Spezifische Energie | 855 kJ·kg−1 (87,2 mt/kg)[1] |
| Bleiblockausbauchung | 33 cm3·g−1 (Pikrinsäure 31,5 cm3·g−1)[1] |
| Verpuffungspunkt | 200 °C (Zersetzung ab 149 °C, Explosion ab 130 °C möglich) |
| Detonationsgeschwindigkeit | 4500–5100 m·s−1 |
| Schlagempfindlichkeit | 0,6 Nm[1] |
| Reibempfindlichkeit | 0,1 N[1] |
Verwendung
HMTD wurde als Initialsprengstoff für unempfindlichere Sprengstoffe erprobt und erwies sich dabei dem Quecksilberfulminat als überlegen. In offener Anhäufung verpufft es auch in größeren Mengen (einige Gramm) nur, während es bei geringem Einschluss oder gar gepresst bereitwillig durchdetoniert. Es fand aber trotzdem keine praktische Verwendung, da es mechanisch und gegen Feuchtigkeit instabil ist und sich bei Lagerung allmählich zersetzt.[1] Es ist weniger schlagempfindlich als viele andere Initialsprengstoffe, besitzt jedoch eine erhebliche Sprengkraft und zerkleinert im Sand-Test etwa 2,5- bis 3-mal mehr Sand als Quecksilberfulminat. HMTD explodiert beim sogenannten Fallhammerversuch bereits mit einem 2 kg schweren Fallhammer aus einer Fallhöhe von 10 cm.
Sicherheitshinweise
Hexamethylentriperoxiddiamin ist ein Initialsprengstoff und daher besonders explosionsgefährlich. Es kann durch erhöhte Temperatur, Zündquellen oder mechanische Einwirkung wie Reibung oder Stoß zur Explosion kommen, aber auch, wenn es UV-Strahlung oder Sonnenlicht ausgesetzt wird. Ebenso kann es bei Kontakt mit anderen chemischen Verbindungen und Elementen, insbesondere mit Metallen, oder bereits durch eigene Zersetzungsprodukte bei längerer Lagerung detonieren. Bei unzureichender Kühlung während des Herstellungsprozesses kann es ebenfalls auf ungewünschte Art und Weise reagieren. Beim Umgang sind größte Vorsicht und Sorgfalt walten zu lassen und besondere Vorkehrungen zu treffen. Auch unter Wasser gelagert ist es explosionsfähig, zersetzt sich jedoch bereits bei Raumtemperatur langsam. Der Umgang mit mehr als Kleinstmengen ist unverantwortlich, da die Gefahr einer Spontanreaktion allgegenwärtig ist.
Recht
In Deutschland unterliegt HMTD dem Sprengstoffrecht (insbesondere der Erlaubnispflicht nach § 7 und § 27 Sprengstoffgesetz, sofern keine Ausnahmen für Forschung und Lehre nach der 1. Verordnung zum Sprengstoffgesetz greifen).
Literatur
- Alfred Stettbacher: Die Schieß- und Sprengstoffe. 2., umgearbeitete Auflage. Barth, Leipzig 1933
Einzelnachweise
- Josef Köhler, Rudolf Meyer, Axel Homburg: Explosivstoffe. 10., vollständig überarbeitete Auflage. Wiley-VCH, Weinheim 2008, ISBN 978-3-527-32009-7, S. 158, doi:10.1002/9783527623402.ch8.
- Dieser Stoff wurde in Bezug auf seine Gefährlichkeit entweder noch nicht eingestuft oder eine verlässliche und zitierfähige Quelle hierzu wurde noch nicht gefunden.
- Martin Martens: Ueber die Producte der langsamen Verbrennung des Alkohols und Aethers um einen Platindraht. In: Archiv der Pharmazie. Bd. 70 = Reihe 2, Bd. 20, Nr. 1, 1839, S. 181–188.
- Ludwig Legler: Ueber Producte der langsamen Verbrennung des Aethyläthers. In: Berichte der Deutschen Chemischen Gesellschaft. Bd. 18, Nr. 2, 1885, S. 3343–3351, doi:10.1002/cber.188501802306.